甘草甜素对HepG2.2.15细胞株HBeAg水平及TLR4表达的影响*
2010-11-03李永伟杨宏志郭云蔚陆慧琼凌小强
李永伟,杨宏志,郭云蔚,陆慧琼,凌小强
(中山大学附属第三医院 1中医科,2消化内科,3中心实验室,4感染病科,广东 广州 510630)
甘草类制剂如甘利欣、复方甘草甜素(olycyrrhizin,GL)可影响 HBV 复制或抗原分泌[1~3],甘草甜素是中药甘草中的主要有效成分。基础和临床研究表明,GL具有抗炎、抗纤维化、降酶、退黄及免疫调节等作用,被广泛用于治疗各种急慢性肝炎。某些研究者认为,GL可诱生干扰素抑制HBV[1,2]。目前在体外实验发现,Toll样受体(Toll-like receptor,TLR)是激活后产生干扰素的重要信号分子,可促进抗病毒的细胞免疫,具有抑制病毒复制的作用[3]。本实验研究了GL体外对HBeAg的作用及对TLR4信号分子的影响,以了解该药的作用机制。
1 材料与方法
1.1 材料
DMEM 培养基(GIBCO公司),G418和MTT(Sigma公司),胎牛血清( GBico公司),96孔、6孔培养板及25 cm2培养瓶(COSTER公司),酶标仪(BIO-RAD、Model 450 MICRoPLATE READER),ELISA试剂盒购自中山生物公司,Real-time PCR检测试剂盒购自中山大学达安基因公司,甘草甜素GL(商品名:美能)由日本美能生源制药公司生产,TLR4抗体购自eBioscience公司,HepG2.2.15细胞株由本实验室保存。其他试剂来自于广东省肝脏疾病研究重点实验室。
1.2 实验分组及药物浓度设定
将GL按原药物浓度用DMEM倍比稀释成5个浓度梯度:800、400、200、100、50μg/mL;并设空白对照组。
1.3 细胞培养
将HepG2.2.15细胞铺于六孔板,接种于DMEM混合培养液(含1O%胎牛血清、G418 200μg/mL),置5%二氧化碳培养箱中37℃培养,每3天换液一次,每孔加培养液至2mL,第5、6天加入相应剂量GL,共2次。 第7天收集细胞行流式细胞仪检测,每剂量组3个复孔,分3次独立实验完成。
1.4 细胞存活率测定
药物细胞毒性实验系通过MTT法测定细胞存活率。细胞接种于96孔板,接种第5,6天给药,第7天加入1mg/mL MTT液每孔20μL,于5%二氧化碳培养箱中37℃培养4 h,吸弃上清液,每孔加入DMSO 200μL。细胞存活率%=实验孔OD值/对照孔OD值×100%。
1.5 检测细胞培养上清中HBeAg水平
取收集的上清液,用ELISA法检测,按试剂盒说明书操作,含量直接用OD值表示。
1.6 直接免疫荧光流式细胞术检测TLR4表达
给药后第7天收集细胞,加DMEM培养基1 000 r/min 离心 3~5min,去掉培养基,500μL PBS重悬细胞,取100μL细胞悬液,分别加TLR4标记抗体各 10μL,混匀,避光孵育 20~30min,加 PBS 2 mL,2 000 r/min离心 5min,弃上清,加 1mL PBS 重悬上机,同型对照加无关抗体消去本底。
1.7 荧光定量PCR检测TLR4 m RNA的表达
培养至第七天收集细胞并提取总RNA(Qiagen RNeasy Mini Kit,Gene copmpany),逆转录为第一链cDNA(RevertAidTM First Strand cDNA Synthesis Kit,#K1621,Fermatas),两步法定量PCR(SYBR Premix Ex TaqTM(Perfect Real Time)Kit TaKaRa,DRR041S,宝生物工程(大连有限公司))检测TLR4的表达水平。β-actin:正向引物:TGGCACCCAGCA CAATGAA,反向引物:CTAAGTCATAGTCCGCCTAGAAGCA;TLR4正向引物:TCAGGTCCAGGTTCTTG GTTGAG,反向引物:AGGATGATGCCAGGATGATGTC。
1.8 统计学分析
2 结果
2.1 GL对HepG2.2.15细胞增殖活性的影响
结果显示,细胞增殖活性随GL量的增加,由促进增殖而变为抑制增殖,即较小剂量促进细胞生长。其中,50μg/mL组与对照组比较差异有统计学意义,P<0.05;200μg/mL 以下三组间差异不显著,P>0.05;400μg/mL以上剂量则开始变为抑制细胞增殖,400μg/mL与800μg/mL分别与其它各组比较差异有显著性,P<0.01。尤其是800μg/mL更为明显,存活率只有20.7%。见表1。本结果与文献报道一致[1]。
2.2 不同剂量GL干预后细胞培养上清HBeAg的表达
HBeAg的表达结果显示,GL各剂量组给药后第7天总体均数间差异显著,有统计学意义(P<0.05);200μg组以下虽然降低,但与对照组比较无显著差异;400μg以上组HBeAg升高,但与对照组比较无显著差异;800μg/mL组较 100、200μg/mL组明显升高,差异有统计学意义,P<0.05。见表1。
2.3 GL治疗各组及对照组TLR4阳性细胞率的表达
治疗后48 h流式细胞仪检测TLR4阳性细胞率的表达,各组表达TLR4的阳性细胞率总体均数间差别有统计学意义。各剂量组与对照组比较,显示表达TLR4的阳性细胞率均显著增加,差异有统计学意义(P<0.01),尤其100μg/mL组最明显,与其他各组相比差异均有统计学意义(P<0.01)。见表1。
2.4 GL治疗各组及对照组TLR4mRNA的表达
治疗后RT-PCR检测TLR4 mRNA的表达,各组表达TLR4水平总体均数间差别有统计学意义。各剂量组与对照组比较显示TLR4水平均显著增加,差异有统计学意义(P<0.01),尤其100μg/mL组最明显,与其他各组相比差异均有统计学意义(P<0.01)。见表1。
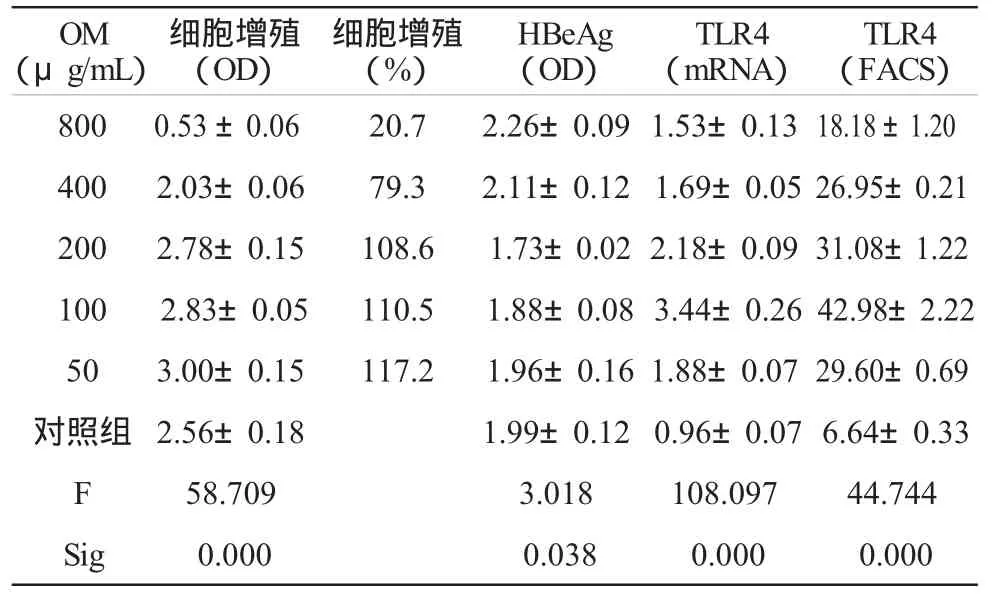
表1 GL对HepG2细胞的影响
2.5 GL干预后各指标的相关性
GL干预后,MTT结果与HBeAg呈显著负相关(r=-0.584,Sig=0.003);TLR4 mRNA 与 TLR4 流式结果呈显著正相关(r=0.881,Sig=0.000)。TLR4 mRNA及TLR4流式结果分别与MTT、HBeAg比较无相关关系(P>0.05)。
3 讨论
TLR为I型跨膜蛋白,是连接先天和后天免疫的关键信号分子。TLR参与机体免疫反应,可促进细胞因子的合成与释放、促使免疫细胞成熟、分化,调节适度水平的免疫应答,因而可起到抗病毒的作用[4],但也引起肝脏损伤。近来的研究显示,TLR信号系统可能在肝脏疾病包括丙型病毒(HCV)性肝炎的发生及免疫介导的肝细胞损伤中起重要作用。其中,HCV的蛋白成分可直接调节TLR家族的信号分子,是HCV持续感染的机理之一[5]。HBV的核心抗原可促使人类的THP-1巨噬细胞分泌细胞因子,这一作用依赖于TLR2介导的核转录因子的激活[6]。体内外实验发现,HBeAg可下调TLR2的表达[7,8]。但TLR2与其配体在乙肝转基因小鼠没有抗病毒作用,而TLR4与其配体则可有效抑制病毒[3]。在免疫低下的慢乙肝患者,可出现肝细胞TLR的表达并直接导致肝损伤,提示TLR信号途径激活产生IFN的同时,也可能激活了炎症因子导致肝细胞的病理性损害[9]。我们既往研究发现,在HBV持续感染的HepG 2.2.15细胞株TLR2、TLR4表达降低,表明HBV慢性感染可能需要TLR的低表达以逃避免疫清除,而GL可上调TLR水平,以100μg/m L组最为显著,但200μg/m L组作用较其它组弱[10];本研究与既往研究不同的是200μg/m L组对TLR4的调节仍较强,可能与两次研究所用细胞株不同有关,此次为HBV野生型的细胞株。
在临床病例中发现,慢乙肝轻度患者血清IL-2、IFNγ基本正常,但随着炎症的加重逐渐减少,慢性重型肝患者浓度则最低,上述Th1类细胞因子的低表达是病毒不能清除的原因之一[11]。有人认为,GL抗病毒的机理可能与诱生干扰素有关 ,干扰素产生的重要途径为TLR信号家族途径,GL有可能通过影响TLR信号分子的表达来促进干扰素产生。李金兴研究了GL对单个核细胞的影响,其产生干扰素的最适剂量为100μg/mL12]。我们两次结果均提示100μg/mL组表达TLR2、TLR4的阳性细胞数最多[10],可能与干扰素的产生有一定关系。
GL对TLR4的上调可能有助于打破慢乙肝的免疫耐受状态,通过调节先天免疫而激活抗病毒效应。MATTEO认为,在缺乏适应性免疫的情况下,先天免疫如TLR信号家族并不能显著的导致肝脏损伤及病毒清除[13],与GL体外非免疫细胞介导抑制Alexander细胞表面抗原[14]不同的是,如GL在体内激活免疫细胞的TLR,可进一步诱导特异性的细胞免疫,从而促进HBV清除,并且因GL具有抗炎作用,在抑制HBV的同时如何减轻TLR导致的病理损伤,需要进一步研究其作用机理及其中的复杂关系。
本文还研究了GL对HepG2.2.15细胞株抗原分泌的作用,发现GL既可能抑制、也可能促进e抗原分泌,即对HBV的抗原分泌具有双向作用,但差异无统计学意义。本实验还研究了GL对细胞增殖的影响,我们采用最后两天持续给药的方法,发现GL对细胞株增殖的影响与文献其它给药方法产生的结果类似,表现为中小剂量促进增殖,大剂量抑制细胞增长[1],其机理需要深入研究。
[1]杨 京,喻成波,席宏丽等.甘草甜素联合单磷酸阿糖腺苷对HepG2.2.15细胞及其HBsAg表达的影响 [J].贵州医药,2006,30(6):483-485.
[1]YANG J,YU CB,XI HL,et al.Effects of GL combined with Ara-AMP on HBsAg expression and survival rate of HepG2.2.15 cell lines[J].Gui Zhou Medical Journal,2006,30(6):483-485.Chinese
[2]宋星宏.甘草甜素治疗慢性乙型肝炎疗效观察[J].中国中西医结合杂志,1997,17(8):494-495.
[2]SONG XH.The observation of effect of Types of Chronic Hepatitis B treated with glycyrrhizin[J].Chinese Journal of Integrative Medicine.1997,17(8)494-495.Chinese
[3]MASANORI I,MICHAEL D.R,YOSHIHIRO F,et al.Toll-Like Receptor Signaling Inhibits Hepatitis B Virus Replication In Vivo[J].Journal of Virology,2005,6:7269-7272
[4]BIEBACK K,LIEN E,KLAGGE IM,et al.Hemagglutinin protein of wild-type measles virus activates toll-like receptor 2 signaling[J].J Virology,2002,76(17):8729-8736.
[5]KUI LI,EILEEN FOY,JOSEPHINE C.ERREON,et al,Immune evasion by hepatitis C virus NS3_4A protease-mediated cleavage of the Toll-like receptor3 adaptor protein TRIF [J].Proceedings National Academy Science of USA,2005,102(8):2992-2997.
[6]COOPER A,TAL G,LIDER O,et al,Cytokine Induction by the Hepatitis B Virus Capsid in Macrophages Is Facilitated by Membrane Heparan Sulfate and Involves TLR2[J].Journal Immunology,2005,175(5):3165-3176.
[7]RIORDAN SM,SKINNER N,KURTOVIC J,et al,Reduced Expression of Toll-Like Receptor 2 on Peripheral Monocytes in Patients with Chronic Hepatitis B [J].Clinical Vaccine Immunology,2006,13(8):972–974.
[8]VISVANATHANK K,SKINNER NA,THOMPSON AJ,et al,Regulation of Toll-Like Receptor-2 Expression in Chronic Hepatitis B by the Precore Protein[J].Hepatology,2007,45(1):102-110.
[9]TAKEHARA T,SUZUKI T,OHKAWA K,et al.Viral covalently closed circular DNA in a non-transgenic mouse model for chronic hepatitis B virus replication [J].Journal of Hepatology,2006,44(2):267-274.
[10]李永伟,杨宏志,柯千山,等.甘草甜素对HBsAg低表达HepG2.215细胞株HBV感染及TLR2、4的影响 [J].中药材,2008,31(3):403-407.
[10]LI YW,YANG HZ,KE QS,et al.OF Glycyrrhizin on the Expression of Hepatitis B Virus and Toll Like Receptors 2,4 in HepG2.2.15 Cells Expressing Low HBsAg[J].Journal of Chinese Medicinal Materials,2008,(3):403-407.Chinese
[11]钟旬华,李泽松,张国良,等.应用蛋白芯片技术观察慢性肝病患者血清细胞因子的变化规律 [J].中国中西医结合急救杂志,2007,14(5):267-270.
[11]ZHONG XH;LI ZS;ZHANG GL,et al.Application of protein chip technology for investigation of changes of various serum cytokines in patients with chronic hepatopathy[J].Chinese Journal of Integrated Traditional and Western Medicine in Intensive and Critical Care,2007,14(5):267-270.Chinese
[12]李金兴 郭履峒 甘草甜素对新生儿脐血单个核细胞产生γ—干扰素的影响 上海医科大学学报[J].1991,18(2):104-108.
[12]LI JX,GUO LZ.Effect of Glycyrrhizin on the Interferon Production of Human Neonatal Cord Blood Mononuclear Cells[J].Journal of Fudan University (Medical Science),1991,18(2):104-108.Chinese
[13]MATTEO I,GIOVANNI S,ZAVERIO M.RUGGERI,et al,HBV pathogenesis in animal models:recent advances on the role of platelets[J].J Hepatol,2007,46(4):719–726.
[14]FUJISAWA K,et a1.Therapcutic approach to chronic active hepatitis with Glycyrrhizin[J].Asian Med J,1980,230:745.
