谷朊的糖基化及其谷氨酰胺转氨酶脱酰胺改性研究*
2010-11-02章旭王淼
章旭,王淼,2
1(江南大学食品学院,江苏无锡,214122) 2(江南大学食品科学与技术国家重点实验室,江苏 无锡,214122)
谷朊的糖基化及其谷氨酰胺转氨酶脱酰胺改性研究*
章旭1,王淼1,2
1(江南大学食品学院,江苏无锡,214122) 2(江南大学食品科学与技术国家重点实验室,江苏 无锡,214122)
谷朊富含谷氨酰胺和较多的疏水性氨基酸,具有不溶于水等独特性质。试验采用糖基化和谷氨酰胺转氨酶对谷朊改性,使蛋白质分子带有更多的极性基团,从而使其功能性质得到改善。研究首先在60℃,75%的相对湿度下对谷朊进行糖基化,当谷朊与葡萄糖和葡聚糖的质量比均为10∶1,Maillard反应时间24h,糖基化后的谷朊可利用的ε-NH2分别下降了40%和20%左右。2种糖基化谷朊在底物浓度为5%,谷氨酰胺转氨酶(MTG)浓度为100 U/g谷朊,在pH 6.0,37℃条件下进行脱酰胺改性,MTG作用7 h后,葡萄糖和葡聚糖糖基化谷朊氨释放量分别达到40 μM氨/g蛋白和50 μM氨/g蛋白,高于非糖基化谷朊的31 μM氨/g蛋白,经MTG改性后的糖基化谷朊表面疏水性和溶解性有小幅度的提高,但持水性和持油性有较大提高。
谷朊,谷氨酰胺转氨酶,糖基化,脱酰胺,改性
小麦面筋蛋白俗称谷朊粉,是小麦淀粉生产的副产物,由于面筋蛋白含有较多的疏水性氨基酸,分子内疏水作用区域较大,溶解性较低,限制了它在食品中的使用[1]。对富含谷氨酰胺和天冬酰胺的面筋蛋白进行脱酰胺改性,降低它们在蛋白质分子中形成氢键的能力,从而改善蛋白的功能性质可以扩大其使用范围。脱酰胺改性可通过酸法、碱法及酶法进行。酸性条件下,脱酰胺反应是直接水解蛋白质的酰胺键,脱去一个氨形成羧酸进行[2]。但酸法脱酰胺由于温度高,不仅在酸的催化下肽键水解不好控制,蛋白质也会发生部分变性。用碱催化脱酰胺改性虽然速度快,但使得蛋白质中的氨基酸发生了消旋作用,使必需氨基酸的L-对映体减少和消化率降低,并产生赖丙氨酸,毒理研究表明它对小鼠肾有毒害作用,因此对其研究甚少[3]。
谷氨酰胺转氨酶是一种能催化蛋白酰胺键脱酰胺能力的酶。它还能通过酰基转移反应,催化蛋白侧链的酰胺键与伯胺反应,以及酰胺键与蛋白质中赖氨酸残基的ε-NH2的交联反应[4]。氨酰胺转氨酶在食品中的应用已有很多报道[4],利用谷氨酰胺转氨酶对蛋白进行脱酰胺作用,需要避免蛋白之间因交联反应而进行的聚合。为了解决这一问题,可以通过蛋白与糖的Maillard反应来掩蔽赖氨酸侧链上的ε-NH2,尽可能防止交联反应的发生,并且糖的亲水性对面筋蛋白的功能性质也有改善[5]。因此,本文利用谷氨酰胺转氨酶对糖基化小麦面筋蛋白进行脱酰胺改性研究。
1 材料与方法
1.1 材料与仪器
谷朊粉,周口莲花味精集团;微生物谷氨酰胺转氨酶(MTG,1 600U/g),东海粮油张家港公司;1-苯胺-8-奈磺酸(ANS)、2,4,6-三硝基苯磺酸(TNBS),Sigma公司;氨快速检测试剂盒,Megazyme公司;葡萄糖、葡聚糖,2万单位(右旋糖酐),国药集团化学试剂有限公司。
V1800型可见光分光光度计,上海美谱达仪器有限公司;Hitachi 650-60荧光分光光度计,日本日立公司;FE20实验室pH计,梅特勒-托利多仪器(上海)有限公司;冷冻干燥机,LABCONCO公司。
1.2 实验方法
1.2.1 谷朊粉水分含量的测定
参见 GB5479-1985[6]。
1.2.2 谷朊粉蛋白质含量的测定
微量凯氏定氮法 GB5511-1985[6]。
1.2.3 糖基化谷朊的制备
将谷朊在搅拌条件下分批加入到0.05mol/L磷酸缓冲液中(pH值8.0),配制成5%谷朊悬浮液,以m(谷朊)∶m(糖)=10∶1的配比加入葡萄糖或葡聚糖,搅拌30 min充分混合均匀,将样品冷冻干燥,冻干后的样品在60℃,79%的相对湿度下(饱和的KBr维持79%相对湿度)进行美拉德反应[7],在不同时间的接枝反应下,得到不同接枝度的糖基化谷朊样品。
1.2.4 糖基化谷朊的脱酰胺过程
在酶反应器中将糖基化谷朊分散在pH值6.0的0.05mol/L磷酸缓冲液中,配制成1%悬浮液,按加酶量100 U/g谷朊加入MTG,在37℃,pH值6.0条件下反应不同时间,而后于90℃灭活5 min使反应停止,冷冻干燥,装袋既得改性样品,或在不同时间取一定量悬浮液加入等体积的20%TCA溶液,离心,测上清液中氨的含量。
1.2.5 接枝度的测定
TNBS法测定自由氨基[8]:准确称取40 mg谷朊样品溶于40mL的0.05mol/L的NaCl,pH值9.2,质量浓度2.9g/L的SDS溶液中,搅拌30 min,取上述1mL悬浮液,加入1mL 0.05mol/L的Na2HPO4和1mL质量浓度2.9g/L的TNBS溶液,在60℃水浴反应2 h,室温静置10 min,再加1mL质量浓度100g/L的SDS和0.5mL 1mol/L的HCl,在340 nm处测吸光值,空白不加样品。用相同的方法,以赖氨酸代替样品作标准曲线,根据曲线计算样品中自由氨基的含量C。接枝度的计算公式为:

其中:C0为接枝反应前溶液中自由氨基的含量,mol/L;C1为接枝反应后溶液中自由氨基的含量,mol/L。
1.2.6 脱酰胺过程中氨的测定
在脱酰胺过程中,在不同的时间取3mL悬浮液,再加等体积的20%TCA溶液,静置10 min使蛋白质沉淀,12 000 r/min离心10 min后,取上清液按氨快速检测试剂盒使用说明,测氨浓度。
1.2.7 溶解性的测定
蛋白溶解性采用氮溶解指数(NSI%)表示[9]。将1%的样品溶液,调节到pH值8.0,搅拌1 h使样品溶解,然后离心20 min(4 000 r/min),用福林酚法测上清液蛋白质含量,利用牛血清白蛋白作标准曲线。样品中蛋白质含量测定采用微量凯氏定氮法。
1.2.8 表面疏水性的测定
采用 ANS荧光探针法[10]。将蛋白样品溶于0.01mol/L磷酸缓冲液(pH值7)中,分别稀释成0.5~0.005mg/mL个不同浓度梯度。取不同样品稀释液 5mL,加入50μL 8 mmoL/L 的 ANS,振荡,静置 3 min,设定激发波长338 nm,发射波长496 nm,狭缝校正5 nm。以荧光强度对蛋白浓度作曲线,初始段的斜率即为蛋白质分子的表面疏水性指数。
1.2.9 持水性的测定
将1 g左右(G)样品加入离心管中,连管称重(m1),再加入10mL蒸馏水,搅拌均匀,在25℃下静置30 min,4 000 r/min离心10 min,倒出析出水分,连管称重(m2)。持水性的计算公式为:
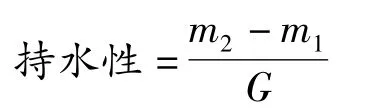
1.2.10 持油性的测定
方法同持水性测定,用大豆色拉油代替蒸馏水。
2 结果与讨论
2.1 Maillard反应时间对接枝反应的影响
本研究选取葡萄糖和葡聚糖与谷朊在10∶1的质量比下进行Maillard反应,通过羰基与氨基的结合,从而掩蔽面筋蛋白上的氨基。在不同的接枝反应时间谷朊接枝度的变化如图1所示。

图1 Maillard反应时间对接枝度的影响
由图1可知,随着Maillard反应时间的增加,糖与谷朊发生接枝反应的接枝度在不断增加,24 h后,葡萄糖与谷朊的接枝度达到了45%,葡聚糖与谷朊的接枝度达到了20%。由于谷朊的溶解性很差,对糖与谷朊的接枝反应有一定的阻碍,所以总体谷朊的接枝度不高。相同反应时间下,葡萄糖与谷朊的接枝度要高于葡聚糖与谷朊的接枝度,可能是由于单糖的分子量要小于多糖,更有利于Maillard反应的发生。为了使糖基化谷朊更好地发生脱酰胺反应而不发生交联反应,改善谷朊的水溶性等特性,后期MTG的处理选择氨基掩蔽程度较高的糖基化24 h谷朊,一方面氨基掩蔽程度高的谷朊可以在MTG作用下更好发生脱酰胺反应,另一方面大量接枝到谷朊上的糖链可以增强蛋白的亲水作用。
2.2 糖基化谷朊在MTG作用下的脱酰胺作用
2种糖基化谷朊和非糖基化谷朊在MTG(100 U/g谷朊)作用下,发生脱酰胺反应,同时可能存在少量的交联反应,反应释放氨的量在一定程度上可反映样品的脱酰胺程度。
由图2可知,在MTG作用开始的1 h内,非糖基化谷朊氨释放量要稍高于葡萄糖和葡聚糖糖基化24 h的谷朊,2 h后,非糖基化谷朊氨释放量速度降低,MTG作用3 h后2种糖基化谷朊氨释放量要明显高于非糖基化谷朊,其中葡聚糖糖基化谷朊又高于葡萄糖糖基化谷朊。这是因为MTG优先催化交联反应。在反应初期,由于体系的蛋白质中可能存在伯胺,特别是非糖基化谷朊中伯胺含量相对较高,故在MTG的作用下,非糖基化的谷朊氨的释放较快。但反应1 h后,糖基化谷朊氨的释放速度和释放量明显高于非糖基化谷朊,反应转向脱酰胺,而且葡聚糖糖基化谷朊由于连接上大分子的葡聚糖,对于蛋白链的展开作用要大于连接上单糖的葡萄糖糖基化谷朊,故更易发生脱酰胺反应,氨的释放量也较大。
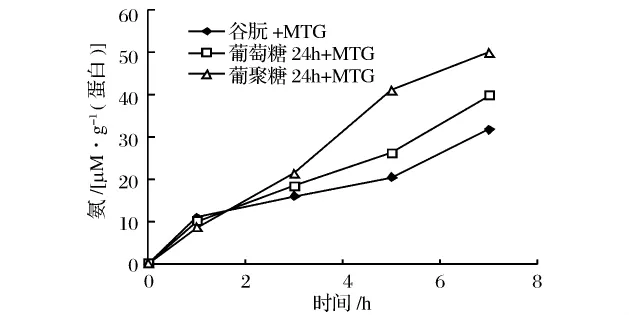
图2 MTG催化谷朊改性过程中氨的释放
2.3 MTG作用时间对糖基化谷朊表面疏水性的影响
谷朊在MTG的作用下表面疏水性的变化,可以反映出蛋白质分子相互作用的结构变化。
由图3可知,非糖基化谷朊和2种糖基化24 h的谷朊在MTG作用开始的1 h内,表面疏水性有显著的升高,1 h后,非糖基化谷朊和葡萄糖糖基化谷朊的表面疏水性升高趋势变缓,葡聚糖糖基化谷朊的表面疏水性有一定程度的波动,总体趋于平缓。在MTG作用的开始1 h,可能由于交联作用,使谷朊的内部大量疏水基团暴露,连接葡萄糖和葡聚糖的糖基化谷朊对蛋白链的展开有一定的促进作用,所以表面疏水性增加较大,MTG作用后期,发生脱酰胺作用,对蛋白表面疏水性影响不明显。
2.4 MTG作用时间对糖基化谷朊功能性质的影响
糖基化谷朊在MTG(100 U/g谷朊)的作用下,进行交联和脱酰胺反应,随着脱酰胺程度的增加,谷朊的功能性质也在发生相应的改变,如溶解性、持水性和持油性等。
2.4.1 MTG作用时间对糖基化谷朊溶解性的影响
由图4可知,糖基化谷朊在MTG的作用下,氮溶解指数都有一定程度的增加,2种糖基化谷朊分别从12%和15%增加到20%,而非糖基化谷朊在MTG的作用下,氮溶解指数也有所提高,但只达到了16%,谷朊的氮溶解指数在10%左右。葡聚糖糖基化24 h的谷朊在MTG作用1.5 h后溶解性快速提高,可能是因为后期主要发生了较多的脱酰胺反应所致[11]。糖基化谷朊在MTG作用下,溶解性的提高,一方面可能由于亲水性的糖链接枝到谷朊上,另一方面由于MTG的脱酰胺作用,使酰胺键变为亲水侧链的羧基,使蛋白链展开,暴露了更多的亲水基团。
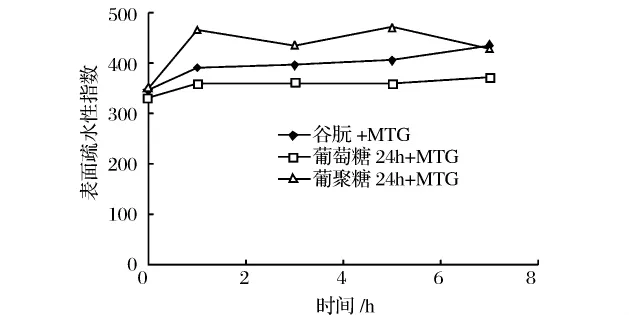
图3 MTG作用时间对糖基化谷朊表面疏水性的影响

图4 MTG作用时间对糖基化谷朊溶解性的影响
2.4.2 MTG作用时间对糖基化谷朊持水性的影响
由图5可知,糖基化谷朊和非糖基化谷朊在MTG的作用下,持水性随酶反应时间的增加而升高,在开始1 h内持水性增加趋势明显,1 h后持水性呈缓和的增加趋势,在MTG作用下,糖基化谷朊持水性高于于非糖基化谷朊,葡萄糖糖基化谷朊高于葡聚糖糖基化谷朊。MTG的脱酰胺作用使蛋白链展开,亲水基团暴露,使连接糖链的谷朊更易具有亲水性,从而持水性增加,以及谷朊上氨基掩蔽率越高,不利于发生交联反应而更多的发生脱酰胺反应,从而更好地改善其持水性。
2.4.3 MTG作用时间对糖基化谷朊持油性的影响
由图6可知,糖基化谷朊和非糖基化谷朊在MTG的作用下,在起始的1 h,持油性明显增加,可能是由于交联作用和疏水基团的暴露,1 h后糖基化谷朊持油性有所下降,3 h后非糖基化谷朊持油性下降明显,可能是由于后期MTG对蛋白的脱酰胺作用使酰胺键转变为亲水性带负电荷的羧基。糖基化谷朊上连接的糖链也在一定程度上增加了其持油性。
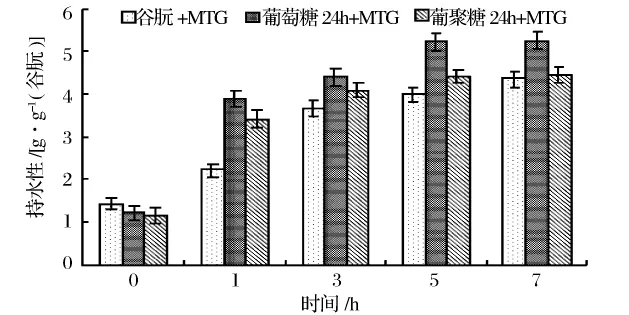
图5 MTG作用时间对糖基化谷朊持水性的影响
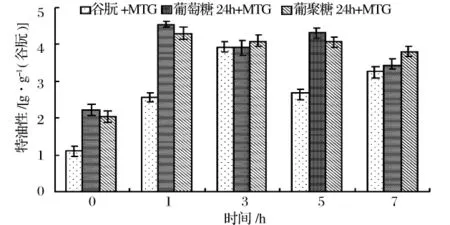
图6 MTG作用时间对糖基化谷朊持油性的影响
3 结论
谷朊与葡萄糖、葡聚糖在进行美拉德反应24 h后,谷朊上的ε-NH2分别下降了40%和20%左右。利用谷氨酰胺转氨酶(MTG)对2种糖基化24 h的谷朊进行改性,在MTG酶量为100 U/g谷朊,37℃,pH 6.0的条件下进行交联和脱酰胺反应,随着反应的进行氨释放量在不断增加,溶解性都有一定程度的提高,持水性有很大的提高,持油性在MTG作用前期提高很大,后期有一定的下降,但都高于非糖基化谷朊。
[1]Barber Kathleen J,Warthesen Joseph J.Some functional properties of acylated wheat gluten[J].Journal of Agriculture and Food Chemistry,1982(20):930-934.
[2]Akio Kato,Atsushi Tanaka,Naotoshi Matsudomi,et al.Damidation of food proteins by protease in alkaline pH[J].Food Chemistry,1987,35:224-227.
[3]马兴盛,候立琪,李红梅.小麦面筋蛋白的改性技术[J].哈尔滨商业大学学报,2001,17(2):21-22.
[4]郑美英,陈坚,伦世仪,等.谷氨酰胺转移酶的理化性质、生产方法及其在食品工业中的应用[J].生物工程进展,2001,21(1):33-37.
[5]Oliver C M,Melton et al.Creating proteins with novel functionality via the Maillard reaction:A review[J].Crit Rev Food Sci Nutr,2006,46:337-350.
[6]王肇慈.粮油食品品质分析[M].北京:中国轻工业出版社,2000:349-361.
[7]钟芳,麻建国,王璋,等.蛋白质-多糖共价复合物[J].食品科技,2000(5):20-26.
[8]Jacques G,Sophie B,Dieter Schwenke K,et al.Effect of succinylation on some physicochemical and functional properties of the 12S storage protein from rapeseed[J].J Agric Food Chem,1990,38:61-69.
[9]Govindaraju K,Srinivas H.Studies on the effects of enzymatic hydrolysis on functional and physicochemical properties of arachin[J].LWT,2006,39:54-62.
[10]Kato A,Sasaki Y,Furuta R.Functional protein-polysaccharide conjugate prepared by controlled dry-heating of ovalbumin-dextran mixtures[J].Agricutural and Biological Chemistry,1990,54(1):107-112.
[11]Yong Y H,Yamaguchi S,Matsumura Y.Effects of enzymatic deamidation by protein-glutaminase on structure and functional properties of wheat gluten[J].J Agric Food Chem,2006,54:6 034-6 040.
Study on Deamidated Modification of Maillard Conjugated Wheat Gluten with Carbohydrates by Microbial Transglutaminase
Zhang Xu1,Wang Miao1,2
1(School of Food Science and Technology,Jianghan university,Wuxi 214122,China)2(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Wheat gluten is rich with glutamine and hydrophobic amino acids,and has some unique properties such as poor water-solubility,etc.To improve its functional properties gluten was modified by glycosylation followed by microbial transglutaminase(MTGase)deamidation with increasing polar groups on gluten.In this study,firstly,wheat gluten was incubated 24 hours with glucose or dextran at 60℃and 75%relative humidity to promote the formation of Maillard reaction.Available ε-NH2groups of wheat gluten were masked approximately 40%and 20%respectively.A 5%suspension solution of glycosylated glutens was to be deamidated by MTGase 100 U/g gluten at 37℃,pH 6.0 for 7 h,the amount of NH3released during the reaction reached 40 μM NH3/g protein and 50μM NH3/g protein while the amount of NH3released reached 31μM NH3/g protein to un-glycosylated glutens.After gluten was glycosylated followed by MTGase reaction,the surface hydrophobicity and the solubility property were slightly increased.The water holding capacity and oil holding capacity were raised effectively by deamidation.
wheat gluten,microbial transglutaminase,maillard reation,deamidation,modification
硕士研究生(王淼教授为通讯作者)。
*国家自然科学基金面上项目(20776063)
2010-06-17,改回日期:2010-09-15
