从植物乳杆菌全细胞转化液中分离纯化γ-氨基丁酸的工艺研究*
2010-11-02张术聪刘婷婷杨套伟夏海锋饶志明
张术聪,刘婷婷,杨套伟,夏海锋,饶志明
(江南大学工业生物技术教育部重点实验室江南大学生物工程学院,江苏无锡,214122)
从植物乳杆菌全细胞转化液中分离纯化γ-氨基丁酸的工艺研究*
张术聪,刘婷婷,杨套伟,夏海锋,饶志明
(江南大学工业生物技术教育部重点实验室江南大学生物工程学院,江苏无锡,214122)
前期筛选获得1株高效转化L-谷氨酸为γ-氨基丁酸(GABA)的植物乳杆菌(Lactobacillus plantarum)GB01-21,该菌以浓度200g/L的L-谷氨酸为底物,发酵20 h左右,能以99%的摩尔转化率生产γ-氨基丁酸,产物γ-氨基丁酸的终浓度可达140g/L左右。从全细胞转化液中分离纯化γ-氨基丁酸,着重对脱色工艺进行了研究,考察了温度、时间、pH和活性炭添加量对脱色效果的影响。通过单因素实验的基础上的正交实验分析,确定了脱色最佳工艺条件为粉末活性炭(150~200目)用量为1.5%,脱色温度70℃,pH值4.0,脱色时间40 min,γ-氨基丁酸转化液的脱色率高达98.42%,γ-氨基丁酸的保留率可达97.23%。随后对γ-氨基丁酸转化液进行初步分离纯化,最终测得γ-氨基丁酸的回收率89.4%,纯度为96.7%。
γ-氨基丁酸,全细胞转化,脱色,分离纯化
γ-氨基丁酸(γ-aminobutyricacid,GABA)是一种非蛋白质组成的天然氨基酸,广泛存在于动物、植物和微生物中,具有降低血压、促进生殖、活化肝肾等多种生理功能,在食品及医药方面具有广泛的应用前景[1]。生物发酵法合成γ-氨基丁酸具有条件温和,对环境友好等特点,已受到国内外研究学者的广泛重视[2],但其发酵液是个极其复杂的多相体系,含有微生物细胞、代谢产物以及未耗尽的培养基等,给GABA的下游分离纯化带来一定困难,这也成为目前工业化生产GABA的瓶颈问题。
目前,只有日本实现了生物合成GABA的工业化生产,国内虽有多家研究机构对发酵法制备GABA技术进行研究,但GABA提取效率或纯度比较低,而且成本较高[3-5]。由此可见,如何低成本、高效率地对GABA纯化提取已成为工业化生产γ-氨基丁酸的关键因素。本实验室前期筛选出1株高产GABA的菌株——植物乳杆菌(Lactobacillus plantarum)GB01-21,利用全细胞转化法生产GABA,摩尔转化率可达99%(已申请国家发明专利,申请号为200910183478.1),且转化液成分较为单一,有效避免了由发酵液成分复杂给下游提取造成的不利影响,但同时也存在转化液颜色较深等问题。本研究主要对转化液脱色工艺条件进行了研究,并在脱色的基础上对γ-氨基丁酸进一步分离提取,从而获得了高回收率、高纯度的γ-氨基丁酸,为工业化生产打下基础。
1 材料与方法
1.1 菌株
植物乳杆菌(Lactobacillus plantarum)GB01-21,实验室保存。
1.2 培养基[6-7]
活化培养基(g/L):酪蛋白胨10,牛肉提取物10,酵母提取物5,葡萄糖5,乙酸钠5,柠檬酸二胺0.2,吐温-80 0.1,K2HPO40.2,MgSO40.2,MnSO40.05,CaCO320,pH 值6.5,0.08 MPa 灭菌15 min。
种子培养基(g/L):蛋白胨10,酵母膏5,葡萄糖10,丁二酸钠5,pH 6.5,0.08 MPa 灭菌 15 min。
1.3 主要试剂和仪器
GABA标准品(Sigma公司),丹磺酰氯(Dns-Cl)、活性炭颗粒炭A、颗粒炭 B、粉末炭 C,NaHCO3、L-谷氨酸(L-Glu)、无水乙醇、冰乙酸、乙酸钠(均为国药分析纯);实验用水为去离子水。
PHS-3C型精密 pH计,Mettler公司;UltiMate-3000型高效液相色谱仪,戴安公司;UV-2000紫外-可见分光光度计,上海精密科学仪器有限公司;电热恒温水浴锅,江苏金坛市环宇科学仪器厂;旋转蒸发仪,上海沪西分析仪器厂有限公司。
1.4 实验方法
1.4.1 分离工艺流程
GABA分离纯化的工艺流程为[8]:

1.4.2 菌体培养
将斜面保藏的菌种接种至活化培养基中,30℃、160 r/min振荡培养24 h,再以2%的接种量接入种子培养基,30℃、160 r/min振荡培养24 h。
1.4.3 转化液的制备
离心收集菌体,用双蒸水洗涤菌体3次,最后用3 L乙酸-乙酸钠缓冲液(pH 4.8,0.1mol/L)悬浮菌体,加入200 g L-Glu,30℃下,在5L发酵罐中转化24 h。
1.4.4 转化液预处理
收集转化液,离心取上清,在70~80℃加热30 min,经单层滤纸过滤后再用0.45 μm滤膜进行抽滤,收集滤液4℃保藏备用。
1.4.5 活性炭预处理[9]
试验用活性炭经验,热去离子水洗,滤干、干燥(120℃干燥6~8 h),冷却到室温备用。
1.4.6 真空抽滤及结晶
活性炭脱色后,经双层滤纸过滤后用0.45 μm滤膜进行抽滤,收集滤液于55℃进行真空浓缩至稀稠状,加入3倍体积的95%的乙醇结晶,4℃下静置12 h,过滤收集晶体。
1.5 测定方法
1.5.1 GABA和L-Glu 的测定方法[10-11]
采用HPLC法测定GABA及L-Glu:Agilent TC C18柱(250 mm ×4.6 mm);进样量:10μL;紫外检测波长:254 nm;柱温:室温;流动相A:甲醇;流动相B:四氢呋喃-甲醇-0.05mol/L醋酸钠(pH值6.2)(体积比为5∶75∶20);洗脱方式:线性梯度洗脱程序见表1。

表1 梯度洗脱程序
1.5.2 样品和标准品柱前衍生反应
取样品0.1mL,加入0.2mol/L pH值9.8的NaHCO30.9mL,再加入等量的Dns-Cl丙酮(2g/L)溶液,避光,置于30℃下衍生1 h。
1.5.3 转化液中色素吸收波长的测定
量取一定量转化液,以该溶液中色素浓度为100%,稀释不同倍数,配成一定浓度梯度的标准溶液,以去离子水为空白,测量其在450 nm波长下溶液的吸光度,平行3次。
1.5.4 转化液脱色
选取温度、时间、pH值和活性炭添加量4个因素,对转化液进行脱色实验,过滤,滤液在450 nm下测定吸光值,计算脱色率[12]:

式中:Ds为脱色率;A0为脱色前样液的吸光度值;A为脱色后样液的吸光度值
GABA保留率的计算公式:
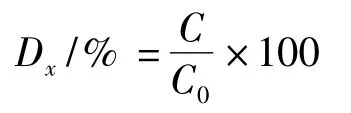
式中:Dx为GABA保留率,%;C0为脱色前GABA质量浓度,g/L;C为脱色后的GABA质量浓度,g/L。
2 结果与讨论
2.1 转化液中GABA和L-Glu的测定
按照方法1.4.3进行全细胞转化制备转化液,对转化液进行衍生化,用HPLC进行检测,结果见图1。
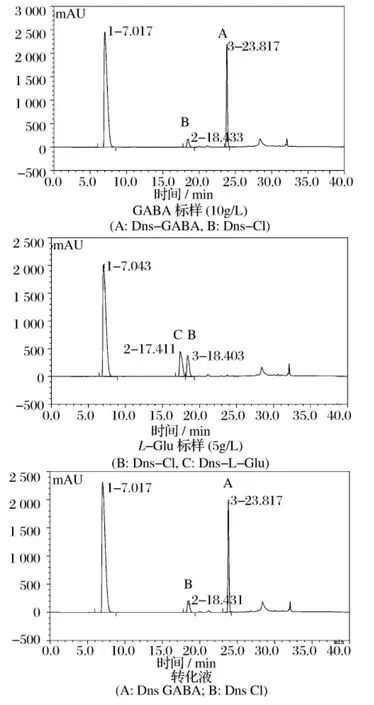
图1 GABA、L-Glu以及转化液HPLC检测图
用HPLC测得转化液中GABA的含量为139.2 g,摩尔转化率为99.3%;由图1也可以看出,转化液中L-Glu几乎检测不到,因此可以确定本实验中下一步分离纯化过程不需要考虑L-Glu与GABA的分离,减少了繁琐的离子交换[13]等分离步骤,节约了成本。
2.2 转化液中色素吸收波长的测定
对转化液进行全波长扫描,扫描结果表明GABA转化液无最大吸收波长,根据文献[14],GABA转化液中的色素吸收峰应在400~500 nm,按照1.5.3方法对转化液中色素吸收波长的进行了测定,结果如图2所示。
由图2可知,在450 nm下转化液浓度与吸光度A的相关系数较高,相关性较好,所以选择450 nm作为检测波长。
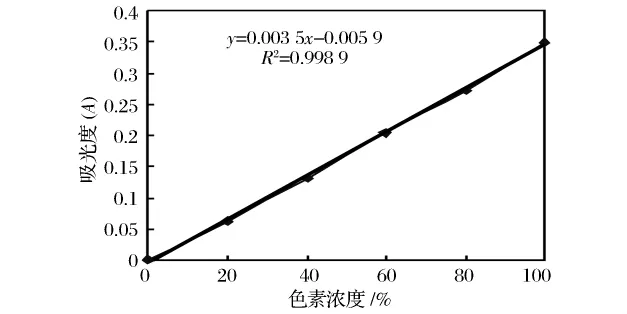
图2 色素浓度与吸光度(A)的关系
2.3 活性炭的选择
实验中发现,不同颗粒大小的活性炭对预处理转化液脱色效果差异很大,分别选择不同颗粒大小的活性炭颗粒炭A,颗粒炭B,粉末炭C在相同的条件下对转化液进行脱色效果比较,结果见表2。
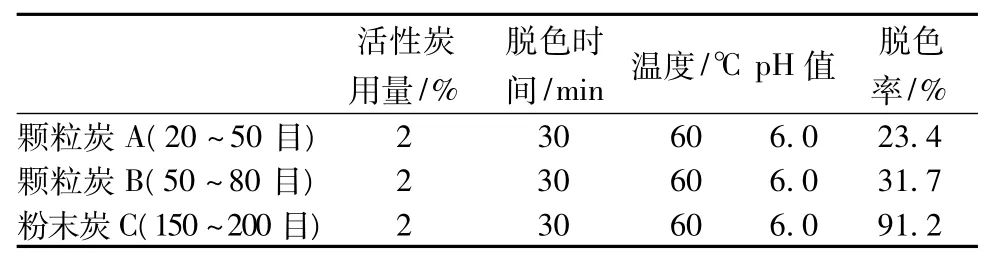
表2 不同颗粒大小的活性炭对脱色率的影响
由表2可知,粉末状活性炭C的脱色效果十分显著,经处理后溶液清澈透明,脱色率达到91.2%。因此,选用粉末状活性炭C作为脱色用炭。
2.4 活性炭脱色条件研究
2.4.1 单因素实验确定脱色条件
按照工业上活性炭用量不超过3%的原则,选取温度、时间、pH值和活性炭添加量4个因素,对转化液进行脱色实验,过滤,滤液在450 nm下测定吸光值,计算其脱色率、GABA保留率。
活性炭用量对转化液的脱色效果影响较大(如图3),随着活性炭用量的增加脱色效果越来越好,但当活性炭用量超过2.0%时,脱色率增加的幅度比较小,而GABA的损失率却继续增加。由实验结果确定选用2.0%作为最佳活性炭脱色浓度,该用量明显低于工业应用中活性炭用量不超过3%的要求。
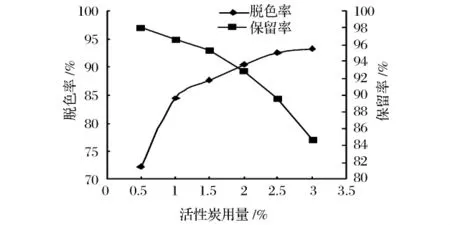
图3 活性炭用量对脱色效果的影响
转化液的脱色效果随着脱色时间的增加而越来越好(如图4),在超过30 min后,脱色率的变化幅度不大,而GABA的保留率随着时间的延长却越来越小,综合考虑选择脱色时间为30 min。
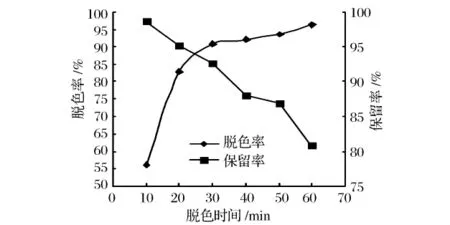
图4 脱色时间对活性炭脱色效果的影响
温度对活性炭脱色效果影响较大(如图5)。由图5可以看出,随着脱色温度的升高,脱色率升高,GABA保留率则降低,温度从30℃升到60℃时,脱色率变化显著,保留率降低的也较快,温度升至60℃后,预处理液脱色率变化不明显,而保留率也继续降低,因此确定脱色温度为60℃。
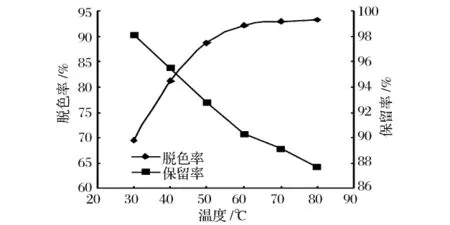
图5 温度对活性炭脱色效果的影响
转化液的pH值对活性炭脱色效果有一定的影响(见图6),在pH值为5.0时,脱色率达到最大为93.3%,此时GABA的保留率也较高为89.3%,所以选择脱色pH值为5.0。

图6 pH值对活性炭脱色效果的影响
2.4.2 正交设计确定活性炭脱色最佳工艺条件
根据单因素实验结果,选择四因素三水平,按L9(43)进行正交实验,见表3,以确定最佳的活性炭脱色工艺条件。

表3 活性炭脱色因素水平表
以预处理转化液的脱色率、保留率为指标,进行正交试验,确定活性炭脱色的最佳工艺条件,具体的试验结果见表4。
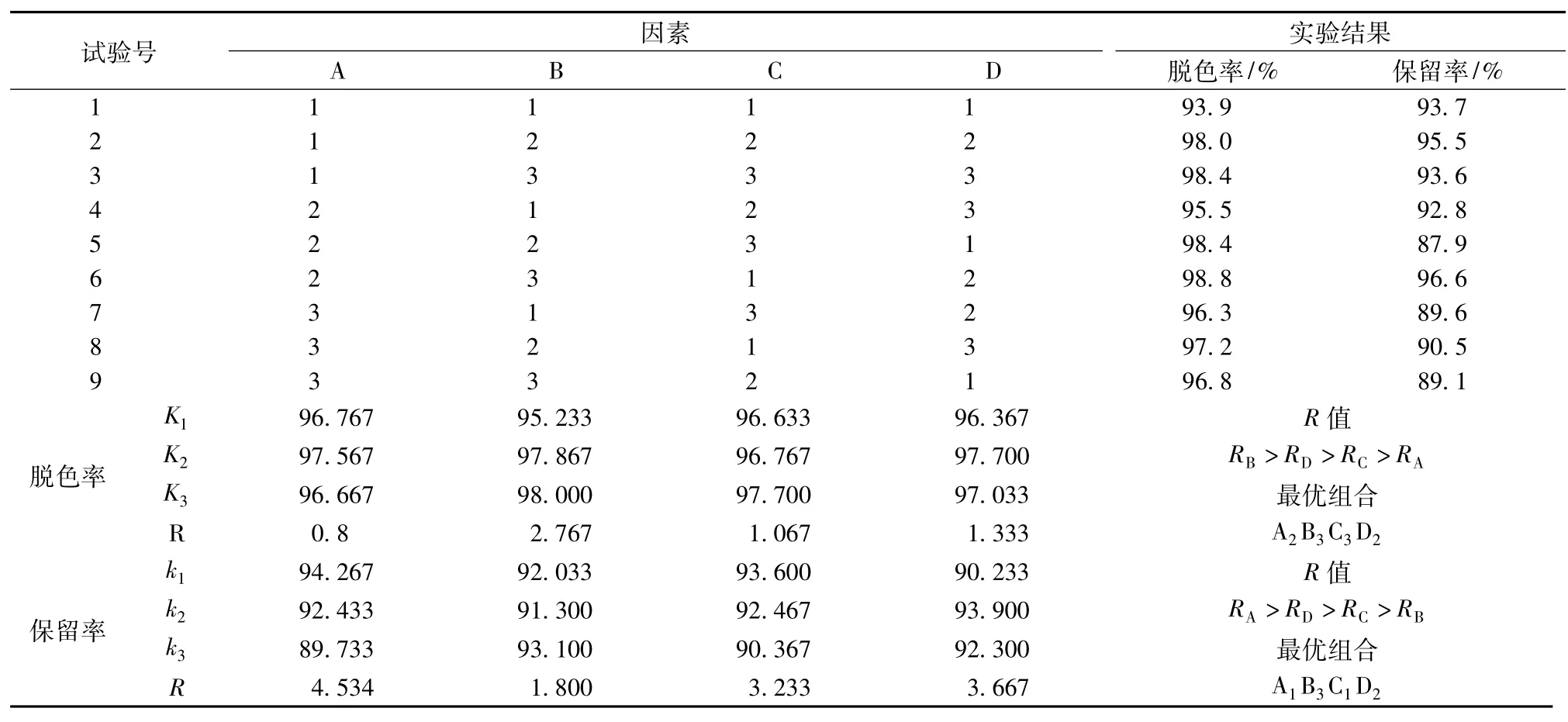
表4 活性炭脱色正交试验设计及结果
由表4分析得知,影响活性炭脱色效果的因素中,按影响程度的大小顺序为B>D>C>A。最佳的工艺条件为A2B3C3D2;而在脱色过程中对GABA的保留率的影响因素顺序为A>D>C>B,依次为pH值、时间、活性炭添加量和温度,最佳工艺条件为A1B3C1D2。综合考虑脱色率和GABA的保留率,最终确定工艺条件为A1B3C1D2,即在70℃下、调节pH值为4.0、添加1.5%的活性炭、脱色40 min。在最佳工艺条件下进行了脱色的效果试验,脱色率为98.42%,GABA的保留率为97.23%。
2.5 转化液中GABA分离纯化及产品质量评价
按照方法1.4.3进行全细胞转化制备的转化液,用HPLC测其中GABA的含量为139.2 g,按上述脱色条件进行进行脱色后,旋转蒸发浓缩至稀糊状,加入3倍体积的95%乙醇静置12 h,过滤干燥后得到128.7gGABA成品,用氨基酸自动分析仪分析(图7),产品纯度可达96.7%,整个工艺GABA的回收率为89.4%。

图7 GABA成品氨基酸自动分析仪分析图谱
3 结论
目前,以生物合成法生产GABA,由于下游分离提取困难,已成为微生物法工业化生产GABA的主要制约因素,因此GABA的分离提取工艺已成为研究热点。王文等[3]采用高速离心、超滤和稀释过滤相结合的方法,将GABA的回收率由原来的50%提高到将近95%,但 GABA的纯度仍然较低,仅为31.63%。王兢[4]采用NKA-9大孔吸附树脂和阴离子交换树脂D201对乳酸菌SK005发酵生产GABA的发酵液进行脱色纯化处理,产品的纯度达到了90.8%,但收率不高。本研究小组前期利用高转化率的植物乳杆菌全细胞转化法生产GABA,避免了发酵液成分复杂给下游提取造成的不利影响,但同时也存在转化液颜色较深等问题,因此本研究对转化液脱色工艺条件进行了研究。确定了活性炭脱色的最佳工艺条件:活性炭用量1.5%,脱色温度70℃,pH值4.0,脱色时间40 min,GABA转化液的脱色率高达98.42%,GABA的保留率可达97.23%。运用此工艺对GABA转化液进行进一步分离纯化,GABA的回收率为89.4%,纯度为96.7%,回收率和纯度在国内均处于领先水平,而且该工艺操作简单,成本低,具有工业化应用的优势。
[1]陈恩成,张名位,彭超英,等.γ-氨基丁酸的功能特性及其在食品原料中的富集技术研究进展[J].湖北农学院学报,2004,24(4):316-320.
[2]Huang J,Mei L H,Xia J.Application of artificial neural network coupling particle swarm optimization algorithm to biocatalytic production of GABA[J].Biotechnol Bioeng,2006,96(5):924-931.
[3]王文,冯晶.超滤技术在GABA发酵液分离纯化过程中的应用[J].江苏大学学报:自然科学版,2005,26(1):5-8.
[4]王兢.高纯度γ-氨基丁酸的制备及脱色工艺研究[D].无锡:江南大学硕士论文,2006.
[5]陈颖.米糠中γ-氨基丁酸的富集[D].无锡:江南大学硕士论文,2005.
[6]刘清,姚惠源.生产γ-氨基丁酸乳酸菌的选育及发酵条件优化[J].氨基酸与生物资源,2004,26(1):40-43.
[7]Masaru Nomura,Ikuyo Nakajima.Lactococcus lactis contains only one glutamate decarboxylase gene[J].Microbiology,1999(145),1 375-1 380.
[8]张伟国,钱和.氨基酸生产技术及其应用[M].北京:中国轻工业出版社,1997.
[9]吴田瑞,杨林.食用变性淀粉的性质及用途[J].陕西粮油科技,1995,20(4):16-19.
[10]闫淑莲,赵光,刘永利.反相高效液相色谱-丹酰氯柱前衍生法的氨基酸分析测定[J].首都医科大学学报,2003,24(3):338-339.
[11]邓福华,梅乐和,黄俊.发酵液中γ-氨基丁酸含量的高效液相色谱法测定[J].材料科学与工程学报,2005,23(专刊):100-102.
[12]杨云,刘福勤,冯卫生,等.碱法提取大枣渣多糖及活性炭脱色的工艺研究[J].食品与发酵工业,2004,30(7):30-32.
[13]黄美娥,于华忠,曹庸.蕨菜叶、茎中γ-氨基丁酸的提取分离及含量测定[J].氨基酸和生物资源,2004,27(1):77-78.
[14]马晓博.利用米糠谷氨酸脱发酶富集γ-氨基丁酸及其分离与纯化[D].无锡:江南大学硕士论文,2008.
Study on Separation and Purification Technology of γ-aminobutyric Acid by Whole-cell Bioconversion
Zhang Shu-cong,Liu Ting-ting,Yang Tao-wei,Xia Hai-feng,Rao Zhi-ming
(Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
A strain named Lactobacillus plantarum GB01-21 that can produce γ-aminobutyric(GABA)efficiently was screened in our laboratory.During the 20 hours,200g/L L-Glu can be transformed into 140g/L GABA.In this work,γ-aminobutyric was separated and purified from the whole-cell transforming solution.The decolorizing technical conditions such as temperature,time,pH and amount of active carbon were studied.As a result,the optimum decolorization conditions were determined through single factor and orthogonal experiments as follows:activated carbon dosage 1.5%,decolorization temperature 70 ℃,pH value 4.0 and decolorization time 30 min.Under these conditions,the decolorization rate and recovery rate of bioconversion broth reached 98.42%and 97.23%,respectively.Finally,γ-aminobutyric acid was isolated and purified from bioconversion broth and the recovery rate and the purity of γ-aminobutyric acid was 89.4%and 96.7%,respectively.These findings pave the way for industrial production of GABA.
γ-aminobutyric acid,whole-cell transforming,decolorization,separation and purification
硕士研究生(饶志明教授为通讯作者)
*国家“863计划”(2007AA02Z207);国家自然科学基金(30970056);霍英东青年基金(121020)
2010-06-03,改回日期:2010-06-28
