沙丁胺醇单克隆抗体的制备及间接ELISA方法的建立
2010-11-02彭述辉袁利鹏孙远明雷红涛王保玲徐振林
彭述辉,袁利鹏,孙远明,雷红涛,*,王保玲,徐振林,庞 杰
(1.广州城市职业学院,广东广州510405;2.广东省食品质量安全重点实验室/华南农业大学食品学院,广东广州510640)
沙丁胺醇单克隆抗体的制备及间接ELISA方法的建立
彭述辉1,2,袁利鹏2,孙远明2,雷红涛2,*,王保玲2,徐振林2,庞 杰2
(1.广州城市职业学院,广东广州510405;2.广东省食品质量安全重点实验室/华南农业大学食品学院,广东广州510640)
制备抗沙丁胺醇单克隆抗体,鉴定其特异性并建立间接竞争ELISA检测方法。以合成的沙丁胺醇完全抗原免疫Balb/c小鼠,利用杂交瘤技术进行细胞融合,筛选克隆得到稳定分泌抗沙丁胺醇抗体的单克隆杂交瘤细胞,命名为4E4和3A2。经鉴定,两个抗体亚类都为IgG1,其腹水纯化后效价分别达到2.56×105和1.28×105。以效价高且特异性较好的4E4细胞株获得的抗体建立间接竞争ELISA方法,经条件优化后得到标准曲线,检测范围为4.76~84.99ng/mL,IC50为20.12ng/mL,检测限为3.25ng/mL,与克伦特罗交叉反应率为253.62%,与其它结构类似物没有明显交叉反应。本研究制备的单克隆抗体和建立的间接ELISA方法,可用于开发同时检测沙丁胺醇和克伦特罗的试剂盒。
沙丁胺醇,单克隆抗体,间接ELISA
沙丁胺醇(salbutamol,SAL)是一种!-肾上腺素能兴奋剂,主要用于防治哮喘和支气管痉挛,但可减少胭体的脂肪含量,减少非胭体部分的脂肪沉积,促进饲料转化率、增加瘦肉率[1-2]。由于近年来畜产品中克伦特罗、莱克多巴胺等“瘦肉精”含量超标引起的中毒事件不断发生[3-4],政府对“瘦肉精”的监管力度不断加强,不法商开始以SAL作为“瘦肉精”的替代品。过量摄入SAL会导致心悸、头疼、目眩、恶心甚至损害肝肾[5],其残留严重危害着人们的身体健康和生命安全。作为一种潜在的“瘦肉精”替代品,很有必要加强对其的监控。目前国内外对SAL残留的检测主要采用仪器分析方法[6-9]。仪器检测方法虽然准确、灵敏,但设备昂贵,样品前处理复杂,需要专业人员才可操作,不适于大量样品的筛选检测。免疫分析方法操作简便、快捷、高通量、灵敏度高,目前已经成为食品安全快速筛选检测的主要方法之一。Kunakar Pou[10]和Sean Chins[11]分别建立了SAL放射免疫分析,其检测限可以达到0.01ng/mL和0.04ng/g,但由于放免分析的特殊性,使这一技术无法得到普遍的应用。史利军[12]建立的SAL间接ELISA检测方法,IC50为40.5ng/mL。本研究制备SAL单克隆抗体,建立了一种更加灵敏的间接竞争ELISA方法,为开发用于检测SAL的试剂盒奠定基础。
1 材料与方法
1.1 材料与仪器
鼠骨髓瘤细胞SP2/0 本实验室保藏;清洁级Balb/c纯种雌性小鼠、普通级雌性昆明鼠 中山医科大学实验动物中心;沙丁胺醇完全抗原 本实验室制备;HAT、HT、RPMI-1640培养基 美国Gibico公司;HEPES 上海博粤生物科技;PEG 4000 美国Sigma公司。
Wellwash MK2洗板机 美国 Thermo公司;ZHJH-1112超净工作台 上海智城分析仪器制造有限公司;TC-2323CO2培养箱 SHELDON公司;CHA倒置光学显微镜 日本OLYMPUS公司;Multiskan MK3酶标仪。
1.2 实验方法
1.2.1 单克隆抗体的制备[13]
1.2.1.1 动物免疫 取6~8周龄雌性Balb/c小鼠,分2组,3只/组,第1组小鼠编号为A、B、C,第2组设为阴性对照组 。腹腔注射免疫,每只小鼠100!g(以蛋白量计)沙丁胺醇免疫原SAL-BSA,每隔2周后同样剂量腹腔和足垫注射加强免疫。三次免疫后尾部取血检测小鼠血清效果。
1.2.1.2 抗血清效价的测定 利用间接ELISA测定,分别以不同浓度的SAL-OVA包被酶标板,小鼠抗血清倍比稀释,抗血清效价为抗血清A450nm/阴性血清A450nm≥2.1时的抗血清的稀释倍数。采用方阵滴定法优化包被抗原浓度和抗血清工作浓度,选择吸光值为1.0左右时的抗原浓度和抗体稀释度作为工作浓度,采用间接竞争ELISA检测血清的抑制效果。效价高抑制效果好的小鼠加强免疫,用于细胞融合。
1.2.1.3 细胞融合 将免疫小鼠的脾细胞和骨髓瘤细胞以个数5∶1的比例混合,用50%聚乙二醇(PEG)作为融合剂进行细胞融合,将融合好的细胞悬浮于HAT选择性培养液,将混匀悬液分装于有饲养细胞的24孔板中,于37℃、5%CO2饱和湿度的培养箱中孵育。
1.2.1.4 杂交瘤细胞筛选及亚克隆 融合后6~9d,用HT培养液半量换液1次,在12~14d后根据增殖情况改用完全培养液。待细胞贴壁至占板孔1/3时,取上清液,采用间接ELISA和间接竞争ELISA法进行阳性杂交瘤细胞筛选,显示阳性并出现竞争抑制反应的孔为产SAL抗体的孔,显微克隆和有限稀释进行亚克隆。如此反复克隆2~5次,待所克隆的所有孔上清液中抗体阳性率为100%时,挑取单克隆细胞,扩大培养,建株。
1.2.1.5 腹水制备和抗体亚型鉴定 提前一周注射0.5mL液体石蜡至Balb/c小鼠腹腔。将细胞(每只小鼠1mL,含3.1×107个细胞)腹腔注射小鼠腹部,10~15d后,待小鼠腹部明显膨大时采集腹水。ELISA法测定其效价,间接ELISA法鉴定单克隆抗体的免疫球蛋白类型和亚类。
1.2.1.6 纯化抗体及蛋白质含量测定 辛酸-硫酸铵沉淀法分离纯化抗体。280nm紫外光谱测定,并按下列公式计算蛋白质含量:

1.2.1.7 单克隆抗体的亲和常数(Ka)测定 以1!g/mL SAL-OVA包被,间接ELISA法测定不同浓度的抗SAL单克隆抗体与包被抗原反应的A450nm值,以单克隆抗体浓度为横坐标,以A450nm值为纵坐标,绘制反应曲线,并在曲线上找到趋于平坦段A值的50%所对应的单克隆抗体浓度,以其倒数作为亲和常数Ka[14]。
1.2.2 单克隆抗体间竞争ELISA(icELISA)方法的建立 检测ELISA酶标板均一性,用棋盘滴定确定最佳包被浓度和抗体稀释倍数,采用常规ELISA操作步骤[15],建立稳定灵敏的ELISA间接竞争方法。四参数拟合曲线,计算 IC50,定量检测范围,确定检测限。
1.2.3 沙丁胺醇icELISA特异性分析[16]以SAL浓度的常用对数值为横坐标,以抑制百分率为纵坐标作图,抑制曲线用Origin 7.5软件进行拟合,抑制率为50%所对应的浓度即为IC50值。抑制率的计算公式为:
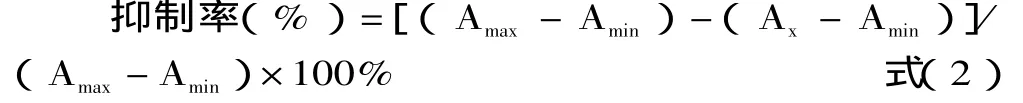
其中:Amax为不加药物时的吸光值,Ax为药物浓度为x时的吸光值,Amin为空白对照孔的吸光值。
以交叉反应率(cross reactivity,CR)评价方法的特异性。
CR=(沙丁胺醇的IC50/各结构类似物的IC50)× 100%
2 结果与讨论
2.1 抗血清效果分析
血清中抗体的效价越高,则说明有效抗体浓度越高,即小鼠的脾脏中激活的B淋巴细胞越多,有利于细胞融合。如图1所示,3只小鼠抗血清800倍开始倍比稀释,在相同包被浓度4!g/mL下,可以看出小鼠B免疫产生得血清效价最高。
采用浓度为10ng/mL SAL作为抑制药物,对不同小鼠的血清进行间接竞争ELISA检测。比较抑制情况如表1所示,3只小鼠中,小鼠B血清效价最高且药物对其血清的抑制作用也最强,故选择小鼠B进行细胞融合。
2.2 单克隆抗体亚类的鉴定和腹水效价测定

表1 SAL 抗血清的抑制效果
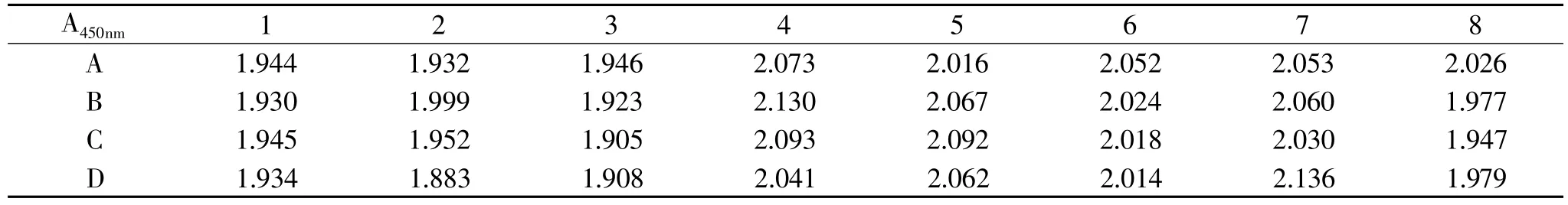
表2 酶标板均一性的检测表

图1 SAL抗血清效价测定曲线
经过细胞融合,筛选克隆,得到2株稳定分泌抗SAL抗体的杂交瘤细胞4E4和3A2。以4!g/mL的SAL-OVA包被酶标板,采用icELISA检测方法检测4E4、3A2两株腹水抗体亚型。检测结果抗体亚型都为IgG1。用间接ELISA测定4E4和3A2得到腹水的效价分别为1∶2.56×105、1∶1.28×105。
2.3 纯化后抗体中的蛋白质含量测定
辛酸-硫酸铵沉淀法纯化腹水得到的抗体,按照公式(1)计算得到的蛋白浓度:4E4腹水纯化后抗体浓度为8.12mg/mL;3A2腹水纯化后抗体浓度为6.03mg/mL。
2.4 不同细胞株获得抗体的特异性测定
以4!g/mL SAL-OVA包被酶标板,icELISA检测抗体特异性。如图2所示,虽然4E4和3A2两株抗体的效价测定差距不大,但在抑制率曲线中4E4细胞株获得的抗体的抑制情况明显优于3A2细胞株获得的抗体,故选择4E4细胞株分泌的抗体用于随后实验。

图2 不同细胞株诱导抗体的抑制率曲线
2.5 SAL单克隆抗体的亲和常数测定
以1.0!g/mL SAL-OVA包被,icELISA法测定单克隆抗体的亲和力,结果如图3所示,取趋于平坦段A450nm值为2.08的50%所对应的单克隆抗体浓度,以其倒数作为亲和常数(Ka),所获单克隆抗体的Ka为2.64×109L/mol。

图3 SAL单克隆抗体的亲和常数测定曲线(n=3)
2.6 ELISA酶标板均一性的测试
从不同的酶标板中随机取酶标条4条,以1.0!g/mL包被原包被酶标条,其余按照icELISA步骤操作,A450nm下读数,计算各孔间的变异系数,以检验酶标板的均一性。以表2测试数据为准,经统计分析平均值为2.003,标准差为0.0686,样本数为32,变异系数为4.1%,说明均一性良好,可以满足实验对SAL测定要求。
2.7 SAL-icELISA最佳检测条件的确定
最佳包被浓度和抗体的稀释倍数采用棋盘测定法确定,包被浓度会影响标准曲线的灵敏度,包被的浓度越小,与游离抗原的竞争力就会减弱,这样会使曲线的灵敏度增加,但是包被浓度太小,就会影响Amax和曲线的稳定性。由图4可知,Amax在包被浓度为0.5~4!g/mL时呈现逐渐增大的趋势,根据Amax值在1.0左右[17]比较灵敏的原则,在包被浓度为0.5!g/mL时,Amax为1.22,IC50值最小30ng/mL,且 Amax/IC50最高,说明其灵敏度最高,因此,在以后的实验中选择包被浓度0.5!g/mL,此包被时最适抗体稀释倍数为256000倍。
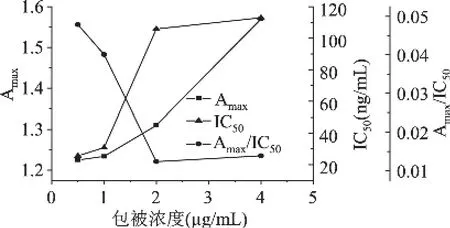
图4 包被浓度对Amax与IC50和Amax/IC50的影响
2.8 SAL-icELISA标准曲线
以0.5!g/mL SAL-OVA 4℃过夜包被酶标板,5%脱脂奶粉37℃孵育封闭3h,0.01mol/L、pH 7.4的磷酸盐缓冲液液(PBS)稀释的 SAL药物和稀释256000倍的单克隆抗体各50!L,37℃水浴反应1h后,加入1∶15000倍稀释的HRP-羊抗小鼠抗体37℃水浴反应45min。以A450nm值为纵坐标,SAL浓度的负对数为横坐标,绘制标准曲线,如图5所示。得到的标准曲线检测范围为 4.76~84.99ng/mL,IC50= 20.12ng/mL,检测限为3.25ng/mL。

图5 沙丁胺醇icELISA标准曲线(n=3)
2.9 SAL-icELISA的特异性分析
采用沙丁胺醇icELISA方法,在几种"-兴奋剂的交叉反应曲线中,发现SAL单克隆抗体与克伦特罗有高的交叉反应,达253.62%(图6)。而与其他结构类似物交叉很小。莱克多巴胺的交叉率为1.25%,异丙肾上腺素为0.05%,去甲肾上腺素无交叉。

图6 沙丁胺醇的交叉反应曲线
3 讨论与结论
小分子偶联蛋白BSA形成的完全抗原是一类比较特殊的抗原,它不像天然的蛋白抗原有多个抗原决定簇,它可能只有一个决定簇,所以其阳性率极低,在选择免疫小鼠时候,要效价越高、抑制效果越明显的越好,这样脾脏中激活的B淋巴细胞才足够多,融合的出现阳性的几率才会大。抗体分泌株相比不分泌抗体的细胞株处于生长劣势,其分泌特性如不及时建株极易丧失。本实验室自制的显微克隆系统,结合有限稀释法成功地筛选到2株特异性细胞。所获4E4单克隆抗体的亲和常数(Ka)为2.64× 109L/mol,表明该抗体的亲和力是较高的,高亲和力抗体在免疫化学技术中使用效果较好,它在较短的时间内比低亲和力抗体能结合较大量的抗原,具有较高的活性,且复合物的稳定性也较好。
邱阳生[18]所制备沙丁胺醇单抗对克伦特罗有50%的抑制率,史利军[12]得到的单抗对克伦特罗交叉反应率达100%,本文的单抗建立的间接竞争方法对克伦特罗交叉反应率为253.62%,这种反应性能尚未在其他沙丁胺醇检测研究中报道过。本文所用沙丁胺醇单克隆抗体与莱克多巴胺和异丙肾上腺素几乎没有交叉反应,尽管莱克多巴胺和异丙肾上腺素的异丙胺基与沙丁胺醇的叔丁氨基很相似,这表明抗体的识别能力非常精细。
综上所述,本文所建立的单抗间接竞争ELISA模式适合同时检测沙丁胺醇和克伦特罗,用于两种药物的同时筛查。
[1]Warriss P D,Brown S N,Rolph T P,et al.Interactions between the beta-adrenergic agonist salbutamol and genotype on meat quality in pigs[J].Journal of Animal Science,1990,68(1):3669-3676.
[2]Hansen J A,Nelssen J L,Goodband R D,et al.Interactive effects among porcein somatropin the Beta-adrenergic agonist salbutamol,anddietary Lysineon growth performance and nitrogen balance off inishing swine[J].Journalof Animal Science,1994,72(3):1540-1541.
[3]吴日钧.关于瘦肉精检测的几点思考[J].猪业科学,2009,26(6):50.
[4]庞苏纳.于芳.“瘦肉精”及其危害简介[J].新疆畜牧业,2009(3):17.
[5]刘宣兵,庞玉芳,侯玉泽,等.沙丁胺醇的毒副作用及其残留检测[J].上海畜牧兽医通讯,2008(4):83-84.
[6]Gabiola C,Calonge M A G,PortilloM P,et a.l Validation of a method for the determination of salbutamol in animal urine by gas chromatography-mass spectrometry and its application to treated lamb samples[J].Microcolumn Separations,1996,8(5):361-364.
[7]Couper B R,Fiona J,Drummer A D.Gas chromatographic mass spectrometric determination of"2-agonists in post mortem blood:Application in forensic medicine[J].Chromatography Biomedical Science and Application,1996,685(2):12-15.
[8]ZhangY,Zhang Z J,Sun Y H,et al.Development of analytical method for the determination of"-agonist residues in animal tissues by high-performance liquid chromatography with on-line electrogenerated[Cu(HIO6)2]5-luminol chemiluminescence detection[J].Agriculture and Food Chemistry,2007,55:4949-4956.
[9]Somsak S,Proespichaya K.Rapid analysis of clenbuterol,salbutamol,procaterol,and fenoterol in pharmaceuticals and human urine by capillary electrophoresis[J].Talanta,2008,76(5):1194-1198.
[10]Pou K,Ong H,Adam At.Combined immunoextraction approach coupled to a chemiluminescence enzyme immunoassay for the determination of trace levels of salbutamol and clenbuterol in tissue samples[J].Analyst,1994,119(12):2659-2662.
[11]Sean C,Michael O K,Malcolm R S,et al.Mutli-residue analysis for Beta-agonists in urine and liver sample using missed Phase columns with determination by radioimmunoassay[J]. Analyst,1994,119(10):2671-2674.
[12]史利军,杨正涛,王艳,等.沙丁胺醇单克隆抗体的制备及其免疫学检测方法的建立[J].中国兽医杂志,2006,42(6):12-14.
[13]周珍辉.动物细胞培养技术[M].北京:中国环境科学出版社,2006:188-241.
[14]Beatty J D,Beatty B G,Vlahos W G.Measurement of monoclonalantibody affinity by non-competitive enzyme immunoassay[J].Journal of Immunological Methods,1987,100(1-2):173-179.
[15]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000:351-357.
[16]徐宜为.实验免疫学技术[M].北京:科学出版社,1979:79-85.
[17]杨利国,胡少昶,魏平华,等.酶免疫测定技术[M].南京:南京大学出版社,1998:70-71.
[18]邱阳生,杨根海,何方洋.沙丁胺醇单克隆抗体的制备及鉴定[J].中国兽医科,2002,32(10):25-26.
Preparation of monoclonal antibody against salbutamol and establishment of indirect competitive ELISA
PENG Shu-hui1,2,YUAN Li-peng2,SUN Yuan-ming2,LEI Hong-tao2,*,WANG Bao-ling2,XU Zhen-lin2,PANG Jie2
(1.Guangzhou City Polytechnic,Guangzhou 510405,China;2.College of Food Science/Key Laboratory of Food Quality and Safety of Guangdong Province,South China Agricultural University,Guangzhou 510640,China)
Monoclonal antibody against Salbutamol(SAL)was prepared and the specificity of the antibody was identified to develop an indirect competitive enzyme-linked immunosobent assay(ELISA)for SAL.Splenocytes from mice immunized with SAL-BSA were fused with SP2/0 myeloma cells,and hybridomas secreting antibodies against SAL were selected and cloned.Two stable monoclonal antibodies 4E4 and 3A2 of subclasses IgG1were isolated and the titers of corresponding ascites were 2.56×105and 1.28×105,respectively.Based on the antibody produced by cell 4E4,an indirect competitive ELISA(icELISA)was developed for the quantitative detection of SAL. The IC50of standard curve was 20.12ng/mL and the limit of detection for SAL was 3.25ng/mL,with a linear ranged from 4.76 to 84.99ng/mL.The obtained SAL monoclonal antibody had 253.62% cross-reactivity(CR%)to Clenbuterol(CBL)and showed scarcely cross-reactivity with other structural analogs.The monoclonal antibody and the method was suitable for developing a commercial immunoassay kit for detecting the residue of SAL and CBL simultaneously.
salbutamol;monoclonal antibody;indirect competitive ELISA.
Q785
A
1002-0306(2010)07-0171-05
2010-01-28 *通讯联系人
彭述辉(1965-),男,博士,副教授,主要从事食品科学教学和研究。
国家自然科学基金(20877029,30700663);广东科技计划(Zgzhzd0808,2009B040500002,2009B080701068,2008B021400007);国家863计划(2007AA10Z437);国家“十一五”科技支撑计划(2006BAD27B02-05);福建省自然科学基金(2009J01061);福建省科技计划社会发展重点项目(2008Y0006)。
