大肠杆菌O157:H7胶体金试纸条研制
2010-10-28黄岭芳刘文娟赖卫华
黄岭芳,段 霞,陈 媛,刘文娟,魏 华,赖卫华,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西中德生物工程有限公司,江西 南昌 330029)
大肠杆菌O157:H7胶体金试纸条研制
黄岭芳1,段 霞1,陈 媛2,刘文娟2,魏 华1,赖卫华1,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西中德生物工程有限公司,江西 南昌 330029)
采用胶体金标记抗大肠杆菌O157:H7单克隆抗体(鼠源),通过将大肠杆菌O157:H7多克隆抗体和驴抗鼠抗体(二抗)喷涂于硝酸纤维素膜分别作为检测线和质控线,研制大肠杆菌O157:H7胶体金快速检测试纸条。通过优化实验,确定最佳条件为标记量16.8μg/mL、标记pH8.0、封闭剂PEG20000、检测时样品最佳pH7.0~7.5。对26株常见细菌交叉反应结果表明,该试纸条除与鼠伤寒沙门氏菌ATCC 13311和金黄色葡萄球菌CMCC 26003有轻微交叉反应外,与其他24株菌均无交叉反应。该试纸条灵敏度为104CFU/mL。用该试纸条检测大肠杆菌O157:H7操作简便、快捷、灵敏度高、特异性强。
大肠杆菌O157:H7;胶体金;试纸条
大肠杆菌O157:H7(Escherichia coli O157:H7)是一种常见的、重要的人畜共患致病菌。它可以引起多种疾病,如出血性结肠炎(hemorrhagic colitis)、溶血性尿路综合症(haemolytic uremic syndrome)[1-3]和血栓性血小板紫癜(thrombotic thrombocytopenic purpura)[4]等,它的感染剂量非常低,食入不足10个细菌就可引起疾病[5]。1982年美国第一次发现E.coli O157:H7,随后在美国、英国、加拿大、日本、澳大利亚和德国等地均有此菌感染事件的报道。我国受该菌的威胁也越来越大,2005年郑州市内发现3例E.coli O157:H7感染病例[6];据调查河南省波尔山羊的带菌率最高达到29.8%[7];张亚利等[8]对河北省1998年1月1日至1999年12月31日住院病例进行调查,发现有41例E.coli O157:H7感染疑似病例;徐景野等[9]从2001年一名男性腹泻患者粪便中分离得到E.coli O157:H7;陈冈等[10]对上海地区4家猪场的饲料、饮水、土壤、粪便以及空气112份样品进行检测,在粪便及土壤中均有E.coli O157:H7检出,其中E.coli O157:H7总阳性率为2.68%;朱根忠等[11]对在江苏省建湖地区2008年5月至9月采集腹泻患者、家禽和家畜的粪便以及水源水、肉制品、苍蝇等836份样本进行鉴定,检出肠出血性大肠杆菌O157:H7阳性标本17份;冯艳洁等[12]对秦皇岛食品中E.coli O157:H7污染情况进行监测,从220份食品中检出2株大肠杆菌O157:H7,检出2株可疑的大肠杆菌O157:H7。因此,建立快速准确灵敏的检测方法,对于诊断E.coli O157:H7引起的食物中毒及预防该菌引起食物中毒均有重要意义。
1971年Faulk等创立免疫胶体金技术以来,由于该技术有方便快捷、特异敏感、稳定性强、不需要特殊设备和试剂、结果判断直观等优点,得到广泛的应用。本研究拟以双抗夹心为模型,研制E.coli O157:H7胶体金试纸条,并对试纸条进行灵敏度和特异性评价。
1 材料与方法
1.1 菌株与抗体
E. coli O157:H7(CMCC 44828) 中国医学细菌保藏管理中心;其他菌株为本实验保存;兔抗E.coli O157:H7多克隆抗体由本实验室制备;鼠抗E.coli O157:H7单克隆抗体 Meridian公司。
1.2 试剂与仪器
氯化金(HAuC14) 天津市福晨化学试剂厂;柠檬酸三钠 北京化工试剂公司;硝酸纤维素膜、吸水纸、样品垫、结合垫、PVC底板 Millipore公司;PEG20000 Simga公司;BSA 北京新经科生物公司;驴抗鼠IgG无锡中德伯尔生物技术有限公司。
紫外分光光度计 上海棱光技术有限公司;Biodot点样仪、试纸条切刀 Biodot公司;磁力搅拌器 江苏金坛市金城国盛实验仪器厂。
1.3 细菌培养
将-80℃保存E. coli O157:H7划线接种于山梨醇麦糠凯平板上,37℃培养18h后挑取典型菌落接种于液体LB培养基中,37℃摇床培养8h。长双歧杆菌等厌氧细菌划线接种于MRS平板上,37℃厌氧培养24h,挑取单菌落于液体MRS中,37℃静置培养16h。其他细菌划线接种于LB平板上,方法同E. coli O157:H7。各种菌均用生理盐水梯度稀释后进行菌落计数。
1.4 胶体金试纸条制备
1.4.1 胶体金制备
胶体金的制备采用柠檬酸三钠还原法。将100mL 0.01% HAuCl4溶液加热煮沸,然后立即加入1.2mL 1%柠檬酸三钠溶液搅拌,溶液的颜色由浅黄→蓝色→深蓝→红色,当溶液的颜色完全变为透明的红色时,继续回流10min后停止加热,冷却至室温,4℃保存。
1.4.2 标记pH值的确定[13]
取7个2mL离心管,分别加入1mL胶体金溶液,用0.2mol/L K2CO3溶液将pH值分别调为5.0、6.0、7.0、7.5、8.0、8.5、9.0、9.5,各取100μL上述不同pH值的胶体金加入96孔板中,每孔加入10μL 1mg/mL的抗E.coli O157:H7单克隆抗体,混匀,静置5min后,每孔加入20μL 100g/L NaCl溶液,混匀,室温条件下放置10min,观察胶体金颜色变化,保持红色的pH值即为合适的标记pH值。
1.4.3 最佳标记量的确定
最佳标记量以目测法确定[14-15]。将待标记的抗E.coli O157:H7单克隆抗体逐级稀释后,各取10μL加入一系列装有100μL pH8.0胶体金的离心管中,摇匀室温放置5min后,分别加入10μL 100g/L NaCl,依次按表1进行,混匀静置2h以上观察结果。保持红色的离心管中,所含最低蛋白量(稳定1mL胶体金的必须蛋白量)的120%即为实际用量。
1.4.4 封闭剂的确定
取5个50mL洁净烧杯,分别加入10mL胶体金,用0.2mol/L K2CO3溶液调节pH8.0,分别加入1mL 168μg/mL抗E.coli O157:H7单克隆抗体,搅拌30min,其他试剂按表2加入,4℃、5000r/min离心30min,沉淀用重悬液重悬。用点样仪将重悬液点样于结合垫上(8μL/cm),真空干燥1~2h,将已纯化抗E. coli O157:H7多克隆抗体用pH7.2的PBS稀释至0.5mg/mL,点样于硝酸纤维素膜上(1μL/cm),37℃干燥4~5h。将滤纸、样品垫、结合垫和硝酸纤维素膜、吸水纸固定于PVC底板上,依次加入液体LB、PBS及108CFU/mL E. coli O157:H7培养液,10~15min后读取结果。
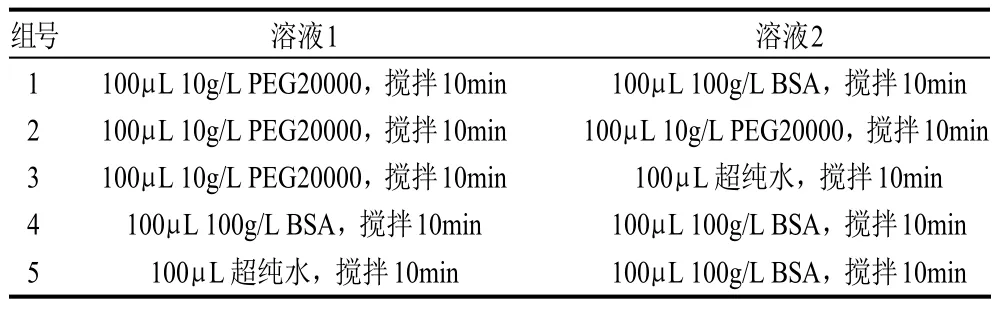
表2 封闭剂的确定Table 2 Design for the optimization of blocking reagents

表1 抗体最佳标记量确定Table 1 Design for the optimization of antibody label amount
1.4.5 样品最佳pH值确定
将PBS的pH值分别调至5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0,各取100μL加入试纸条中,10~15min后读取结果。
1.4.6 试纸条特异性
将培养好的各种细菌用p H 7.2的P B S稀释至107CFU/mL,分别取100μL用试纸条检测,并用pH7.2的PBS和液体LB作为阴性对照。
1.4.7 试纸条灵敏度
将E. coli O157:H7培养液用pH7.2的PBS稀释成103~107CFU/mL,分别加入试纸条中,并用pH7.2的PBS和液体LB作为阴性对照,10~15min后读取结果。
1.5 食品样品检测
市售莴苣、牛肉接种目的菌(E. coli O157:H7)和非目的菌(金黄色葡萄球菌 2 60 0 3、鼠伤寒沙门氏菌13311),经过前增菌后,用制备的胶体金试纸条检测,以测定该方法对于食品样品的实用性。
目的菌和非目的菌按1.3节方法培养后,测量其OD600,用生理盐水将全部菌稀释至102~103CFU/mL,并用平板准确计数各稀释液的浓度,目的菌稀释液记为a液,将非目的菌各取0.5mL混匀记为b液。其他试剂按表3进行,将各组37℃摇床培养10h。取各组增菌液用制备的胶体金试纸条检测,并将增菌液涂布与山梨醇麦康凯琼脂培养基上(E. coli O157:H7为无色菌落,其他菌为粉红色或红色菌落),以验证试纸条检测的准确性。
2 结果与分析
2.1 制备的胶体金分析
制备的胶体金紫外-可见光谱图见图1,其在535nm左右有强吸收峰。用透射电子显微镜观察颗粒大小均一,约为40nm左右(图2)。

图1 胶体金紫外扫描图Fig.1 UV-visible spectrum of colloidal gold

图2 胶体金电镜图Fig.2 TEM image of colloidal gold particles
2.2 标记pH值的确定
图3结果表明,pH7.5~8.5时,胶体金仍保持原来红色,胶体金溶液稳定,其他pH值条件下的胶体金有不同程度的颜色变浅现象。本实验选择pH8.0作为标记pH值。

图3 标记pH值的确定结果Fig.3 pH for antibody labeling
2.3 最佳抗体标记量的确定
图4结果显示,8~11号管胶体金保持红色,因此14μg为稳定1mL胶体金的必须蛋白量,本实验实际用量为16.8μg/mL(抗E. coli O157:H7单克隆抗体/胶体金)。
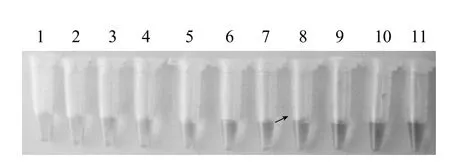
图4 最佳抗体标记量的确定结果Fig.4 Results for the optimization of antibody label amount
2.4 封闭剂的确定
如图5所示,加入液体LB和PBS时,1号、3号、4号T线出现不同程度显色,而2号T线不显色,加入E.coli O157:H7菌液时,1~4号T线显色无明显差异。因此本实验按2号方法标记胶体金。

表3 选择性增菌实验方案Table 3 Protocol of selective enrichment experiments

图5 封闭剂的确定结果Fig.5 Results for the optimization of blocking reagent
2.5 待检样品最佳pH值的确定
待检样品的pH值对胶体金试纸条检测影响很大,当样品pH值低至5.0或高至9.0时,胶体金残留于结合垫中,导致试纸条无效(C线不显色)。阴性样品pH值在5.5、6.0、6.5、8.0、8.5时,试纸条T线呈现不同程度的显色;而pH值在7.0~7.5时,T线不显色,非特异性吸附消除,结果见图6。因此检测时应将待检样品pH值调至7.0~7.5,以避免假阳性结果。

图6 样品最佳pH值的确定结果Fig.6 Results for the optimization of pH
2.6 试纸条特异性分析
试纸条与其他24株细菌呈阴性反应,包括肠致病性大肠杆菌(EPEC) CMCC44496、肠侵袭性大肠杆菌(EIEC) CMCC 44350、大肠杆菌CMCC 44102、大肠杆菌2DBE2001、阪崎肠杆菌CMCC 45401、阪崎肠杆菌CMCC 45402、福氏志贺氏菌301、福氏志贺氏菌2457、白色假丝酵母Z1、枯草芽孢杆菌168、枯草芽孢杆菌BD366、金黄色葡萄球菌CMCC 26001、金黄色葡萄球菌CMCC 26002、副溶血弧菌CGMCC 1.1997、副溶血弧菌CGMCC1.1616、单核细胞增生李斯特氏菌CMCC 54001、单核细胞增生李斯特氏菌CMCC 54007、长双歧杆菌NCC 2705、婴儿双歧杆菌ZDY18、短双歧杆菌C5、青春双歧杆菌LiB、嗜热链球菌G1、保加利亚乳杆菌F1、变形杆菌CMCC 49027,编号依次为1~24。与金黄色葡萄球菌CMCC26003(编号25)、沙门氏菌ATCC 13311(编号26)呈弱阳性反应,试纸条与pH7.2的PBS(编号27)和液体LB(编号28)呈阴性反应。结果见图7。

图7 试纸条特异性实验结果Fig.7 Specificity of the developed strip
2.7 试纸条灵敏度分析
本研究制备的E.coli O157:H7胶体金试纸条的灵敏度为104CFU/mL,结果见表4。

表4 试纸条灵敏度实验结果Table 4 Sensitivity of the developed strip
2.8 食品样品检测

图8 食品样品检测结果Fig.8 Detection of Escherichia coli O157:H7 in food samples
通过平板计数,确定了加入样品中的目的菌和非目的菌均为10~100CFU。通过增菌10h,牛肉组1和莴苣组1用试纸条检测均为阳性,牛肉组2和莴苣组2试纸条检测结果均为阴性,如图8所示,山梨醇麦康凯琼脂平板显示牛肉组1和莴苣组1中几乎全部为目的菌,与试纸条检测结果相符,而牛肉组2和莴苣组2中只有少数粉红色菌落,说明通过添加选择性试剂抑制了非目的菌的生长,因此用试纸条检测为阴性,从而弥补了试纸条本身特异性不足。
3 讨 论
E.coli O157:H7感染已经成为一个世界性公共卫生问题。建立快速准确的检测方法是预防该菌感染的重要手段。近年各种细菌的胶体金快速检测试纸条层出不穷。唐景峰等[16]制备了布鲁氏菌胶体金试纸条,灵敏度为3×103~5×103CFU/mL之间;辛志明等[17]制备了豚鼠气单胞菌胶体金试纸条,检测灵敏度为106CFU/mL。
蛋白质主要通过电荷吸引力、疏水作用力和共价键吸附在金表面,但离子强度、pH值及封闭剂等会破坏这3种力从而影响层析系统的性能,造成假阳性结果。本研究着重从消除这种非特异性吸附,对标记时pH值及封闭剂等进行优化,制备的试纸条与样品稀释液(pH7.2 PBS)及液体LB呈阴性反应。试纸条与鼠伤寒沙门氏菌ATCC 13311和金黄色葡萄球菌CMCC 26003有轻微的交叉反应,这可能是由于E. coli O157:H7与这两种菌有较多的相似抗原。对制备的试纸条应用于实际样品检测有以下思路:在样品前增菌过程中添加选择性试剂选择目的菌,以弥补试纸条特异性方面的不足;试纸条与前增菌培养基、稀释液应配套使用;将待检样品pH值调至7.0~7.5。用本研究所得的试纸条检测E.coli O157:H7快速、准确,具有很好的应用前景。
[1] Van DYCK M, PROESMANS W, DEPRAETERE M. Hemolytic uremic syndrome in childhood: renal function ten years later[J]. Clin Nephrol, 1988, 29(3): 109-112.
[2] TUTTLE J, GOMEZ T, DOYLE M P, et al. Lessons from a large outbreak of Escherichia coli O157:H7 infections: insights into the infectious dose and method of widespread contamination of hamburger patties[J]. Epidemiol Infect, 1999, 122(2): 185-192.
[3] KARMALI M A, PETRIC M, LIM C, et al. The association between idiopathic hemolytic uremic syndrome and infection by verotoxinproducing Escherichia coli[J]. Infectious Diseases, 1985, 151(5): 775-782.
[4] MORRISON D M, TYRRELL D L, JEWELL L D. Colonic biopsy in verotoxin induced hemorrhagic colitis and thrombotic thrombocytopenic purpura (TTP)[J]. Am J Clin Pathol, 1986, 86(1): 108-112.
[5] ONY J, ZHE L, ROBINS B R, et al. Prevalence of verocytotoxigenic Eshcherichia coli serotype O157:H7 in children with diarrhoea attendinga sydney hospital[J]. J Paediatr Child Health, 1993, 29(3): 185-187.
[6] 武恩平, 刘灵芝, 张燕. 郑州市2005年肠出血性大肠杆菌O157:H7感染状况调查[J]. 现代预防医学, 2006, 33(12): 2455-2456.
[7] 马宏, 张锦, 王建丽, 等. 河南省肠出血性大肠杆菌(EHEC O157:H7)感染之流行与基因特征研究[J]. 河南医学研究, 2004, 13(2): 116-120.
[8] 张亚利, 郭选秀, 李桂银, 等. 河北省肠出血性大肠杆菌O157:H7感染监测[J]. 疾病监测, 2003, 18(3): 86-88.
[9] 徐景野, 许国章, 徐奋奋, 等. 宁波市检出第一株肠出血性大肠杆菌O157: H7[J]. 疾病控制杂志, 2002, 6(2): 169-170.
[10] 陈冈, 葛菲菲, 徐锋, 等. 上海地区猪场饲养环境中大肠杆菌O157:H7的监测[J]. 上海畜牧兽医通讯, 2010(2): 55-56.
[11] 朱根忠, 吴芹. 江苏省建湖地区肠出血性大肠杆菌O157:H7监测分析[J]. 徐州医学院学报, 2009, 29(6): 394-395.
[12] 冯艳洁, 张海滨. 秦皇岛市食品中O157:H7大肠杆菌检测分析与探讨[J]. 中国卫生检验杂志, 2009, 19(7): 1630-1631.
[13] GEOGHEGAN W D, ACHERMAN G A. Adsorption of horseradish peroxidase, ovomucoid and anti-immunoglobulin to colloidal gold for the indirect detection of concanavalin A, wheat germ agglutinin and goat anti-human immunoglobulin G on cell surfaces at the electron microscopic level: a new method, theory and application[J]. J Histochem Cytochem, 1977, 25: 1178-1200.
[14] MEY J D. The preparation and use of gold probes[M]//POLAK J M,NOORDEN S V. Immunocytochemistry modern methods and applications. 2nd ed. Bristol: Wright PSG, 1986: 115-145.
[15] 严杰, 罗海波, 陆德源. 现代微生物学实验技术及其应用[M]. 北京:人民卫生出版社, 1997: 222-223.
[16] 唐景峰. 布鲁氏菌种特异性抗原抗体免疫胶体金试纸条的研制及初步应用[D]. 长春: 吉林大学, 2006.
[17] 辛志明, 豚鼠气单胞菌胶体金免疫层析快速检测试纸条的研制[D].福州: 福建农林大学, 2008.
Preparation of Colloidal Gold Strip for the Detection of Escherichia coli O157:H7
HUANG Ling-fang1,DUAN Xia1,CHEN Yuan2,LIU Wen-juan2,WEI Hua1,LAI Wei-hua1,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Jiangxi Zodolabs Biological Engineering Co. Ltd., Nanchang 330029, China)
Anti-Escherichia coli O157:H7 monoclonal antibody was labeled with colloidal gold to prepare a strip for the detection of E. coli O157: H7. Anti-E. coli O157:H7 polyclonal antibody and donkey anti-mouse IgG were dispensed on the nitrocellulose membrane as the test line and control line, respectively. The optimal conjugation was performed using 16.8μg/mL antibody at the condition of pH 8.0 and blocked with PEG20000. However, the optimal pH range for the detection was 7.0-7.5. Cross-reaction test was conducted by 26 bacteria strains. Results showed no obvious cross-reaction were observed except for the slight cross-reaction from Salmonella typhimurium ATCC13311 and Staphylococcus aureus CMCC26003.Meanwhile, the sensitivity of the developed strip was up to 104CFU/mL. Moreover, this kind of developed strip was characteristics of simple operation, rapid detection, high sensitivity and specificity.
Escherichia coli O157:H7;colloidal gold;strip
TS207.4
A
1002-6630(2010)24-0355-05
2010-08-03
科技部中小企业创新基金项目(10C26223601934);南昌市重大产业化项目(2009)
黄岭芳(1985—),女,硕士研究生,研究方向为食品质量与安全。E-mail:hlf8406@163.com
赖卫华(1968—),男,教授,博士,研究方向为食品科学。E-mail:talktolaiwh@163.com
