西藏种萨牦牛与犏牛挥发性风味组分比较研究
2010-10-28马美湖孙术国金永国李彦坡马长中贡桑玉珍
罗 章,马美湖*,孙术国,金永国,方 军,黄 群,李彦坡,马长中,施 树,贡桑玉珍
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.西藏农牧学院动物科学技术学院,西藏 林芝 860000)
西藏种萨牦牛与犏牛挥发性风味组分比较研究
罗 章1,2,马美湖1,*,孙术国1,金永国1,方 军1,黄 群1,李彦坡1,马长中2,施 树2,贡桑玉珍2
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.西藏农牧学院动物科学技术学院,西藏 林芝 860000)
以西藏种萨牦牛与犏牛为原料,采用顶空固相微萃取技术(HS-SPME)收集两种牛的背最长肌和臀股二头肌挥发性风味组分,利用高效气相色谱-质谱联用(GC-MS)技术对其风味组分进行定性和定量分析,并比较两者之间风味组分的差异。结果表明:种萨牦牛背最长肌的风味组分种类及含量明显优于犏牛,差异极显著(P<0.01);牦牛背最长肌的风味组分种类为96种,其主要组分为醛类,占总体风味组分体积分数的8.2448%,可以确定其为牦牛肉的特征风味之一,而犏牛的主要风味组分为酯类,占总体风味组分体积分数的0.3037%;牦牛臀股二头肌的风味组分种类多于犏牛,但总体含量稍低于犏牛,两者的主要风味组分均为酯类。
种萨牦牛;种萨犏牛;挥发性风味物质;顶空固相微萃取;气质联用
牦牛(Bos grunniens)素有“高原之宝”的美誉,主要分布在我国青藏高原地区高海拔、低气压、空气稀薄等恶劣严酷的环境中,对高寒缺氧的高原环境具有极强的适应性。牦牛全身是宝,肉质鲜嫩、无污染、营养丰富、口感细腻、风味独特,深受消费者青睐。目前有少量文献报道牦牛肉风味分析[1],但未见对牦牛肉不同部位和牛种之间风味组分种类及含量差异进行详细比较分析报道。
顶空固相微萃取技术(HS-SPME) 最早用于收集各种环境条件下水中污染物,再进行分析[2-3],后逐渐发展用于食品风味收集,譬如奶酪[4]、食用油[5]、咖啡[6]、生姜[7]和甜酒[8],也有科学家用于肉类风味组分的收集和分析[9-10],具有良好的风味组分收集能力。高效气相色谱-质谱联用(GC-MS)技术具有分离效率高、定量准确,以及质谱的选择性高、能高效鉴别物质并提供丰富的结构信息,定性和定量分析风味组分,已广泛应用于食品中易挥发性物质或风味组分的分析[11]。本实验采用顶空固相微萃取(HS-SPME)技术与GC-MS分析技术相结合,比较研究西藏林芝地区种萨牦牛及犏牛的背最长肌和臀股二头肌风味的挥发性组分,为西藏牦牛及犏牛肉的风味研究与产业化开发提供理论基础。
1 材料与方法
1.1 材料与试剂
从西藏林芝地区贡布江达县种萨乡天然牧场随机选取发育正常、健康无病、年龄在5岁左右的成年公牦牛和犏牛各3头为研究对象,西藏牦牛饲养是在纯天然草场上终年放牧,很少补饲,牦牛生长缓慢,屠宰年龄一般确定为5岁左右,选用此年龄阶段牛肉作原料,对实际生产有指导意义。
环已酮(色谱纯) 德国Meker公司;其他试剂均为分析纯。
1.2 仪器与设备
顶空固相微萃取器(SPME)、Fiber 75μm CAR/PDMS型萃取头 美国Supelco公司;QP2010气相色谱-质谱联用仪 日本岛津公司;DB-5ms色谱柱(30m×0.25mm,0.25μm) 美国Agilent公司。
1.3 方法
1.3.1 取样方法
按照国家标准(GB/T 9695.19—2008《肉与肉制品取样方法》)取样[12],然后将样品真空包装,置于4℃条件贮藏备用,贮藏时间不超过3d。
1.3.2 西藏种萨牦牛与犏牛挥发性风味组分测定试验设计
分别取牦牛和犏牛牛背最长肌和臀股二头肌肉样,经预处理后采用顶空固相微萃取器(HS-SPME)收集牛肉的风味组分,GC-MS分析得到两种牛肉挥发性组分的质谱图,比较研究两种牛肉的特征性风味组分。分析检测实验重复3次,获得数据取其平均值。
1.3.3 挥发性风味组分顶空捕集(HS-SPME)
从4℃冰箱取出牛肉样品,在5~10℃工作环境中迅速斩拌成0.3~0.5mm肉糜,准确称取肉糜8g,装入15mL顶空萃取瓶,然后加入10%氯化钠混合均匀,于60℃条件下搅拌30min[13]。然后将活化好的萃取头插入顶空瓶(每次进样前将萃取头老化30min),富集吸附风味物质30min,取出后插入GC-MS进样口解吸进样5min,最后从GC-MS进样口拔萃取头。
1.3.4 GC-MS联用仪测定条件
GC条件设定:柱温箱35℃;进样温度250℃;压力35.3kPa;总流量15.3mL/min;柱流量0.84mL/min;线速度33.0cm/s;吹扫流量6.0mL/min;程序升温:初温35℃,保持5min,然后以5℃/min升高到120℃,不保持,最后以10℃/min升高到230℃,保持8min;采用分流进样模式,分流比10:1;FID检测器。
MS条件设定:离子源温度230.0℃,接口温度250.0℃,溶剂延迟时间2.5min,开始时间3.00min,结束时间41.00min,扫描速度666u/s,开始m/z 35.00,结束m/z 350.00。
1.3.5 风味组分的质谱分析
根据GC-MS所得质谱图,检索NIST 05a.L数据库,定性牛肉的挥发性组分。根据面积归一化法求得各化学成分在牛肉风味物质中的相对含量。
1.3.6 统计方法
主要采用SPSS 9.0统计软件进行数据统计分析,利用单向方差分析法(one-way analysis of variance)分析不同牛种,不同部位肉的风味物质组成差异。
2 结果与分析
2.1 种萨牦牛背最长肌的挥发性风味物质测定

图1 种萨牦牛背最长肌总离子谱图Fig.1 Total ion chromatograms (TICs) of longissimus muscle of yak
牛肉的挥发性风味成分种类及含量为牛肉品质非常重要的指标,风味组分来源于两个方面,一是牛肉脂肪的氧化产生[14],另一方面是美拉德反应产生[15]。由图1分析可知,从种萨牦牛背最长肌挥发性组分中共分离出92种化合物,其中醛类化合物5种,相对含量达8.2448%;酯类化合物4种,相对含量为0.5079%;烷烃类化合物3种,相对含量为1.2698%;芳香族化合物2种,相对含量为0.1899%;醇类化合物1种,相对含量为0.0849%。
2.2 犏牛背最长肌的挥发性风味物质测定
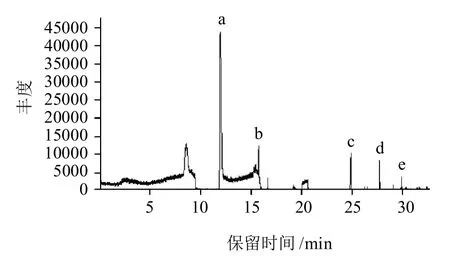
图2 种萨犏牛背最长肌总离子谱图Fig.2 Total ion chromatograms (TICs) of longissimus muscle of dzo
由图2分析可知,从种萨犏牛背最长肌挥发性成分中共分离出59种化合物,其中芳香族化合物3种,相对含量为0.1721%;酯类化合物1种,相对含量为0.3037%;烷烃类化合物1种,相对含量为0.0792%。2.3 种萨牦牛和犏牛背最长肌的挥发性风味比较
为了深入比较分析种萨牦牛和犏牛背最长肌的主要挥发性组分特点,特对种萨牦牛和犏牛背最长肌的醛类、脂类、烷烃类、芳香族和醇类进行定性和定量分析(表1)。结果表明,种萨牦牛背最长肌的醛类主要是壬醛和2-癸烯醛,由于醛类的香气阈值很低,能赋予牛肉愉快的甜香味和水果味[16],因此是种萨牦牛肉非常重要的特征香气组分。种萨牦牛背最长肌第二大香气组分为烷烃类,譬如柠檬烯、癸烷,柠檬烯赋予牛肉类似柠檬的香味,癸烷具有甜润的动物香气,值得注意的是种萨牦牛和犏牛背最长肌都含有癸酸乙酯,其具有椰子香型香气。另外牦牛背最长肌风味组分还含有少量的醇类,主要为十七醇。总体来说,种萨牦牛背最长肌挥发性组分的种类和含量明显优于犏牛。2.4 种萨牦牛臀股二头肌挥发性风味测定
牦牛和犏牛臀股二头肌为主要食用部位,直接影响牛肉整体品质,由图3分析可知,从种萨牦牛臀股二头肌中共分离出挥发性组分多达39种,其中酯类化合物2种,相对含量为0.4076%;烷烃类化合物1种,相对含量为0.3019%;芳香族化合物2种,相对含量为0.0455%;杂环类化合物1种,相对含量为0.0149%。
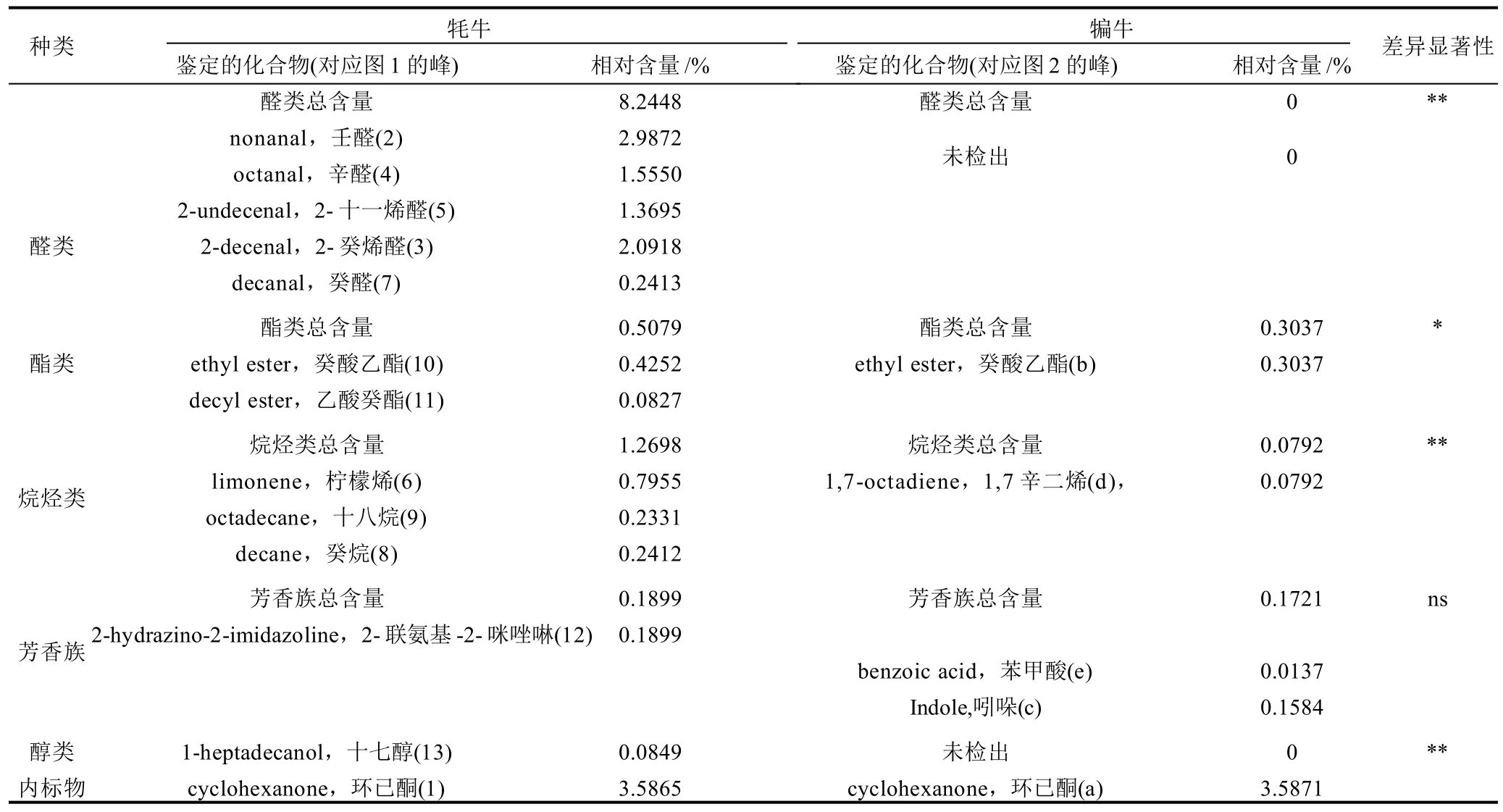
表1 种萨牦牛和犏牛背最长肌的主要挥发性组分比较Table 1 Comparison of the main volatile components in longissimus muscle of yak and dzo

表2 牦牛和犏牛臀股二头肌挥发性风味比较Table 2 Comparison of the main volatile components in gluteobiceps muscle of yak and dzo
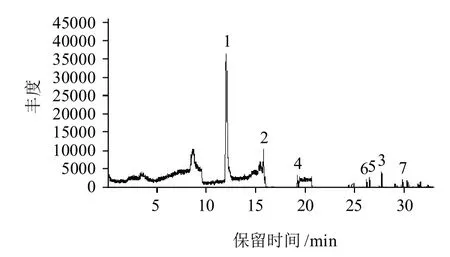
图3 种萨牦牛臀股二头肌总离子谱图Fig.3 Total ion chromatograms (TICs) of gluteobiceps muscle of yak
2.5 犏牛臀股二头肌挥发性风味测定

图4 种萨犏牛臀股二头肌总离子谱图Fig.4 Total ion chromatograms (TICs) of gluteobiceps muscle of dzo
由图4分析可知,从种萨犏牛臀股二头肌的挥发性组分中共分离出36种化合物,其中酯类化合物1种,相对百分含量为1.1114%;芳香族类化合物2种,相对含量为0.2137%;烷烃类化合物1种,相对含量为0.0334%。总体来说,种萨牦牛臀股二头肌挥发性组分的种类多于犏牛,但总含量稍低于犏牛。
2.6 种萨牦牛和犏牛臀股二头肌挥发性风味物质比较
为了深入地比较分析种萨牦牛和犏牛臀股二头肌的主要挥发性风味特点,特对种萨牦牛和犏牛臀股二头肌的酯类、烷烃类、杂环类化合物和芳香族类风味物质进行定性和定量分析,结果见表2。研究表明,种萨牦牛和犏牛臀股二头肌的主要挥发性风味均为酯类,都含癸酸乙酯,赋予牛肉椰子香型香气,牦牛臀股二头肌含有少量的乙酸丙酯,赋予其轻微果实香味。种萨牦牛臀股二头肌的风味组分还含有相对较高的柠檬烯,而犏牛臀股二头肌芳香族化合物含量相对较高。
3 结 论
顶空固相微萃取技术(SPME)能有效收集两种牛背最长肌肉和臀股二头肌挥发性风味组分,经高效气相色谱-质谱联用(GC-MS)分析,获得种萨牦牛和犏牛背最长肌风味组分分别为92种和59种化合物,种萨牦牛背最长肌风味物质种类丰富,与犏牛相比差异极显著(P<0.01),种萨牦牛背最长肌主要风味组分为醛类,含量占总体风味组分体积分数的8.2448%,可以确定其为种萨牦牛的特征风味之一。而犏牛背最长肌的主要风味组分为酯类,占总体风味组分体积分数的0.3037%。醛类一般是由牛肉的不饱和脂肪酸在60℃左右氧化分解产生[17],这些不饱和脂肪酸为油酸[18],因此,可以推测种萨牦牛背最长肌与犏牛的背最长肌相比,不饱和脂肪酸,特别是油酸含量较高。获得的牦牛和犏牛臀股二头肌风味组分分别为39种和36种化合物,两种牛臀股二头肌风味物质组成及各组成成分的含量接近,差异不显著(P>0.05)。相对而言,牦牛臀股二头肌的风味组分种类稍多于犏牛,但总体含量稍低于犏牛,两者的主要风味组分均为酯类。
本实验对西藏种萨牦牛及犏牛肉风味组分的组成进行了较为深入的分析,然而西藏牛种特殊风味组分的形成、组成及其开发应用还需更进一步的研究。
[1] 罗毅皓, 刘书杰. 青海大通牦牛肉氨基酸及风味分析[J]. 食品科技,2010, 35(2): 106-110.
[2] ARTHUR C L, PAWLISZYN J. Solid phase microextraction with thermal desorption using fused silica optical fibers[J]. Analytical Chemistry,1990, 62: 2145-2148.
[3] ARTHUR C L, KILLAM L M, MOTLAGH S, et al. Analysis of substituted benzene compounds in groundwater using solid-phase microextraction[J]. Environmental Science and Technology, 1992, 26:979-983.
[4] LECANU L, DUCRUET D, JOUQUAND C, et al. Optimization of headspace solid-phase microextraction (SPME) for the odor analysis of surface-ripened cheese[J]. Journal of Agricultural and Food Chemistry,2002, 50(13): 3810-3817.
[5] STEENSON D F, LEE J H, MIN D B. Solid phase microextraction of volatile soybean oil and corn oil compounds[J]. Journal of Food Science,2002, 67(1): 71-76.
[6] AKIYAMA M, MURAKAMI K, OHTANI N, et al. Analysis of volatile compounds released during the grinding of roasted coffee beans using solid-phase microextraction[J]. Journal of Agricultural and Food Chemistry, 2003, 51(7): 1961-1969.
[7] SHAO Y, MARRIOTT P, SHELLIE R, et al. Solid-phase microextraction-comprehensive two-dimensional gas chromatography of ginger (Zingiber officinale) volatiles[J]. Flavour and Fragrance Journal,2003, 18: 5-12.
[8] LEE J H, KANG J H, MIN D B. Optimization of solidphase microextraction for the analysis of headspace volatile compounds in kimchi, a traditional Korean fermented vegetable product[J]. Journal of Food Science, 2003, 68(3): 844-848.
[9] RUIZ J, CAVA R, VENTANAS J, et al. Headspace solid phase microextraction for the analysis of volatiles in a meat product: dry-cured iberian ham[J]. Journal of agricultural and food chemistry, 1998, 46 (11):4688-4694.
[10] MADRUGA M S, ELMORE J S, DODSON A T, et al. Volatile flavour profile of goat meat extracted by three widely used techniques[J]. Food Chemistry, 2009, 115: 1081-1087.
[11] SEKHON R K, SCHILLING M W, PHILLIPS T W. Effects of phosphine and methyl bromide fumigation on the volatile flavor profile and sensory quality of dry cured ham[J]. Meat Science, 2010, 86(2): 411-417.
[12] GB/T 9695.19—2008肉与肉制品取样方法[S]. 北京: 中国标准出版社, 2008.
[13] 郭辽朴. 荣昌乳猪与PIC乳猪不同部位肌肉理化特性及主体风味物质研究[D]. 重庆: 西南大学, 2009.
[14] MACLEOD G, SEYYEDAIN-ARDEBILI M. Natural and simulated meat flavor (with particular reference to breed)[J]. Critical Review of Food Science and Nutrition, 1981, 14: 309-437.
[15] MOTTRAM D S. Flavour formation in meat and meat products: a review[J]. Food Chemistry, 1998, 62: 415-424.
[16] INSAUSTI K,, PETRI E, et al, et al. Effect of weight at slaughter on the volatile compounds of cooked beef from Spanish cattle breeds [J]. Meat Science, 2005, 70: 83-90.
[17] MANLEY C H. Progress in the science of thermal generation of aromas:a review[C]//Thermal generation of aromas. Washington, DC: American Chemical Society, 1988.
[18] FORSS D A. Odor and flavor compounds from lipids[J]. Programme for Chemists in Fats and Other Lipids, 1972, 13: 181-258.
Comparison of Volatile Flavor Components of Yak and Dzo Meat from Tibet
LUO Zhang1,2,MA Mei-hu1,*,SUN Shu-guo1,JIN Yong-guo1,FANG Jun1,HUANG Qun1,LI Yan-po1,MA Chang-zhong2,SHI Shu2,GONGSANG Yu-zhen2
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;2. College of Animal Science and Technology, Tibet Agricultural and Animal Husbandry College, Linzhi 860000, China)
The flavor components in longissimus dorsi and gluteobiceps muscles of yak and dzo from Linzhi, Tibert were extracted using headspace-solid phase microextraction (HS-SPME) and then analyzed by gas chromatography-mass spectroscopy(GC-MS). The results showed that the varieties and content of flavor components of yak were significantly higher than those of dzo (P<0.01). There are 96 flavor compounds in the longissimus muscle of yak, and the main compounds are aldehydes,accounting for 8.2448% of the total flavor components, which could be the characteristic flavor components of the yak meat.The main flavor components in the longissimus muscle of dzo are esters, accounting for 0.3037% of the total flavor components.The main flavor components in the gluteobiceps muscles of the two bovine species are esters. There are more varieties of flavor compounds in the gluteobiceps muscles of yak, however, their relative contents were lower.
yak;dzo;flavor components;headspace-solid phase micro-extraction (HS-SPME);gas chromatography-mass spectrometry (GC-MS)
TS207.3
A
1002-6630(2010)24-0325-04
2010-07-13
罗章(1965—),男,副教授,博士,研究方向为畜产品加工及贮藏。E-mail:luozhang1759@sohu.com
马美湖(1957—),男,教授,博士,研究方向为肉类、蛋品科学。E-mail:mameihuhn@yahoo.com.cn
