细胞外钙受体调节人脐静脉内皮细胞游离钙离子浓度的研究
2010-10-28陈雄英王振焕胡清华钟华邓峰美何芳
陈雄英,王振焕,胡清华,钟华,邓峰美,何芳
(1石河子大学医学院/新疆地方与民族高发病重点实验室,石河子832002;2华中科技大学同济医学院/卫生部呼吸系统疾病重点实验室,武汉430030)
细胞外钙受体调节人脐静脉内皮细胞游离钙离子浓度的研究
陈雄英1,王振焕1,胡清华2,钟华1,邓峰美1,何芳1
(1石河子大学医学院/新疆地方与民族高发病重点实验室,石河子832002;2华中科技大学同济医学院/卫生部呼吸系统疾病重点实验室,武汉430030)
为探讨人脐静脉内皮细胞(HUVEC)游离钙离子浓度是否受细胞外钙受体(CaR)的调节。采用Western blot及RT-PCR技术检测CaR在 HUVEC中蛋白及mRNA表达。使用CaR激动剂精胺,负性变构调节剂Calhex231,通过钙荧光探针(Fura-2/AM)负载 HUVEC检测细胞内钙离子浓度([Ca2+]i)。结果显示:(1)HUVEC中有CaR的表达。(2)在Fura-2/AM负载 HUVEC中加入精胺刺激,[Ca2+]i为△ratio=0.24±0.01,先加入Calhex231作用1min后再加入Calhex231+精胺刺激,[Ca2+]i为△ratio=0,两组比较差异有统计学意义(P<0.05)。由此可知,CaR调节 HUVEC游离钙离子浓度。
细胞外钙受体;Calhex231;细胞内钙离子浓度
Abstract:To study whether intracellular Ca2+concentration([Ca2+]i)is regulated by Ca-sensing receptor(CaR)in human umbilical vein endothelial cells(HUVEC).CaR protein was demonstrated by Western blot.The mRNA expression of CaR was investigated by RT-PCR in HUVEC.The fluorescence Ca2+indicator Fura-2/AM was used to observe[Ca2+]iin the presence of CaR agonists spermine and negative allosteric modulator Calhex231.(1)CaR is present in HUVEC.(2)There was significantly difference in[Ca2+]ibetween spermine(△ratio=0.24 ±0.01)and Calhex231+spermine(△ratio=0)(P<0.05).CaR regulates[Ca2+]iin HUVEC.
Key words:calcium-sensing receptor;Calhex231;intracellular Ca2+concentration
钙离子作为金属离子并不象其它大分子可被表达和降解,其无论在细胞内或细胞外执行功能必须首先达到或维持一定浓度,而且在细胞内外维持一定的浓度差。细胞内钙离子浓度可由各种信号分子、钙泵及钙离子通道等多种因素精确调控。其中包括由细胞外钙受体(The extracellular Ca-sensing receptor,CaR)介导的细胞内钙池释放和电压门控性钙离子通道(Voltage-gated Ca2+channels,VOC)、受体操纵钙离子通道(Receptor-operated channels,ROC)、及瞬时型感受器电位(transient receptor potential canonical,TRPC)通道等介导的外钙内流[1,2]。有研究表明在人的脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)中,激动剂ATP、组胺通过触发细胞内钙池释放激活小电导系数钙敏感钾通道(small-conductance,SKCa)和中电导系数钙敏感钾通道(intermediateconductance Ca2+-activated K+,IKCa),介导细胞膜超极化。而这种激动剂触发的细胞内钙池释放是否与激活 G蛋白偶联受体有关尚不清楚[3],有待进一步研究。
CaR为 G蛋白偶联受体超家族中的成员,属于G蛋白偶联受体超家族中C亚族的成员,其基本结构与一般 G蛋白偶联受体相同,由1078个氨基酸组成[4]。该受体最早克隆于甲状旁腺,在维持全身钙稳态中发挥重要作用,通过感受细胞外Ca2+浓度(extracellular Ca2+concentration,[Ca2+]o)变化调节甲状旁腺素(PTH)的分泌。当[Ca2+]o升高时,激活 CaR经磷脂酶 C(phospholipid lipoidase,PLC),增加胞内三磷酸肌醇和二磷酸甘油,使细胞内钙离子浓度(intracellular Ca2+concentration,[Ca2+]i)升高、抑制PTH的分泌。
本研究以原代培养 HUVEC为研究对象,通过钙荧光探针(Fura-2/AM)负载 HUVEC检测精胺与Calhex231+精胺共孵育时[Ca2+]i的变化。探讨HUVEC游离钙离子浓度是否受CaR的调节。
1 材料与方法
1.1 材料
剖宫产健康胎儿的新鲜脐带,性别、体重不限。
ECM培养基购自 Sciencellg公司,精胺、Calhex231为 sigma公司产品。CaR一抗为 Affinity Bioreagents产品。辣根过氧化物酶偶联的山羊抗小鼠二抗为Sigma产品。RNA提取用 Trizol,RTPCR试剂盒购自东盛科技。Fruo-2购自invitrogen公司。其余均为国产分析纯试剂。
1.2 人脐静脉内皮细胞(HUVEC)原代及传代培养
取剖宫产健康胎儿新鲜脐带,以胰蛋白酶消化法培养 HUVEC。胰蛋白酶注入脐静脉内,室温消化10 min后,10%FBS的M199培养基终止反应。1000r/min,离心8min,ECM培养基重悬细胞沉淀,置于37℃,5%CO2恒温培养箱内孵育。细胞生长融合后,以104~105/mL的密度传代培养。取生长状态良好的2~5代细胞用于实验。
1.3 细胞的蛋白样品制备和Western blot检测
弃去培养基,加入冷的0.01 mol/L PBS洗2次,加入100μL蛋白裂解液,细胞刮棒刮下贴壁细胞,将黏稠状细胞裂解产物收集于eppendorf管中。冰浴中静置30 min,12 000 r/min,4℃,离心5 min。将上清移入另一eppendorf管中,弃去沉淀。BCA方法蛋白定量。样品置于加样缓冲液中,沸水煮5 min,以 SDS-PAGE电泳分离蛋白,电转至醋酸纤维素膜(PVDF膜)上,室温下用 5%脱脂奶粉TBST溶液封闭1h。随后加入CaR(1∶1 000)一抗,4℃孵育过夜。次日用 TBST缓冲液洗4次。加入辣根过氧化物酶标记二抗(1∶10 000),室温轻摇1 h,TBST洗膜4次。ECL化学发光试剂显色,显影定影处理,获得实验结果。
1.4 RT-PCR检测
用 Trizol从 HUVEC中提取总 RNA,逆转录成cDNA。体系含 Rnase Free H2O 6μL,5×RTBuffer4μL,dNTPMxituro2μL,Rnase inhibitor1 μL,oligo(dT)201μL,RNA 5μL,ReverTraAce1 μL。反应条件:42℃,20 min;99℃,5 min;4℃,5 min。
PCR法检测CaR mRNA的表达。上游引物:5′-GAA GTCGGGTATTACAACG-3′,下 游 引 物 :5′-GAGCAGGGAGAAGA GGAG-3′,扩增片段为459 bp。PCR反应条件:94℃预变性3 min;30次循环(94℃30 s,55℃30 s,72℃30 s);72℃延伸10 min。PCR产物行1.5%琼脂糖凝胶电泳,电泳条带经凝胶成像系统分析后获得实验结果。
1.5 HUVEC[Ca2+]i的测定
将第2代或第3代 HUVEC接种于放有圆形玻片的六孔板中。待细胞达80%融合时,将玻片取出放入自制的灌流槽中,用含有2μmol/L Fura-2/AM的HBS(CaCl21.5 mmol/L,NaCl 140 mmol/L,KCl 5 mmol/L,HEPES 20 mmol/L,MgCl22 mmol/L,Glucose.H2O 10 mmol/L)溶液37℃孵育细胞15 min后,冲洗,并继续用 HBS溶液孵育15~20 min使 Fura-2/AM去酯化。然后用 HBS溶液反复冲洗。
将灌流槽放于倒置荧光显微镜(Olympus XI70)上,40倍镜下调整细胞层面,用本实验室自行研制的全自动显微灌流控制系统来控制所加药物灌流液的转换。同时用340 nm与380 nm波长的激发光激发钙离子荧光探针Fura-2发射荧光,用CCD拍摄荧光的动态变化并通过钙荧光成像系统 IPA software进行分析。
1.6 统计学处理
实验数据用 ¯x±S差表示,组间比较用单因素方差分析,均数间的比较采用 t检验。所有数据采用SPSS13.0统计软件包进行分析,以 P<0.05表示差异有统计学意义。
2 结果
2.1 HUVEC中CaR的表达
2.1.1 HUVEC中CaR蛋白表达
见图1,可见100~130 ku CaR蛋白表达,2条带均为目的蛋白。
2.1.2 HUVEC中CaRmRNA表达
见图2,可见459 bp的CaRmRNA表达。

图1 Western blot检测CaR蛋白的表达Fig.1 The protein expression of CaR analyzed by Western blo t
2.2 精胺、Calhex231+精胺刺激下对HUVEC细胞内钙离子浓度的影响
2.2.1 精胺刺激下HUVEC细胞内钙离子浓度明显增加
Fura-2/AM负载 HUVEC后,用 Ca2+-free HBS溶液(EGTA 1 mmol/L,NaCl 140 mmol/L,KCl 5mmol/L,HEPES 20mmol/L,MgCl22 mmol/L,Glucose.H2O 10 mmol/L)检测1 min后换Ca2+-free HBS配制的2 mmol/L的精胺持续灌流,大约8 min时[Ca2+]i浓度达最高峰,共检测20 min[Ca2+]i(0.38±0.02)(0.62±0.01),n=3,P<0.05)。结果(图3)显示:精胺刺激下,HUVEC细胞内钙离子浓度明显增加。
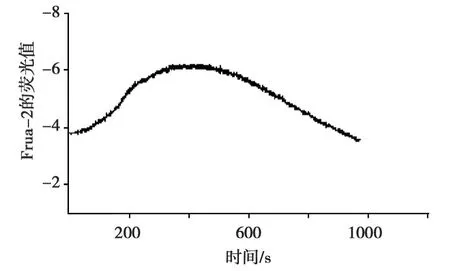
图3 精胺刺激下HUVEC细胞内钙离子浓度的变化Fig.3 The change of[Ca2+]istimulated by spermine in HUVEC

图2 RT-PCR检测CaR mRNA的表达Fig.2 The mRNA expression of CaR analyzed by RT-PCR
2.2.2 Calhex231抑制精胺刺激下HUVEC细胞内钙离子浓度的增加
Fura-2/AM负载 HUVEC,Ca2+-free HBS溶液检测1 min后,使用全自动显微灌流控制系,用Ca2+-free HBS配制的 1μmol/L Calhex231将 Ca2+-free HBS溶液置换掉,继续检测1 min,再用 Ca2+-free HBS配制Calhex231+精胺(浓度同前)置换掉Ca2+-free HBS配制的Calhex231灌流20 min,[Ca2+]i(ratio 0.29±0.04 to 0.29±0.04,n=3,P<0.05),结果见图4。比较图4与图3所得[Ca2+]i结果(△ratio=0.24±0.01与0,P=0.000),有显著统计学意义。这显示:Calhex231明显抑制精胺刺激下 HUVEC细胞内钙离子浓度的增加。
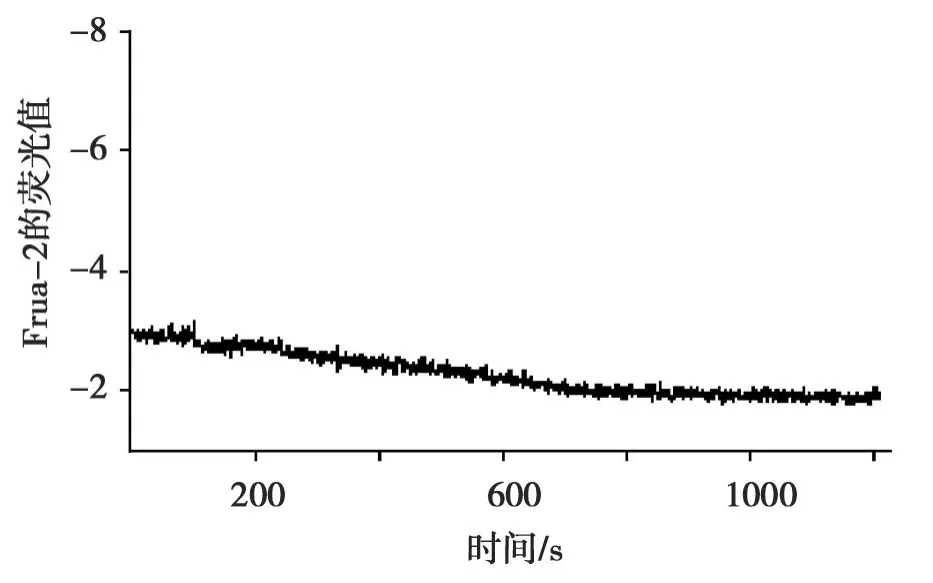
图4 Calhex231刺激下H UVEC细胞内钙离子浓度的变化Fig.4 The change of[Ca2+]istimulated by Calhex231 in HUVEC
3 讨论
CaR具有广泛宿主表达的特点,除了功能性表达于骨、肾、肠这3个主要的与钙转移和钙稳态调节有关的器官外,CaR也广泛分布于脑、皮肤、血管及内皮细胞、心肌细胞等各种不同组织和细胞,通过PLC、磷脂酰肌醇激酶及促丝裂原活化蛋白激酶等细胞内信号转导途径起着除钙稳态调节以外重要的细胞内作用,如保护细胞抗凋亡,促细胞增殖、诱导细胞分化,促进激素分泌和离子通道激活等[4]。本研究证明HUVEC中有CaR的表达。
CaR可被不同的激动剂激活,其中 Ca2+、新霉素、钆及精胺等都可以作为配体来激活 CaR[5]。Ziegelstein RC等证实在人的主动脉血管内皮细胞中有功能性的CaR表达,激动剂精胺刺激下,通过三磷酸肌醇和ryanodine敏感的钙池释放,可引起[Ca2+]i增加[6]。本研究证实HUVEC中有CaR表达,以激动剂精胺作为配体来激活CaR,发现在精胺的刺激下,HUVEC细胞内钙离子浓度明显增加。但精胺并不是CaR特异性的激动剂。有研究表明Calhex231是一种新型的CaR负性变购调节剂[7],CaR激动剂Ca2+或calindol的增加,可引血管平滑肌细胞去极化,而这种去极化的效应可被 Calhex231抑制[8]。本研究在负性变购调节剂 Calhex231作用 HUVEC后,再用精胺刺激。结果表明,Calhex231明显抑制精胺刺激下 HUVEC细胞内钙离子浓度的增加。充分证明 HUVEC中游离钙离子浓度受CaR的调节。
血管系统中的一氧化氮(nitric oxide,NO)等舒血管物质的生成与血管内皮细胞中细胞内钙离子浓度有关。生理条件下,NO主要源于内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS),而eNOS-NO信息系统的健全又是内皮细胞发挥生理作用的关键,内皮细胞的正常与否直接关系到血管内环境的稳定。对细胞内游离钙离子浓度的研究,可能对深入了解血管生理和病理生理起着重要的作用。再者细胞内游离钙离子浓度维持与内钙释放和外钙内流的调节有关,CaR在此相互关联的两个过程中的作用和机制有待进一步的研究。
[1] Sanderson M J,Delmotte Y.Regulation of airway smooth muscle cell contractility by Ca2+signaling and sensitivity[J].Proc Am Thorac Soc,2008,5(1):23-31.[2]Nilius B,Owsianik G,Voets T,et al.Transient receptor potential cation channels in disease[J].Physiol Rev,2007,87(1):165-217.
[3]Sheng J Z,Braun A P.Small-and intermediate-conductance Ca2+-activated K+channels directly control agonist-evoked nitric oxide synthesis in human vascular endothelial cells[J].Am J Physilo Cell Physiol,2007,293(1):458-467.
[4]Smajilovic S,Tfelt-Hansen J.Calcium acts as a first messenger through the calcium-sensing receptor in the cardiovascular system[J].CardiovascularResearch,2007,75(3):457-467.
[5]D’Souza-Li L.The calcium-sensing receptor and related diseases[J].Arq Bras Endocrinol Metabol,2006,50(4):628-639.
[6]Ziegelstein R C,Xiong Y,He C,et al.Expression of a functional extracellular calcium-sensing receptor in human aortic endothelial cells[J].Biochem Biophys Res Commun,2006,342(1):153-163.
[7]Kessler A,Faure H,Petrel C,et al.N1-Benzoyl-N2-[1-(1-naphthyl)ethyl]-trans-1,2-diaminocyclohexanes:development of 4-chlorophenyl carboxamide(Calhex 231)as a new calcium sensing receptor ligand demonstrating potent calcilytic activity[J].J Med Chem,2006,49(17):5119-5128.
[8]Weston A H,Absi M,Ward D T,et al.Evidence in favor of a calcium-sensing receptor in arterial endothelial cells:studies with calindol and Calhex 231[J].Circ Res,2005,97(4):391-398.
Extracellular Ca-sensing Receptor Regulating Intracellular Ca2+Concentration in Human Umbilical Vein Endothelial Cells
CHEN Xiongying1,WANG Zhenghuang1,HU Qinghua2,ZNONG Hua1,DENG Fengmei1,HE Fang1
(1 Medical College,Shihezi University/Ministry of Education Key Laboratory of Xinjiang Endemic and Ethnic Diseases,Shihezi 832002,China;2 Tongji Medical College,Huazhong University of Science and Technology/Key Laboratory of Pulmonary Disease of Ministry of Health of China,Wuhan 430030,China)
R363.272
A
1007-7383(2010)04-0453-04
2009-10-11
国家自然科学基金项目(30860099)
陈雄英(1983-),女,硕士生,专业方向为心血管病理生理研究。
何芳(1964-),女,教授,从事心血管病理生理研究;e-mail:FangF2002shz@126.com。
