天山雪莲△9硬脂酰脱饱和酶基因信号肽的功能分析*
2010-10-28陈尚珂孙建富王爱英沈海涛祝建波
陈尚珂,孙建富,王爱英,沈海涛,祝建波
(石河子大学生命科学学院农业生物技术重点实验室,石河子832003)
天山雪莲△9硬脂酰脱饱和酶基因信号肽的功能分析*
陈尚珂,孙建富,王爱英,沈海涛,祝建波
(石河子大学生命科学学院农业生物技术重点实验室,石河子832003)
为了验证天山雪莲△9硬脂酰脱饱和酶基因sikSA D信号肽的功能,本研究利用PCR法从已构建的天山雪莲cDNA文库中克隆了sikSA D的96 bp信号肽序列,将其与报告基因GFP连接,成功构建了融合基因植物表达载体pCMBIA2301-sp-GFP。通过农杆菌介导的叶盘法转化烟草NC89,获得转基因植株。通过激光共聚焦显微镜观察GFP在转基因烟草叶片中的激发荧光,确定天山雪莲△9硬脂酰脱饱和酶sikSA D定位于天山雪莲的叶绿体中。关键词:sikSA D;导肽;GFP;亚细胞定位
Abstract:To authenticate the function ofsikSA D's signal peptide,the 96 bp signal peptide sequence by using PCR from cDNA library ofS asussured involucrateKar.et Kir which had been constructed was cloned,then ligated with report geneGFP,constructed a plant expression vector pCMBIA2301-sp-GFP.Transformed them into tobacco NC89 byA grobacterium-mediated transformation method,and got the transgenic plant.Subcellular localization ofsikSA Dwas examined by laser confocal microscope by using the approaches of GFP-tagging.
Key words:sikSA D;targeting peptide;GFP;subcellular localization
利用不同来源的信号肽改造蛋白质序列,制备各种融合蛋白,由此改变蛋白质的定位,以提高外源蛋白的表达量,在基因工程应用领域显示了广阔的前景[1]。拟南芥FAD5(SAD3)不同于其它的SAD酶(stearoyl-ACP desaturase),在其 N端包含着71aa转位到叶绿体转运肽。将该基因定位到细胞质表达,酶区域专一性催化Δ7→Δ9增加了 70倍[2]。拟南芥脱饱酶(SAD)家族成员可以在不改变基因编码区序列的情况下,通过不同细胞定位改变酶催化的特异性[3]。马建忠等[4]从波菜叶中克隆了1个SAD同功能基因,其也存在2个大小不同的基因编码框,比Nishida等的波菜 SAD的多11aa,转基因烟草同样明显提高了抗寒性。
本实验室从天山雪莲(S asussured involucrata Kar.et Kir)中克隆了Δ9硬脂酰-ACP脱饱和酶基因,为了有效分析sikSA D基因在细胞中的准确定位,本研究构建其植物表达载体pCMBIA2301-sp-GFP,转化烟草NC89,得到转基因植株,并用激光共聚焦显微镜观察报告基因 GFP在转基因烟草中的表达,以证明sikSA D在植物中定位于叶绿体,以期为进一步研究其生物学功能提供了线索。
1 材料与方法
1.1 材料
1.1.1 菌株,质粒载体及植株
E.coliDH 5α菌株,GV3101菌株,p GM-T质粒,pCMBIA 2301质粒,p7A-GFP质粒以及烟草NC89均为本实验室保存。
1.1.2 工具酶和相关试剂
Taq DNA聚合酶,限制性内切酶Xho I、Nco I、Hind III、EcoR I以及 T4DNA连接酶均为 Fermantas公司产品,DNA片段回收试剂盒为Promaga公司产品。
1.2 方法
1.2.1 PCR引物设计及合成
按照引物设计原则,根据sikSA D信号肽cDNA序列设计1对引物,为了构建植物表达载体,分别加上 X hoI、NcoI酶切位点。引物序列如下:

1.2.2 载体构建及鉴定
利用上述引物以聚合酶链式反应从天山雪莲cDNA文库中获得195 bp大小的前导肽片段。PCR反应条件如下:94℃预变性4 min,(94℃30 s,52℃45 s,72℃30 s)30个循环,72℃终延伸7 min。用1.0%的琼脂糖凝胶电泳检测扩增结果。回收目的片段连接至p GM-T载体,转化后筛选阳性克隆,PCR鉴定后再以Xho I/Nco I双酶切。测序正确后,回收酶切目的片段。同时用相同双酶切pA7-GFP质粒,回收目的大小的片段进行连接,构建pA7-sp-GFP载体。得到阳性克隆后,用PCR及双酶切方法进行鉴定,筛选正确的阳性克隆。然后用 Hind III/EcoR I双酶切,同时切pCMBIA 2301载体,回收目的大小的基因及载体片段后进行连接,即植物表达载体pCMBIA 2301-sp-GFP,用PCR和酶切的方法筛选正确的阳性克隆。用相同的方法构建对照载体pCMBIA 2301-GFP并鉴定。
1.2.3 叶盘法转化烟草及再生
将已构建好的植物表达载体转农杆菌GV3101。取NC89烟草无菌叶片,切成1 cm2左右的小块,放置于用MS液体培养基稀释的农杆菌菌液中浸泡15 min,然后用无菌滤纸吸去多余菌液,于MS固体培养基(不含抗生素)中25℃暗培养2 d;把叶片转入含100 mg/L Kan和50 mg/L Cb分化培养基中,25℃光下培养诱导愈伤组织生芽;将长至1 cm左右的芽转入生根培养基上诱导生根,即获得转基因烟草植株。
1.2.4 用GFP标签检测 sikSAD的亚细胞定位
取非转基因及转基因烟草的叶片,撕取叶表皮,制成水封片,采用型号为LSM 510 META激光共聚焦显微镜,在多线氩离子激光束(25 mW)照射条件下,检测488 nm激发荧光(FITC),观察非转基因烟草叶片和转基因烟草叶片绿色荧光的表达,以确定sikSA D的亚细胞定位。
2 结果
2.1 信号肽亚细胞定位的生物信息学分析
2.1.1 信号肽的序列及疏水性分析
本实验室从天山雪莲(Sasussured involucrata Kar.et Kir)中克隆了Δ9硬脂酰-ACP脱饱和酶基因,命名为 sikSAD,并登录 Genbank,登录号为 No.DQ516384。sikSAD基因全长为1191 bp,编码396个氨基酸,与菊科植物红花(C.tinctorius),向日葵(Helianthus annuus)进化度最高,同源性达96%。
以红花蛋白序列N端有一段32个氨基酸前导肽序列(sbjct1)与雪莲 SA D的前导序列进行比对分析,结果(图1)显示,雪莲 sikSA D基因 N端信号肽序列(Query1)中第6位和第23位氨基酸与红花的不同。预计的前导序列的氨基末端M-L带有2个精氨酸和赖氨酸正电荷残基,随后的Q-F有1个疏水的核心区,最后的丙氨酸是信号肽酶水解的切割位点(图2),完全符合信号肽的结构特征。

图1 sikSAD信号肽的序列分析Fig.1 Sequence analysis of sikSAD's signal peptide

图2 sikSAD信号肽的疏水性分析Fig.2 Hydrophobicity analysis of sikSAD's signal peptide
2.1.2 信号肽亚细胞定位的在线分析
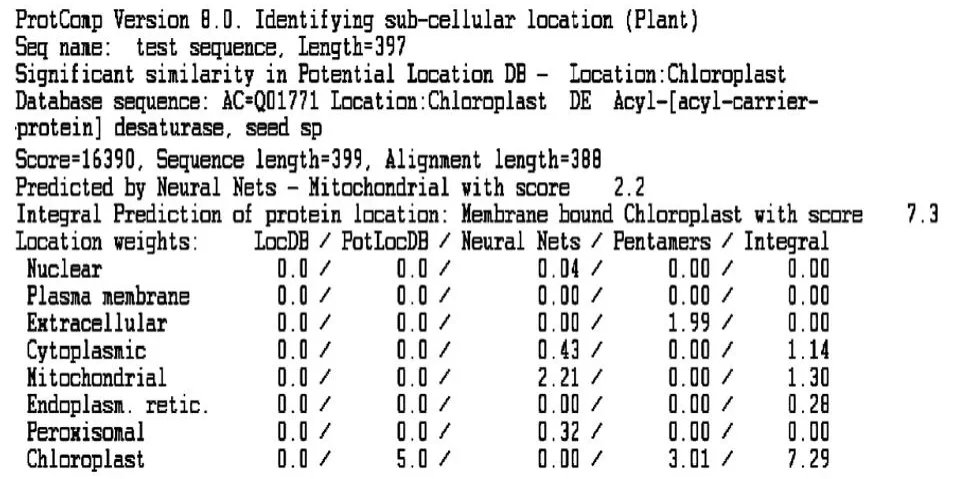
通过不同的导肽分析软件分析了sikSAD基因N端32aa的信号肽序列,发现用不同的导肽在线软件分析得到不同的结论。用 Targetp v1.1分析其倾向于定位在线粒体上(图3),但用 Softberry-Prot-Comp 8.0分析时,又认为其定位在叶绿体上(图4)。

图3 Targetp v1.1分析Fig.3 Analysis of targetp v1.1
targetp v1.1分析显示其倾向于定位在植物细胞的线粒体上。Softberry-ProtComp 8.0分析显示其定位在植物细胞的叶绿体上。

图5 pGM-T-SP重组子PCR检测琼脂糖凝胶电泳Fig.5 PCR detection of the recombinant pGM-T-SP-products
2.2 载体的构建与鉴定
2.2.1 sikSAD基因前导肽片段的扩增及克隆
将sikSA D基因前导肽的 PCR扩增产物与pUCM-T载体连接,转化大肠杆菌,提取质粒,经PCR和酶切鉴定,分别得到1条约195 bp和189 bp的条带(图5、6),测序结果与预期结果一致。这表明目的基因已构建到p GM-T载体上,并成功转入大肠杆菌。

图 6 Nco I、Xho I pGM-T-SP重组质粒Fig.6 Restriction enzyme Nco I and Xho I digestion of the recombinant pGM-T-SP
2.2.2 p7A-sp-GFP的构建
分别用 Xho I、Nco I对 p7A-GFP和 p GM-TS P进行酶切,回收目的条带,连接并转化大肠杆菌。提取重组子质粒p7A-sp-GFP,经 PCR扩增,琼脂糖凝胶电泳,可见195 bp的亮带。再用 Hind III、EcoRⅠ对重组子进行酶切,即得到 35S-sp-GFP,与预期大小一致的片段(图6、7)。

图7 pA-sp-GFP重组子PCR检测琼脂糖凝胶电泳Fig.7 PCR detection of the recombinant pA7-sp-GFP products

图8 HindⅢ、EcoR I酶切pA7-sp-GFP重组质粒Fig.8 Restriction enzyme HindⅢand EcoR I digestion of the recombinant pA7-sp-GFP
2.2.3 pCMBIA 2301-sp-GFP的构建
分别用 Hind III、EcoRⅠ对p7A-S P-GFP和载体pCMBIA 2301进行酶切,回收目的条带,连接并转化大肠杆菌。提取质粒后,经 PCR和 Hind III、EcoRⅠ双酶切,电泳,可见与预期大小一致的条带(图9)。将重组子质粒转化农杆菌,菌液 PCR后,得到195 bp大小的条带(图10)。表明植物表达载体pCMBIA 2301-sp-GFP构建完成,并成功转化大肠杆菌和农杆菌。
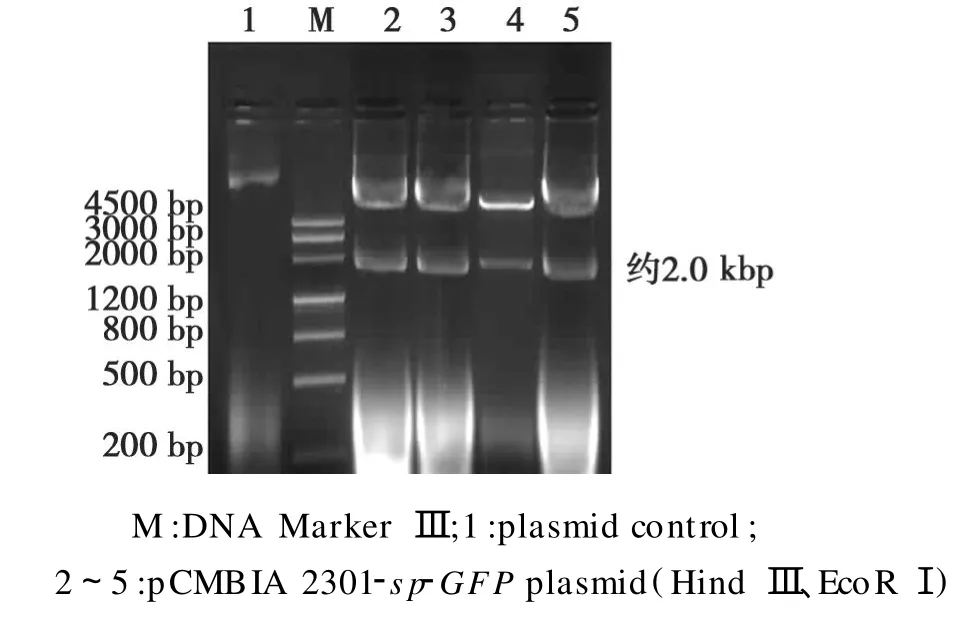
图9 Hind Ⅲ、EcoR I酶切pCMBIA 2301-sp-GFP重组质粒Fig.9 Restriction enzyme HindⅢand EcoR I digestion of the recombinant pCMBIA 2301-sp-GFP

图10 pCMBIA 2301-sp-GFP重组子PCR检测琼脂糖凝胶电泳Fig.10 PCR detection of the recombinant pCMBIA 2301-sp-GFP products
2.3 激光共聚焦检测 GFP在烟草细胞中的定位
非转基因烟草的气孔及其他叶肉细胞在激发光下无荧光发生。转GFP基因烟草的叶肉细胞中有大量荧光表达,气孔周围保卫细胞及表皮细胞基质中有大量荧光激发(图1),而转pCMBIA2301-sp-GFP基因烟草叶表皮中只有有叶绿体存在的气孔两侧保卫细胞及腺毛细胞可见荧光激发。

图11 不同背景下非转基因烟草及转pCMBIA 2301-sp-GFP、pCMBIA2301-GFP基因烟草叶表皮细胞Fig.11 Leaf epidermal cells of transgenic tobaccos and non-transgenic tobaccos
3 讨论
本研究构建了植物表达载体pCMBIA 2301-sp-GFP及pCMBIA 2301-GFP并转到烟草NC89中表达,利用 GFP确定sikSA D在细胞中的亚定位。经激光共聚焦显微镜观察的结果表明,非 GFP转基因烟草细胞在488 nm激发光下不发光,GFP转基因烟草的叶肉细胞中可见大量绿色荧光表达,由于叶肉细胞过分密集且细胞体积较小,不易观察。所以撕取体积较大的叶表皮细胞进一步详细观察。转pCMBIA 2301-GFP基因的烟草在细胞基质中广泛存在着可见荧光。pCMBIA 2301-sp-GFP转基因烟草叶表皮细胞中只有气孔周围和腺毛细胞中可激发明显可见荧光。在植物表皮细胞中,只有保卫细胞和腺毛细胞存在叶绿体。因此,我们认为本实验克隆的前导肽定位于叶绿体中。
利用信号肽来提高外源基因的表达量是目前基因工程操作的一个重要的策略。在抗虫蛋白基因Cpti的5′和3′末端增加了信号肽编码序列和内质网滞留信号 KDEL编码序列,使转基因植物的抗虫性均比未修饰的转基因植物有显著提高[5]。而修饰豌豆储藏蛋白(液泡定位蛋白)基因,可使外源豌豆储藏蛋白在苜蓿植株中积累量提高近百倍[6]。本实验室将拟南芥泛素基因与烟草病程相关蛋白 PR1a基因的信号肽序列体外重组,构建带有泛素和信号肽融合序列的高效植物表达载体,实现外源蛋白在植物体内的有效积累[7]。
在高等植物中,叶肉细胞一般含50~200个叶绿体,可占细胞质的40%,由于叶绿体在植物体中含量丰富,将蛋白定位于叶绿体中表达可以提高外源基因的表达量。将拟南芥rbc S亚基的转运肽序列连接于杀虫蛋白基因之前,发现杀虫蛋白能够特异性地积累在转基因烟草的叶绿体内,外源蛋白总的积累量比对照提高了10~20倍[8]。本实验sik-SA D基因的信号肽构建的通用植物表达载体可以作为植物基因工程的新手段将外源蛋白引导到细胞叶绿体中定位表达。
[1]韦雪芳,王冬梅,刘思,等.信号肽及其在蛋白质表达中的应用[J].生物技术通报,2006(6):38-42.
[2]Heilmann I,Pidkowich M S,Girke T,et al.Switching desaturase enzyme specificity by alternate subcellular targeting[J].Proc Natl Acad Sci,USA,2004,101:10266-10271.
[3]Thompson G A,Scherer D E,Foxall Van Aken S.Primary structures of the precursor and mature forms of stearoyl-acyl carrier protein desaturase from safflower embryos and requirement of ferredoxin for enzyme activity[J].Proc Natl Acad Sci,USA,1991,88(6),2578-2582.
[4]马建忠,刘丹,傅幼英.菠菜硬脂酞基载体蛋白去饱和酶(SAD)基因的分子克隆[J].农业生物技术学报,1996,4(l):33-37.
[5]朱祯,林忠平.走向21世纪的植物分子生物学[M].北京:科学出版社,2000.
[6]Wandelt C I,Khan M R,Craig S,et al.Vicilin with carboxy-terminal KDEL is retained in the endoplasmic reticulum and accumulates to high levels in the leaves of transgenic plants[J].Plant J,1992,2(2):181-192.
[7]史芳芳,周鹏,武冬梅,等.泛素和 PR1a信号肽融合基因植物表达载体的构建[J].石河子大学学报:自然科学版,2006,24(3):265-269.
[8]Wang E Y,Hironaka C M,Fischhoff D A.A rabidopsis thalianasmall subunit leader and transit peptide enhance the expression ofBacillus thuringiensisproteins in transgenic plants[J].Plant Mol Biol,1992,20:81-93.
A Functional Analysis ofsikSAD’s Signal Peptide
CHEN Shangke,SUN Jianfu,WANG Aiying,SHEN Haitao,ZHU Jianbo
(Key Laboratory of Agricultural Biotechnology,College of Life Sciences,Shihezi University,Shihezi 832003,China)
Q785
A
1007-7383(2010)04-0441-05
2009-04-13
国家高技术研究发展计划重点项目(2007AA021401),国家自然科学基金项目(30960034)
陈尚珂(1982-),女,硕士生,专业方向为植物基因工程;e-mail:chloe.k@163.com。
祝建波(1967-),男,副研究员,从事植物基因工程等研究;e-mail:zjbshz@126.com。
