右旋糖酐凝胶微球偶联异烟肼的合成及其体外释放
2010-10-25姚日生尤启冬
姚日生, 尤启冬, 刘 璐, 张 云, 陶 丽
(1.中国药科大学 药学院,江苏 南京 210009;2.合肥工业大学 化学工程学院,安徽 合肥 230009)
0 引 言
异烟肼自1952年开始用于临床以来,至今仍然是治疗各种结核病,尤其是肺结核的首选化学治疗药物之一,其水溶性非常好。但是,异烟肼存在神经系统毒性与严重的肝脏毒性等不良反应,并且半衰期短。为此,在过去的几十年内,人们先后开发了异烟肼与香草醛的缩合物异烟腙(Ftivazid)和与葡萄糖醛酸的缩合物葡烟腙(Glyconiazzid)等小分子药物[1,2]。迄今为止,这类小分子药物的设计与合成筛选研究仍在继续[3,4],但都不具有靶向性。研究表明,粒径为7 μ m左右的微球可在肺部富集靶向[5],而作为肺部靶向药物的高分子载体,通常是亲水性的或水溶性的、无毒的、生物相容性、生物可降解的。右旋糖酐(Dextran)系生物高分子材料,是一种由蔗糖发酵而得的葡萄糖类聚合物,具有水溶性好、安全无毒和生物相容性好等特点,临床上已用作血浆体积扩张剂、外周血流促进剂及抗血栓形成剂等,还用作缓控释药剂的载体或高分子前药载体[6-11]。动物实验表明,无论是生物可降解还是不可降解的右旋糖酐基微凝胶,都可耐受皮下注射的方法将药物安全带到体内[12]。文献[13]利用葡聚糖凝胶(sephadexes)氧化所得醛基葡聚糖凝胶与异烟肼反应形成酰腙键偶联的凝胶基前药,具有良好的缓释作用,并且其在pH=7.4的缓冲溶液中和血液中的释药速率比其在pH=4.0的缓冲溶液中的要慢。但是,葡聚糖凝胶是白色珠状颗粒,其尺度为毫米级,仅适合作口服制剂。
本文采用氧化的右旋糖酐在全水相体系中用环氧氯丙烷交联制备微米级的带有醛基右旋糖酐凝胶微球、微球与异烟肼反应偶联,形成利用凝胶微球粒子偶联的新型缓控释给药系统。
1 实验部分
1.1 药物与主要试剂
异烟肼(药用,浙江新赛科药业有限公司);高碘酸钠、氢氧化钠、环氧氯丙烷、95%乙醇和吐温-80(市购、分析纯);透析袋(MWCO 8 000~12 000,Sigma公司);醛基右旋糖酐(氧化度8.1%和16.4%,参照文献[10]在水溶液用高碘酸钠氧化右旋糖酐制备)。
1.2 仪 器
磁力搅拌器(79HW-1,江苏金城国胜实验仪器厂);高速冷冻离心机Sigma,冷冻干燥机 LGJ-18(宁波新芝生物科技股份有限公司);傅立叶红外光谱Nicolet 5700(美国热电公司);透射电子显微镜 H-800(日本日立公司);紫外可见分光光度计 WFZ800-D3B(上海精密科学仪器有限公司)。
1.3 合成与制备
参照文献[13]合成右旋糖酐微凝胶的方法制备醛基右旋糖酐(PAD)凝胶微球。将一定量醛基右旋糖酐的氢氧化钠(2.8 mol/L)水溶液置于三口烧瓶中,在磁力搅拌下,按0.5 mL/g醛基右旋糖酐加入交联剂环氧氯丙烷,反应24 h,利用旋转蒸发仪浓缩后加入乙醇进行沉淀,高速离心、冷冻干燥后得到醛基右旋糖酐凝胶微球。
精密称取一定量的异烟肼原料药,稀释定容至100 mL的容量瓶中,制备得一定浓度的异烟肼药液,精密量取20 mL药液至50 mL烧杯中,精密称取醛化右旋糖酐基凝胶分别至烧杯中,室温避光反应约12 h。用乙醇醇沉、离心,用蒸馏水水洗3次后,收集上层离心液(备用),下层沉淀冷冻干燥,得固体粉末右旋糖酐凝胶微球偶联异烟肼。
1.4 结构表征
用KBr压片法在Nicolet 5700型傅立叶红外光谱仪上测定葡聚糖交联前后的红外光谱。将冷冻干燥后的样品放在蒸馏水中进行超声波分散,然后将液体样品滴到喷有碳膜的铜网上,用滤纸吸去多余的液体,晾干(晾干时间约数十分钟)即制成样品。在加速电压200 kV透射电镜下观测粒子形貌及大小。右旋糖酐微凝胶偶联异烟肼用去离子水稀释后,用超声波清洗器超声振荡10 min,然后在测量杯中用激光纳米粒度仪测试凝胶粒子的粒度分布,测量温度为25℃。
1.5 载药量与药物释放量的测定
1.5.1 标准曲线绘制
按照《中华人民共和国药典》2005版的规定,采用紫外分光光度计测量263 nm处药物的吸光度,得标准曲线方程为:

1.5.2 载药量测定
因异烟肼与醛基右旋糖酐成腙后,共轭结构发生较大改变,不宜采用通过直接测产物中药物含量的方法测载药量,此处选用间接法测载药量。
将游离的药物收集,通过 Φ 45 μ m 的微孔滤膜过滤,精密吸取到容量瓶中,用蒸馏水稀释,于263 nm测吸光度A,代入异烟肼标准曲线可换算出游离的异烟肼质量,计算公式为:
载药量=(投入的异烟肼总质量-游离的异烟肼质量)/偶联物总质量×100%。
1.5.3 累积释药率的测定
取载药微凝胶100 mg,溶于2 mL与释放介质相同的水溶液中,吸取1 mL溶液装入透析袋内,将口密封后置于盛有50 mL释放介质的锥形瓶中。于(37.0±0.5)℃,120 r/min的恒温摇床内振摇。定时取适量释放介质,于263 nm波长下测吸光度,同时补充等量新鲜介质。所用释放介质分别为 0.9%NaCl生理盐水、pH值为7.4的磷酸盐缓冲溶液和pH值为4.5的柠檬酸盐缓冲溶液。根据异烟肼标准曲线,计算释放介质中异烟肼的质量分数,并由此计算出异烟肼的累积释药率,绘制累积释药率-时间关系曲线。
2 结果与讨论
2.1 红外光谱分析
原料药物、载体和偶联药物的红外光谱如图1所示。图1表明,氧化的右旋糖酐以及与环氧氯丙烷反应交联形成的凝胶仍保持着1 731 cm-1的C=O振动吸收峰不变,即所得凝胶保持有原PAD的醛基。PAD凝胶与异烟肼反应后所得产物的FTIR谱与异烟肼的FTIR谱相比,1 635 cm-1处的异烟肼的伯胺基特征峰消失,在1 555 cm-1(m)出现了明显的吡啶环(C=C)骨架特征峰以及在845 cm-1(s)出现的吡啶环上的-CH吸收峰,并且在1 669 cm-1处峰形明显变宽且强度增大,意味着有酰腙键形成。可见所合成的最终产物是右旋糖酐凝胶偶联异烟肼。
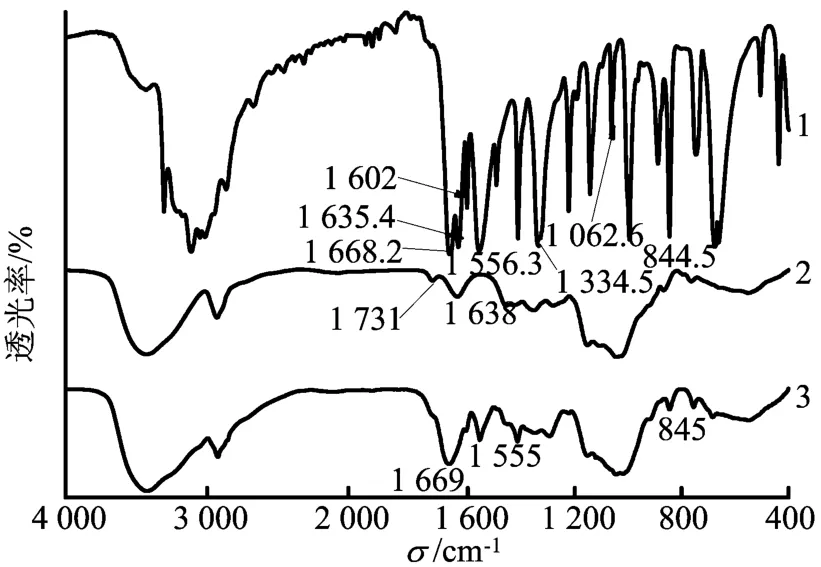
图1 原料药物、载体与偶联药物的FTIR图谱
2.2 T EM分析
氧化16.4%的醛化右旋糖酐、其与环氧氯丙烷反应交联形成的凝胶微球以及该微球偶联异烟肼在水中分散结构的TEM照片如图2所示。
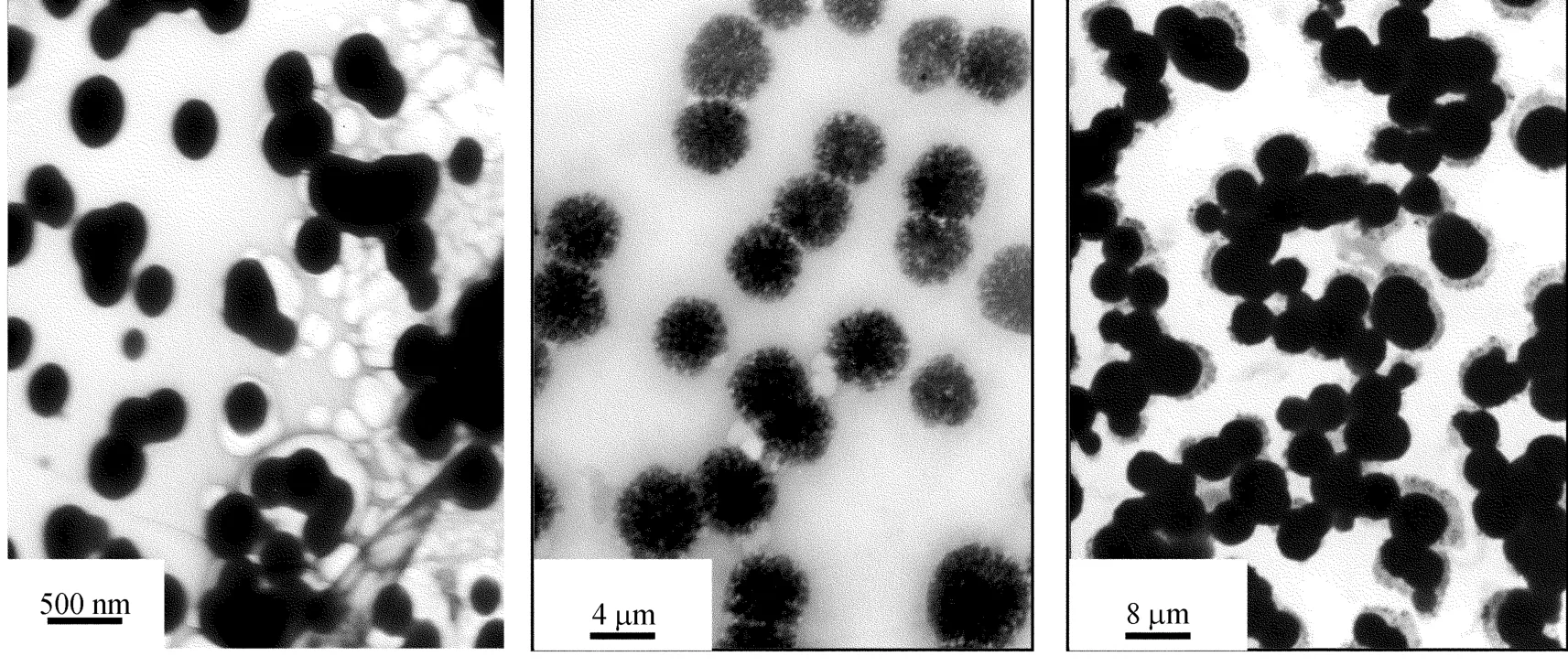
图2 微粒的T EM照片
由图2a可见,氧化16.4%的醛化右旋糖酐可在水溶液中自组装成质地均匀、外观较圆整的粒径为200~300 nm纳米微凝胶粒。由图2b可见,PAD凝胶纳米粒与环氧氯丙烷交联形成的是粒径为4~6 μ m凝胶微球,这种结构存放28 d后依然保持基本不变,稳定性好。同时微球内部是多核的,因此环氧氯丙烷与PAD微凝胶的醇羟基进行的交联反应可在PAD凝胶粒子的内外同时进行,外部的交联反应将迫使邻近的颗粒聚集在一起而形成由多个纳米凝胶微粒堆积的凝胶微球。
另外,比较图2b和图2c可以看出,凝胶微球有一定的膨胀,结构致密、外观更加圆整,且粒径大小主要集中在4~10 μ m。这意味着凝胶微球的亲水性或其与水分子的结合能力增加了,它是因异烟肼的引入使得醛基右旋糖酐的结晶度下降所致,同时,在凝胶微球的外表面有致密度小的包覆层,而这是原凝胶微球表面所没有的。因此,该包覆层只可能是水溶性极佳的异烟肼在化学键合后因仍具有良好的亲水性而向凝胶的表面运动并富集所致。这种结构将有助于微球偶联药物达到病灶部位的母药释放。
2.3 粒径分析
用环氧氯丙烷交联的醛基右旋糖酐(氧化度16.4%)微球及其偶联异烟肼后的粒径大小分布如图3所示,从图3可以看出,环氧氯丙烷交联的醛基右旋糖酐(氧化度16.4%)微球的粒径为500 nm~6.51 μ m。其中,约 60%的粒径大于2.5 μ m;其偶联异烟肼后粒径增大至 1.8~12.3 μ m,分布宽度增大,其中约50%的粒径大于6.5 μ m,且粒度集中在 6 ~ 10 μ m,基本符合肺部靶向的要求。
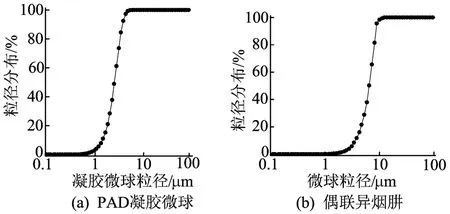
图3 PAD凝胶微球及其偶联异烟肼的粒径分布
2.4 右旋糖酐偶联异烟肼的体外释放
不同载体负载异烟肼的体外释放曲线如图4所示,图4中释放介质为0.9%NaCl水溶液。
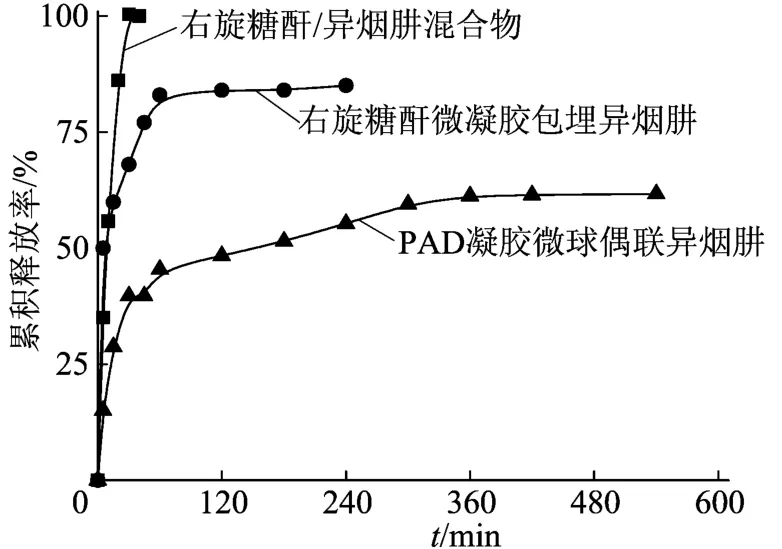
图4 不同载体负载异烟肼的体外释放曲线
从图4可以看出,在同样的释放条件下,药物直接与右旋糖酐混合,40 min累积释放率达到100%;其次右旋糖酐基微凝胶为载体时,药物包埋于凝胶的网格里,药物随着时间慢慢地释放出来,40 min累积释放率约70%,呈现爆释行为;60 min累积释放达83%后几乎不变;出现爆释是异烟肼水溶性极好的必然结果,60 min后释放量非常小是由于部分异烟肼被包埋于凝胶深处后扩散受阻所致。相比之下,氧化度为8.1%的醛化右旋糖酐微凝胶作为载体偶联异烟肼(偶联载药量1.98%),其在 40 min累积释放率约 40%、60 min累积释放率约为45%,而到300 min累积释放率仍不足60%,而后增幅极小,释药时间显著延长,表现出良好的缓释作用。也就是说,通过腙键偶联的异烟肼释放行为和释放速率既不同于与右旋糖酐混合的,也不同于与右旋糖酐微凝胶混合的。并且,醛化右旋糖酐微凝胶负载异烟肼的释放曲线呈阶梯结构,基本符合一级释放动力学模型。这意味着水解产生游离的异烟肼在向生理盐水中扩散释放的同时有一定量的储存,且微凝胶对小分子药物异烟肼扩散有较大的阻力。这种存储量可能是水解释放出的异烟肼与醛化右旋糖酐微凝胶中大量未反应的醛基再反应偶联造成的。
氧化度为16.4%的醛化右旋糖酐凝胶微球偶联异烟肼的体外释放曲线如图5所示,由图5可见,该偶联药物是pH值敏感型的。其在模拟血液环境中24 h后几乎呈线性释放,到第5天其累积释放率达到63.3%;在pH=4.5的酸性体系中的释放比生理盐水中的要快得多,在24 h的累积释放率就高达80%,然后进入缓慢释放状态,外推到第5天的累积释放率达95%左右。该凝胶微球腙键偶联药物具有酸环境敏感性,其中生理盐水中的释放远小于酸性体系,故其具有结核部位的靶向释药能力。而药物的释放过程也出现与图3相似的平台现象,这是由于水解释放出的异烟肼在扩散途中被醛化右旋糖酐微凝胶中先前没有反应的醛基捕获而进行二次成腙反应产生的。

图5 PAD凝胶微球偶联异烟肼体外释放曲线
将图5中的数据分别进行拟合,得到异烟肼在pH=7.4和pH=4.5的介质中的释放动力学模型分别为:
在pH=7.4,R2=0.993时,
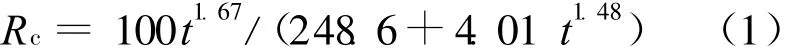
在pH=4.5,R2=0.984时,
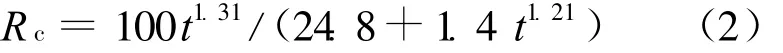
由(1)式、(2)式可见,它们同样可以用 Rc=Atn1/(B+Ctn2)方程描述,在pH=7.4和pH=4.5时的n1均大于1,但前者比后者的高,表明两者均受水解控制,前者受水解释药过程的控制更大。或者说,在pH=7.4的介质中药物从凝胶链上断裂的速度比pH=4.5的慢,即腙键在酸性环境中的水解速率高一些,动力学模型表达的信息与上述分析是一致的。同时,异烟肼在水中的高度水溶性使其在凝胶中沉积的几率非常小,因而药物释放几乎不受扩散控制。
3 结 论
(1)环氧氯丙烷与纳米凝胶化的多醛基右旋糖酐中的羟基反应交联形成微米级凝胶微球,该微球具有多核结构,其约 60%的粒径大于2.5 μ m。16.7%的醛化右旋糖酐凝胶微球偶联异烟肼最终产物在水溶液中能够稳定分散,其粒径大于6.5 μ m前药微球占 50%以上,可实现肺部被动靶向。
(2)在水溶液中成功地进行了醛基右旋糖酐凝胶微球偶联异烟肼的反应合成,其缓释效果明显优于异烟肼与右旋糖酐的混合物和右旋糖酐微凝胶微球吸附负载异烟肼,氧化度为16.7%的醛化右旋糖酐凝胶微球偶联异烟肼具有pH值敏感性。
[1] 尤启冬.药物化学[M].北京:化学工业出版社,2003:35-38.
[2] 徐文芳.药物化学[M].北京:高等教育出版社,2006:235-236.
[3] Bedia K K,Elcin O,Seda U,et al.Synthesis and characterization of novel hydrazide-hydrazones and the study of their structure-antituberculosis activity[J].Eur J Med Chem,2006,41(11):1253-1261.
[4] Rollas S,Gulerman N,Erdeniz H.Sy nthesis and antimicrobial activity of some new hydrazones of 4-fluorobenzoic acid hydrazide and 3-acetyl-2,5-disubstituted-1,3,4-oxadiazolines[J].Il Farmaco,2002,57(2):171-174.
[5] 孙小龙.异烟肼肺靶向性微球的制备及其小鼠体内分布[J].中国医院药学杂志,1999,19(9):515-516.
[6] Brondsted H,Andersen C,Hovgaard L.Crosslinked dextrana new capsule material for colon targeting of drug s[J].J Control Release,1998,53(1/3):7-13.
[7] Cheung R Y,Ying Y,Rauth A M,et al.Biodegradable dextran-based microspheres for delivery of anticancer drug mitomycin C [J]. Biomaterials, 2005, 26(26):5375-5385.
[8] Stenekes R J H,Loebis A E,Fernandes C M,et al.Degradable dextran microspheres fo r the controlled release of liposomes[J].International Journal of Pharmaceutics,2001,214(1/2):17-20.
[9] Basan H,Gǜmǜsderelioglu M,Tevfik O M.Release characteristics of salmon calcitonin from dextran hydrogels for colon-specific delivery[J].Eur J Pharm Biopharm,2007,65(1):39-46.
[10] Bonneaux F,Dellacherie E.Fixation of various aldehydic dextrans onto human hemoglobin:study of conjugate stability[J].J Protein Chem,1995,14(1):1-5.
[11] M uang siri W,Kirsch L E.The protein-binding and drug release properties of macromolecular conjugates containing daptomycin and dextran[J].International Journal of Pharmaceutics,2006,315(1/2):30-43.
[12] 周 琪,徐玉福,何红波,等.多糖类微凝胶的制备及其在缓控释给药系统中的应用[J].合肥工业大学学报:自然科学版,2009,32(2):193-197.
[13] Gumargalieva K Z,Shipunova O V,Zaikov G E,et al.Biodegradation of polymer compounds based on cross-linked dextrans[J].Polymer Degradation and Stability,1996,51:57-65
