玉米须黄酮类化合物构效及合成基因调控研究进展
2010-10-19刘静波王作昭王二雷王翠娜
刘 军,刘静波*,王作昭,王二雷,王翠娜
(吉林大学军需科技学院营养与功能食品研究室,吉林 长春 130062)
玉米须黄酮类化合物构效及合成基因调控研究进展
刘 军,刘静波*,王作昭,王二雷,王翠娜
(吉林大学军需科技学院营养与功能食品研究室,吉林 长春 130062)
玉米须为我国传统的中草药,含有多种活性成分,具有很多重要的生理活性。本文重点对玉米须中所含的黄酮类化合物的分离纯化、结构鉴定、相关的生物活性以及在植物体内合成的基因调控的研究现状进行了总结。
玉米须;黄酮类化合物;纯化;结构;生物活性;基因调控
Abstract:Corn silk, a kind of traditional Chinese drug, contains bioactive components that play important roles in the regulation of many physiological functions. In this paper, current research including purification, structure identification, biological activity and gene regulation of flavonoids in corn silk was comprehensively summarized. These investigations will provide theoretical references for future research and development of corn silk.
Key words:corn silk;flavonoids;purification;structure;biological activity;gene regulation
玉米须(corn silk, corn stigma, stigma maydis or maize silk),异名为玉麦须(《滇南本草》)、玉蜀黍蕊(《现代实用中药》)、棒子毛(《河北药材》),为我国民间传统的中草药,是禾本科玉蜀黍作物玉米(Zea maysL.)的干燥的花柱和柱头[1]。具有性平、味甘淡、无毒等特性,其中含有多种有效成分并且具有降血糖、抗癌、抑菌、增强免疫功能、利尿、降血压等功效[2]。作为重要天然产物之一的黄酮类化合物,在绝大多数的植物体内都有存在,其在植物的生长、发育、开花、结果以及抗菌防病等方面起着重要作用。玉米须中黄酮类化合物含量相当可观,有报道称玉米须中黄酮类化合物含量占玉米须干质量的3%[3],而对于玉米须中黄酮类化合物的组成成分的分离纯化结构鉴定以及相应的生物活性研究已成为国内外相关领域的研究热点。
本文重点对玉米须中黄酮类化合物的分离纯化,结构鉴定、相关的生物活性以及在植物体内合成的基因调控的研究现状进行综述,为进一步开发玉米须产品以及玉米须相关的深层次开发利用提供参考。
1 玉米须中黄酮类化合物分离纯化及其结构鉴定
玉米须中黄酮类化合物含量丰富,且组成复杂,一直以来,科研人员致力于从玉米须原料中分离得到纯度较高的黄酮类化合物单体成分,以解析其结构并研究相应的生理活性及其构效关系。他们在玉米须黄酮的分离纯化及结构鉴定方面做了大量的工作并取得了丰硕的成果。
关于玉米须黄酮类化合物的最早的研究见于Waiss等[4]、Elliger等[5]和Snook等[6-7]的相关报道,从“Zapolote Chieo(ZC)”品种的玉米的玉米须中分离得到6种黄酮类化合物:Maysin[2''-O-a-L-rhamnosyl-6-C-(6-deoxy-xylo-hexos-4-ulosyl)luteolin]、Apimaysin、3'-Methoxymaysin、equatorial-4''-OH-maysin(eq-4''-OH-maysin)、axial-4''-OH-maysin(ax-4''-OH-maysin)以及ax-4''-OH-3'-Methoxymaysin,具体结构式见图1。研究结果表明,所发现的黄酮类化合物对于玉米棉铃虫幼虫具有很好的抗性。
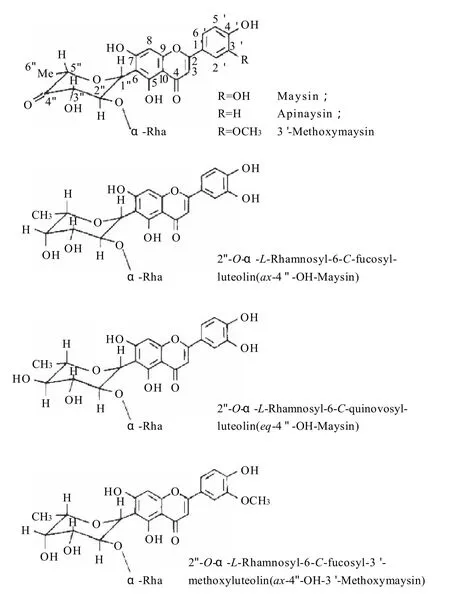
图1 Maysin及其衍生物结构图Fig.1 Structures of maysin and its analog
由于提取方法以及其他一些实验条件的限制,以及品种间可能存在玉米须化学成分的差异,对于玉米须中黄酮类化合物的研究工作并未停止。Suzuki等[8]通过层析分离的方法从玉米须的甲醇提取液中分离得到一种新的C-苷黄酮:chrysoeriol 6-C-β-boivinopyranosyl-7-O-β-glucopyranoside,其结构见图2。

图2 6-C-β-吡喃鼠李糖基-甲氧基木犀草素-7-O-β-吡喃葡萄糖苷结构图Fig.2 Structure of chrysoeriol 6-C-β-boivinopyranosyl-7-O-βglucopyranoside
国内也有关于玉米须黄酮类化合物的研究报道,例如任顺成等[9-10]在玉米须黄酮类化合物的分离纯化上做了大量的工作,通过溶剂法提取玉米须中醇溶性成分,柱层析法得到黄酮类化合物,光谱法(MS、1H-NMR、13CNMR、DEPT-NMR和HMQC-NMR)鉴定结构,先后从玉米须中得到4种黄酮类化合物的详细结构,分别是2''-O-α-L-鼠李糖基-6-C-(6-脱氧-ax-5'-甲基-木-己-4-碳基)-3'-甲氧基木犀草素、2''-O-α-L-鼠李糖基-6-C-岩藻糖基-3'-甲氧基木犀草素、7,4'-二羟基-3'-甲氧基黄酮-2''-O-α-L-鼠李糖基-6-C-岩藻糖苷以及6,4'-二羟基-3',5'-二甲氧基黄酮-7-O-葡萄糖苷,结构见图3。

图3 2''-O-α-L-鼠李糖基 -6-C-(6-脱氧 -ax-5'-甲基 -木 -己 -4-碳基)-3'-甲氧基木犀草素(A)、2''-O-α-L-鼠李糖基-6-C-岩藻糖基 -3'-甲氧基木犀草素(B)、7,4'-二羟基-3'-甲氧基黄酮-2''-O-α-L-鼠李糖基-6-C-岩藻糖苷(C)以及6,4'-二羟基-3',5'-二甲氧基黄酮-7-O-葡萄糖苷(D)结构Fig.3 Structures of 2''-O-α-L-rhamnosy-6-C-(6-deoxy-ax-5'-methylxylo-hexa-4- ulosyl)-3'-chrysoeriol, 2''-O-α-L-rhamnosy-6-C-fucosy-3'-chrysoeriol, 7,4'-dihydroxy-3'-methoxyflavone-2''-O-α-L-rhamnosy-6-C-fucosy and 6,4'-dihydroxy-3',5'-dimethoxyflavone-7-O-glucoside
张慧恩等[11]对玉米须中黄酮化合物的组成进行了研究。实验通过大孔树脂、聚酰胺、ODS以及Sphadex LH-20等层析色谱法从玉米须水提物中分离得到3种黄酮物质,经鉴定分别为芒柄花素、2"-O-alpha-L-rhamnosyl-6-C-(3-deoxyglucosyl)-3'-methoxyluteolin(2"-O-α-L-鼠李糖基-6-C-(3-脱氧葡萄糖基)-3'-甲氧基木犀草素),2"-O-alpha-L-rhamnosyl-6-C-(6-deoxy-ax-5-methyl-xylo-hexos-4-ulosyl)-3'-methoxyluteolin(2"-O-α-L-鼠李糖基-6-C-(6-脱氧-ax-5-甲基-木-己-4-羰基)-3′-甲氧基木犀草素)。其中芒柄花素以及2"-O-α-L-鼠李糖基-6-C-(3-脱氧葡萄糖基)-3′-甲氧基木犀草素为首次从玉米须中分离得到,其结构见图4。

图4 芒柄花素(A)及2"-O-α-L-鼠李糖基-6-C-(3-脱氧葡萄糖基)-3'-甲氧基木犀草素(B)结构图Fig.4 Structures of formononetin (7-hydroxy-4'-methoxyisoflavone)and 2"-O-alpha-L-rhamnosyl-6-C-(3-deoxyglucosyl)-3'-methoxyluteolin
Xu等[12]从玉米须中又分离得到了一种新的黄酮类化合物:6-乙酰基-木犀草素(6-acetyl-luteolin),其结构如图5所示。

图5 6-乙酰基-木犀草素结构图Fig.5 Structure of 6-acetyl-luteolin
Cao等[13]运用制备型高速逆流色谱法(HSCCC)对玉米须中黄酮类成分异鼠李黄素(isorhamnetin)进行了分离纯化,通过两步纯化,分别采用两相溶剂系统的体积比为正己烷-乙酸乙酯-甲醇-水5:5:5:5和5:5:6:4,得到的异鼠李黄素的纯度分别为65.6%和98%。最终可从700mg的玉米须粗提物中得到11.8mg纯度为98%的异鼠李黄素。异鼠李黄素结构由MS、1H-NMR和13C-NMR进行鉴定。这为从玉米须原料中工业化提取生产高纯度的异鼠李黄素提供了依据。米须中存在一种叫做异荭草素的化学物质,其对于玉米棉铃虫的幼虫也具有一定的抗性,结构见图6[14]。
综上所述,从玉米须中分离纯化得到的黄酮类化合物绝大多数都有相同的母核结构:木犀草素,少数也有以甲氧基黄酮、二甲氧基黄酮以及甲氧基异黄酮为母核结构的。从玉米须中分离纯化得到的黄酮类化合物绝大多数为黄酮苷类,这为玉米须黄酮的有效提取提供了参考。国内外对于玉米须黄酮类化合物的分离纯化以及结构鉴定都有足够的重视,并取得了一定的成果。相对而言,国外对于此项研究开展的比较早,取得的成果也较多。考虑到玉米种属之间的差异以及种植的环境的影响,不同玉米品种,不同生长环境条件下,玉米须中所含有的黄酮类化合物的含量及组成可能有所不同,因此,对于玉米须黄酮类化合物组成的深入研究显得十分有必要。我国是玉米种植大国,因此,结合我国玉米种植的地理环境及气候条件特点等对玉米须黄酮类化合物的进一步深入研究十分有必要。鉴于玉米须的价格低廉,来源广泛等特点,从玉米须原料中工业化生产具有一定药理作用的活性成分是非常具有现实意义的。

图6 异荭草素结构图Fig.6 Structure of isoorientin
2 玉米须黄酮的药理作用活性
2.1 抗虫及抑菌活性
对于玉米须黄酮类化合物的相关研究起源于玉米须所表现出的很强抗虫活性及抑菌活性。大量的研究表明,玉米须中存在多种具有抗虫活性及抑菌活性的物质,其中主要是黄酮类化合物以及绿原酸[15]。玉米对于玉米棉铃虫幼虫侵害的抵抗能力与玉米须中Maysin的含量呈正相关[16-18],而玉米须中黄酮类化合物的组成不同,其抗玉米棉铃虫幼虫的能力也有所不同,研究发现,抗性最强的及抗性中等的玉米品种中所含的主要黄酮类化合物为Apimaysin,而最易感品种玉米的玉米须中所含的黄酮成分为3'-Methoxymaysin,此黄酮成分在抗性较好的玉米品种的玉米须中并没有发现[19]。此外,玉米须中含有的黄酮类化合物异荭草素,其对于玉米棉铃虫的幼虫也具有一定的抗性[14]。此外玉米须中所含有的长链烷烃类成分也具有一定的抗菌能力,尤其对于玉米禾谷镰刀菌的抗性具有一定的剂量效应[20]。玉米须水提取物对于经由食物传播的细菌性病原体的抑制作用要强于玉米须的乙醇提取物,尤其是对于鼠伤寒沙门氏菌(Salmonella typhimuriumKCTC 2515)的生长抑制作用。其最小抑菌质量浓度达到7.5mg/mL。但是温度对于玉米须水提取物以及乙醇提取物的抑菌活性的影响较大,20℃条件下各玉米须提取物均表现出很强的抑菌活性,而当温度达到4℃时,各玉米须提取物几乎没有抑菌活性存在[21]。
2.2 抗氧化活性
人体氧化应激所产生的自由基被认为与人类几乎每种慢性退行性疾病有关,如癌症、老年痴呆症、糖尿病、关节炎以及多发性硬化症等疾病。抗氧化物能够有效地清除人体多余的自由基,玉米须中同样存在具有抗氧化活性的抗氧化物,对人体健康具有十分重要的意义。研究发现,玉米须甲醇提取物中一些亲脂性成分,包括酚酸和一些黄酮苷类物质等,对于由Fe2+-抗坏血酸体系所诱导的脂质过氧化体系的具有明显的抑制作用,是玉米须甲醇提取物抗氧化活性的主要活性成分[22]通过不同方法对玉米须乙醇提取物的抗氧化活性的研究发现,玉米须提取物质量浓度在1.6mg/mL时即可清除92.6%的DPPH自由基,并且提取物以及BHA及槲皮素标准品的IC50值分别为0.59、0.053、0.025mg/mL。进一步对提取物的成分进行分析发现,玉米须乙醇提取物中酚类及黄酮类化合物的含量相当的可观,说明酚类及黄酮类化合物是玉米须乙醇提取物抗氧化活性的主要活性成分[23-24]。而对玉米须的石油醚、乙醇、水以及二氯甲烷提取物进行比较研究发现,这些提取物在50~400μg/mL范围内对DPPH自由基和亚麻酸所组成的评估系统都具有明显的抗氧化活性。其中玉米须的乙醇提取物在400μg/mL时对DPPH自由基活性抑制率达到84%。并且这些提取物的抗氧化活性稳定,即使经过β-胡萝卜漂白后仍然具有良好的抗氧化活性[25]。
可见,玉米须具有非常高的抗氧化活性,以玉米须为原料生产新的天然抗氧化剂具有非常广阔的开发及应用前景。此外,研究还表明,玉米须的乙醇提取物还具有非常强的还原能力,通过硫氰酸铁法得知,玉米须的乙醇提取物能够抑制88%的亚麻酸的脂质过氧化作用[23]。由以上可推断,传统医学中玉米须的某些药理学性质与其抗氧化活性有很大的关联性。但对于玉米须抗氧化活性的研究大都停留在体外实验阶段,对于玉米须在体内发挥抗氧化作用的机制还不是十分的明确,因此,玉米须体内抗氧化作用的机制还有待进一步的阐明。
2.3 玉米须黄酮的其他生理活性
玉米须除上述两种显著的生理活性以外,可能还具有其他一些生理活性,如抑制肿瘤细胞生长活性、降血压活性、降血脂活性、抑制血小板聚集作用,对心血管系统以及肝脏的保护作用,抗炎等多种药理作用。现阶段对于玉米须药理作用活性大多停留在玉米须的粗提物的水平上,玉米须粗提物所呈现的各种生理及药理活性都无法对其活性成分进行明确的归属,因此,对于玉米须黄酮类化合物的活性研究必将引起越来越多的科研人员的重视,为进一步的明确玉米须的功效明确提供理论依据。
3 玉米须黄酮生物合成的基因调控
鉴于玉米须中黄酮类化合物的重要生物活性,因此,有目的的提高玉米须中黄酮类化合物含量是十分必要的。对于通过基因手段调控玉米须中黄酮类化合物的含量及组成已有一定的成果。
玉米须中抗玉米棉铃虫幼虫的有效成分主要是C-苷黄酮类化合物及绿原酸,而从玉米须中分离纯化得到的C-苷黄酮类化合物最为普遍的就是Maysin、Apimaysin以及3'-Methoxymaysin,而这些C-苷黄酮类化合物在结构上区别主要是它们在B环上的取代基有所不同,并且Apimaysin的抗性最强,而玉米须中含有3'-Methoxymaysin的植株的抗性最差[19]。另有研究表明,玉米须对玉米棉铃虫幼虫的抗性作用与玉米须中Maysin的含量呈正相关[16-18]。为了得到抗玉米棉铃虫幼虫性能更强的玉米品种,以降低玉米受病虫害的危险程度,科研工作者开始思考是否玉米基因表达与玉米须中黄酮类化合物的生物合成之间存在某种联系,能否通过基因手段定向调节玉米须中黄酮类化合物的生物合成的量并优化黄酮类化合物的组成。一系列研究表明,玉米须中黄酮类化合物的结构组成与其B环修饰的基因有关[15]。研究证实,在玉米须黄酮类化合物性状的表达各不同的路径中,调节基因数量性状位点(QTL)处于中心地位,起主导作用,并且两者之间存在着非常复杂的相互作用,最终导致了玉米须黄酮类化合物合成[26]。而玉米花器组织中红色黄酮类物质的合成受玉米p1基因编码的R2R3-MYB转录因子的调控,通过遗传及数量性状位点分析,分析结果与p1基因调控Maysin的合成相吻合[27]。另外,研究人员通过对两个不同品种玉米((Tx501 x NC7A)F-2 和(Tx501 x Mp708)F-2)的QTL进行了比较发现,对于绿原酸、Maysin及3'-Methoxymaysin,控制其合成的主要的数量性状遗传位点位于4号染色体的umc1963附近。而对于Apimaysin,控制其合成的数量遗传位点则位于5号染色体的pr1位点上。4号染色体上的数量性状遗传位点的等位基因能够显著增加3'-Methoxymaysin的合成量,但却对Maysin及绿原酸的合成具有抑制作用,Maysin的减少量比3'-Methoxymaysin的4倍还要多。实验结果同时表明,4号染色体上的QTL对于3'-Methoxymaysin的合成具有促进作用,并且改变了苯丙胺醇及黄酮类化合物的动力学合成路径[15]。而玉米中调节Maysin含量的具体基因位置为P位点、c2以及whp 1位点,P位点调节whp 1的转录以增加Maysin的含量的机制主要是通过提高査耳酮合酶活性以促进黄酮合成路径的通量,以提高玉米须中Maysin的生物合成量。另有研究表明,玉米须中p1等位基因对于Maysin及AM-maysin(Apimaysin and Methoxymaysin)生物合成的调控作用显著,而a1基因也具有相同的作用,从而使得具有此基因的玉米品种具有更强的抗虫性能[28]。研究人员通过向不含或含Maysin量很小的玉米品种中转移p1基因能够达到提高Maysin的浓度至抑制玉米棉铃虫存活的所需浓度[27]。目前,Halbwrith等[29]已经通过基因调控的手段成功的在玉米须中合成了3-花青素以及罕见的3-脱氧花青素。而玉米须中花青素的组成最终与黄碱酮3-羟化酶(flavanone 3-hydroxylase)的活性有关。
4 结 语
综上所述,玉米须中的黄酮类化合物含量丰富,黄酮类化合物的组成多样,并且各黄酮类化合物的组成成分的活性大小都有差异,因此,通过基因手段有目的的调控玉米须中黄酮类化合物的含量,优化玉米须中黄酮类化合物的组成,培育具有更强的抗虫活性的玉米须品种,开发玉米须黄酮类化合物的相关产品以及玉米须的综合开发利用以及减少玉米种植过程中农药等的使用,开发绿色环保玉米产品具有深远的意义。此外,对于玉米须黄酮的研究还有很大空间,例如对于种属之间存在差异的玉米须的黄酮组成的研究,玉米须黄酮类化合物的药理作用活性以及其构效关系,玉米须中黄酮类化合物的变化与外部种植环境以及植株的生长发育时期的关系等方面,这些都需要进一步的研究并明确,以用于更好地指导农业生产,开发高附加值农产品,促进生态农业的发展。
[1] 中华人民共和国卫生部药材标准委员会. 中华人民共和国卫生部药材标准:一部[M]. 1985版. 北京:人民卫生出版社, 1986:12.
[2] 江苏新药学新编. 中药大辞典:上册[M]. 北京:人民卫生出版社, 1980:555.
[3] 任顺成, 丁霄霖. 不同品种玉米须黄酮类含量研究[J]. 玉米科学,2007, 15(6):135-137; 139.
[4] WAISS A C, CHAN B G, ELLIGER C A Jr, et al. Maysin, a flavones glycoside from corn silks with antibiotic activity toward corn earworm[J]. J Econ Entomol, 1979, 72:256-258.
[5] ELLIGER C A, CHAN B G, WAKA A C, et al.C-Glycosyl flavones fromZea maysthat inhibit insect development [J]. Phytochemistry,1980, 19:293-297.
[6] SNOOK M E, WIDSTROM N W, GUELDNER R. A reversed phase high performance liquid chromatographic procedure for the determination of maysin in corn silk[J]. J Chromatogr, 1989, 47:439-447.
[7] SNOOK M E, WIDSTROM N W, WISEMAN B R, et al. New C-4-hydroxy derivatives of maysin and 3'-metalhoxymaysin isolated from corn silks (Zea mays)[J]. Agric Food Chem, 1995, 43:2740-2745.
[8] SUZUKI R, OKADA, Y OKUYAMA T. Two flavoneC-glycosides from the style ofZea mayswith glycation inhibitory activity[J]. J Nat Prod, 2003, 66:564-565.
[9] 任顺成, 丁霄霖. 玉米须黄酮类成分的提取分离与结构鉴定(I) [J].中草药, 2004, 35(8):857-858.
[10] 任顺成, 丁霄霖. 玉米须黄酮类成分的提取分离与结构鉴定(II)[J]. 河南工业大学学报:自然科学版, 2007, 28(4):34-36.
[11] 张慧恩, 徐德平. 玉米须黄酮类成分的研究[J]. 中草药, 2007, 30(2):164-166.
[12] XU Yan, LIANG Jingyu, ZOU Zhongmei, et al. A novel flavone and two urea glycosides from the style ofZea maysL.[J]. Acta Chimica Sinica,2008, 66(10):1235-1238.
[13] CAO Xiaoying, WEI Yun, ITO Y. Preparative isolation of isorhamnetin fromMaydis stigmausing high speed countercurrent chromatography[J].Journal of Liquid Chromatography and Related Technologies, 2009, 32(2):273-280.
[14] WIDSTROM N W, SNOOK M E. A gene controlling biosynthesis of isoorientin, a compound in corn silks antibiotic to the corn earworm[J].Entomologia Experimentalis Et Applicata, 1998, 89(2):119-124.
[15] CORTES-CRUZ M, SNOOK M, MCMMULLEN M D. The genetic basis ofC-glycosyl flavone B-ring modification in maize (Zea maysL.)silks[J]. Genome, 2003, 46(2):182-194.
[16] GUO B Z, WIDSTROM N W, WISEMAN B R, et al. Comparison of silk maysin, antibiosis to corn earworm larvae (Lepidoptera:Noctuidae),and silk browning in crosses of dent x sweet corn[J]. Journal of Economic Entomology, 1999, 92(3):746-753.
[17] BUTRON A, WIDSTROM N W, SNOOK M E, et al. Recurrent selection for corn earworm resistance in three corn synthetics[J]. Maydica,2000, 45(2):295-300.
[18] NI X Z, DA K D, BUNTIN D, et al. Physiological basis of fall armyworm(Lepidoptera:Noctuidae) resitance in seedlings of maize inbred lines with warying levels of silk maysin[J]. Florida Entomologist, 2008, 91(4):537-545.
[19] GUEVARA P, PEREZ-AMADOR M C, ZUNIGA B, et al. Flavones in corn silks and resistance to insect attacks[J]. Phyton-International Journal of Experimental Botany, 2000, 69:151-156.
[20] MILLER S S, REID L M, BUTLER G, et al. Long chain alkanes in silk extracts of maize genotypes with varying resistance toFusarium graminearum[J]. Journal of Agricultural and Food Chemistry, 2003, 51(23):6702-6708.
[21] AN E S, KANG S H, CHUNG H J. Inhibitory effect of corn silk extract on growth of food-borne bacterial pathogens [J]. Food Science and Biotechnology, 2006, 15(1):138-142.
[22] MAKSIMOVIC Z A, KOVACEVIC N. Preliminary assay on the antioxidative activity ofMaydis stigmaextracts[J]. Fitoterapia, 2003, 74(1/2):144-147.
[23] EBRAHIMZADEH M A, POURMORAD F, HAFEZI S. Antioxidant activities of Iranian corn silk[J]. Turkish Journal of Biology, 2008, 32(1):43-49.
[24] MAKSIMOVIC Z, MALENCIC D, KOVACEVIC N. Polyphenol contents and antioxidant activity ofMaydis stigmaextracts[J]. Bioresource Technology, 2005, 96(8):873-877.
[25] EL-GHORAB A, EL-MASSRY K F, SHIBAMOTO T. Chemical composition of the volatile extract and antioxidant activities of the volatile and nonvolatile extracts of Egyptian corn silk (Zea maysL.)[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22):9124-9127.
[26] BYRNE P F, MCMULLEN M D, SNOOK M E, et al. Quantitative trait loci and metabolic pathways:genetic control of the concentration of maysin, a corn earworm resistance factor, in maize silks[J]. Proc Natl Acad Sci USA, 1996, 93(17):8820-8825.
[27] COCCIOLONE S M, NETTLETON D, SNOOK M E, et al. Transformation of maize with thep1transcription factor directs production of silk maysin, a corn earworm resistance factor, in concordance with a hierarchy of floral organ pigmentation[J]. Plant Biotechnology Journal, 2005, 3(2):225-235.
[28] GUO B Z, ZHANG Z J, BUTRON, A, et al. LostP1allele insh2sweet corn:Quantitative effects ofp1anda1genes on concentrations of maysin,apimaysin, methoxymaysin, and chlorogenic acid in maize silk[J]. Journal of Economic Entomology, 2004, 97(6):2117-2126.
[29] HALBWRITH H, MARTENS S, WIENAND U, et al. Biochemical formation of anthocyanins in silk tissue ofZea mays[J]. Plant Science,2003, 164:489-495.
Research Progress in Structure, Activity and Synthetic Gene Regulation of Flavonoids in Corn Silk
LIU Jun,LIU Jing-bo*,WANG Zuo-zhao,WANG Er-lei,WANG Cui-na
(Laboratory of Nutrition and Functional Food, College of Quartermaster Technology, Jilin University, Changchun 130062, China)
R282.71
A
1002-6630(2010)13-0316-05
2009-10-18
吉林省科技发展计划项目
刘军(1986—),男,硕士研究生,主要从事营养与功能性食品研究。E-mail:liujun86421@yahoo.com.cn
*通信作者:刘静波(1962—),女,教授,博士,主要从事营养与功能食品研究。E-mail:ljb168@sohu.com
