食品中桃仁和杏仁过敏原成分的检测
2010-10-19张海英高旗利张宏伟郑文杰
张 霞,张海英,高旗利,刘 培,张宏伟,郑文杰
(天津出入境检验检疫局,天津 300461)
食品中桃仁和杏仁过敏原成分的检测
张 霞,张海英,高旗利,刘 培,张宏伟,郑文杰
(天津出入境检验检疫局,天津 300461)
目的:建立检测食品中桃仁、杏仁过敏原成分的荧光PCR方法,比较国外3种ELISA试剂盒效果。方法:针对杏仁Pru du1基因设计引物及探针,建立荧光PCR方法。利用杏仁过敏原参考物质对3个品牌的ELISA试剂盒的回收率进行比较。结果:建立的荧光PCR方法,具有很好的特异性;灵敏度为10mg/kg。结论:桃仁及杏仁过敏原成分荧光PCR检测方法特异性好、灵敏度高,对食品中过敏原的检测有重要的实际意义。
杏仁;Pru du1基因;荧光定量PCR
Abstract:Objectives:To establish a real-time PCR method for the detection of allergenic almond and peach seeds in food and compare with quantitative test kits for allergenic almond. Methods:On the basis of sequence analysis of thePru du1region, specific primers and probes were designed to develop a real-time PCR method using TaqMan probe for the identification of allergenic almond or peach seed residues in food. In order to compare with the test kits, recovery rates and detection limit of established real-time PCR were determined using the reference material of allergenic almond. Results:The established real-time PCR method was highly specific for the detection of allergenic almond. Its sensitivity was less than 10 mg/kg. Conclusion:The real-time PCR method is highly sensitive and specific, thereby providing an applicable method for the detection of allergenic almond and peach seeds in food.
Key words:almond;allergenicPru du1gene;fluorescence quantitative polymerase chain reaction
随着食品工业的发展,食品过敏问题日益成为人们关注的焦点问题[1]。树坚果是世界各国公认的引起人类食物过敏的8大主要过敏原之一。据美国FDA资料统计,在美国所有过敏反应中,花生和树坚果引起的过敏占10%~47%。据美国统计,人们对坚果(包括杏仁、核桃等)、凤梨和花生这几类变应原大约影响1.1%美国的总人口[2],其中对花生过敏的最多,占总数的30%;而对杏仁过敏的患者亦占总数的10%以上。对于过敏患者,杏仁作为一种生食和加工兼用的食物,在日常生活中很难避免,因此会随时威胁这一类人群的健康[3]。
蔷薇科中的许多种如苹果、梨、桃、李、杏等是著名的水果,扁桃仁及杏仁为干果。扁桃仁(Prunus dulcis)通常称之为美国大杏仁,其属于蔷薇科、李亚科、桃属、扁桃种[4],引起过敏主要有4类蛋白质:与致病相关的10种蛋白、类奇(异果)甜蛋白、脂质转移蛋白及抑制蛋白。扁桃仁过敏蛋白基因标识为Prudu1至Pru du4[5]。
目前国外对过敏原成分的检测研究主要集中在ELISA、PCR、荧光PCR检测等方面[6-8]。FDA和美国官方分析化学家协会(AOAC)共同研究推荐使用的试剂盒均为ELISA方法。该方法可对食品中引起过敏的蛋白进行定量,但如果产品中蛋白质遭到破坏,ELISA方法就检测不到。相对而言,DNA比蛋白质稳定,PCR方法较ELISA方法更为准确,并且避免了对大量抗体的需求[9]。由于两种检测方法各有利弊,本研究除建立荧光PCR检测方法外,对3个品牌的杏仁过敏原ELISA试剂盒从原理、制样及检测各方面进行比较。
1 材料与方法
1.1 材料与试剂
CTAB(每升含CTAB 20g、EDTA 7.4g、Tris 12.1g,用10g/100mL HCl溶液调pH值至8.0,将溶液高压灭菌备用);氯仿、异戊醇、Tris饱和酚、异丙醇、70%乙醇、TE 德国IFP公司;过敏原参考物质(2、5、10、20、40mg/kg杏仁的黑巧克力)。所用试剂均为分析纯级生化试剂。
TaqMan Universal PCR Master Mix 试剂盒 美国ABI公司;蛋白酶K(20mg/mL) 大连宝生物工程公司;3种品牌杏仁过敏原ELISA检测试剂盒分别购自澳大利亚ELISA Systems公司、德国R-biopharm公司和美国Neogen公司。
1.2 仪器与设备
ABI PRISM 7000荧光PCR扩增仪 美国ABI公司;5417R离心机 Eppendorf公司;Bio Specmini DNA/RNA/蛋白分析仪 日本岛津公司;uQuant酶标分析仪 瑞士Tecan公司;INE800电热恒温培养箱 德国Memmert公司。
1.3 方法
1.3.1 DNA的提取
取200mg美国大杏仁研磨成粉状,于1.5mL离心管中,加入600μL CTAB,15μL蛋白酶K,65℃温育30min;加入500μL Tris饱和酚:氯仿:异戊醇(体积比25:24:1)混合液强烈振荡,12000r/min离心15min;吸取上清液加入等体积异丙醇,强烈振荡后12000r/min离心10min,弃上清液;用70%乙醇洗涤2~3次,吸弃,用200mL TE溶解(TE量视DNA沉淀多少而定)。用DNA/RNA/蛋白分析仪检测其纯度。
同法提取甜杏仁、苦杏仁、桃仁、李子、杨梅、苹果、梨等果仁D N A。
1.3.2 荧光PCR检测方法建立
1.3.2.1 引物及探针的设计
针对Pru du1基因(EU424249.1)设计一对引物,以美国大杏仁、桃仁、甜杏仁、苦杏仁、苹果、李子、杨梅DNA为模板作PCR扩增及测序分析,设计区别于苹果、李子、杨梅等其他蔷薇科常见水果的特异性引物及TaqMan探针(已申请专利200910068848.7)。引物:Up:5'-TTTGGTTGAAGGAGATGCTC-3';Dn:5'-TAGTTGCTGGTGCTCTTTATG-3';探针:5'(FAM)-TCCATCAGCAGATGCCACCAAC-(Eclipse) 3'。
1.3.2.2 反应体系和反应条件
反应体系:TaqMan Universal PCR Master Mix 25μL,10μmol/L引物各2μL,10μmol/L TaqMan探针1.5μL,模板DNA 5μL,ddH2O 14.5μL。
反应条件:50℃保持2min,95℃预变性10min,95℃变性15s,60℃退火40s,45个循环。
1.3.2.3 特异性实验
特异性实验分3组样品进行,第1组针对食物中常见基质成分如麦粉、大豆、粟米等;第2组针对同科属的常食用水果如苹果、梨、李子、杨梅、桃、杏等果仁;第3组针对常食用坚果类食品如核桃、栗子、松子、葵花仁、榛果、夏威夷果等,观察有无交叉反应。
1.3.2.4 灵敏度实验
分别取美国大杏仁、甜杏仁、苦杏仁做样品添加实验。将其切成小块加入液氮研磨成糊状,与面粉充分混匀得到1000、100、20、10、5mg/kg的混合物。
同样以购得德国IFP公司的过敏原参考物质(含2、5、10、20、40mg/kg杏仁的黑巧克力)做灵敏度实验。
1.3.3 ELISA检测试剂盒比较
分别从检测样品种类、样品处理方法及时间、检测时间、定量检测范围、标准品浓度及准确度方面对3种品牌的ELISA试剂盒进行比较。以回收率作为准确度评价指标。
取参考物质作为实验样品,每种实验样品包括4个浓度水平。由2个实验员操作。每个实验员在酶标仪上完成的检测内容为:每个样品取3份按照ELISA检测方法进行样品前处理及检测。
2 结果与分析
2.1 DNA提取结果
采用CTAB法提取美国大杏仁、甜杏仁、苦杏仁、桃仁的DNA,DNA/RNA/蛋白分析仪检测其纯度,OD260nm/OD280nm值在1.46~1.83之间,DNA质量浓度为90.8~183.3μg/mL,其余作特异性实验的阴性样品(苹果、梨、李子、杨梅、麦粉、大豆、粟米、核桃、栗子、松子、葵花仁、榛果、夏威夷果)DNA质量经植物18S核糖体RNA基因通用引物PCR检测其DNA质量均符合后续实验要求,结果见图1。

图1 18S核糖体RNA PCR电泳图Fig.1 Electrophoresis of 18S ribosomal RNA gene after polymerase chain reaction
2.2 特异性实验
经过3组特异性实验结果显示,对于食品中常见基质如麦粉、粟米粉、大豆粉;不同属的坚果类食品如核桃、栗子、松子、葵花仁、榛果、夏威夷果等具有很好的特异性,结果全部为阴性。对于同科的水果苹果、梨、李子、杨梅等检测为阴性。通过桃仁、甜杏仁、苦杏仁及美国大杏仁的Pru du/pu1基因测序结果显示,具有高度同源性,建立的荧光PCR方法检测均为阳性,结果见图2。
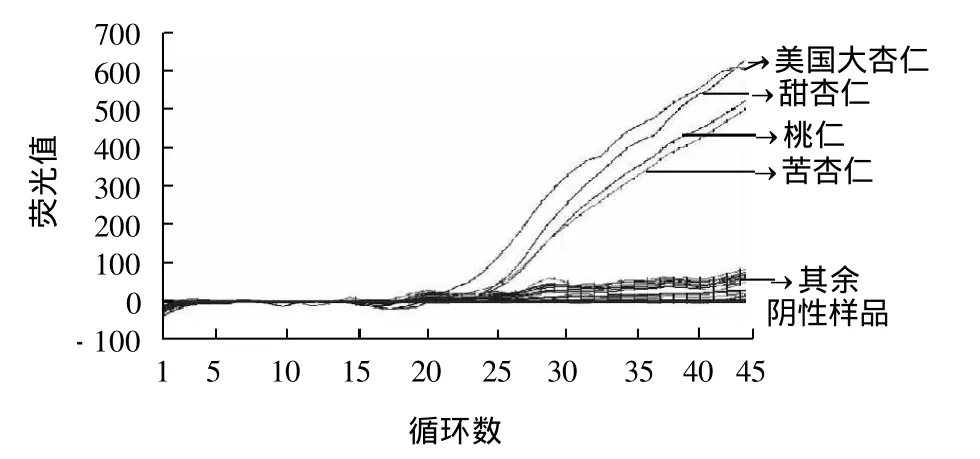
图2 杏仁过敏原荧光PCR特异性实验Fig.2 Specificity of fluorescent PCR for the detection of allergenic almond
2.3 灵敏度实验
美国大杏仁、甜杏仁、苦杏仁作添加实验,添加量分别为1000、100、20、10、5mg/kg,应用荧光PCR方法均可检测至5mg/kg,但循环数出现在42~43之间,荧光值偏低(图3),不好做出阳性判断。应用IFP参考物质做灵敏度检测,5次重复结果两次检出5mg/kg添加量的参考物质为阳性,结果不稳定;对于10mg/kg参考物质可稳定检出,没有漏检现象。该方法虽然最低可检测到5mg/kg,但结果不稳定,而且由于其荧光值偏低,具体检测样品时较难做出阴、阳性判断,所以确定本方法的灵敏度为10mg/kg。

图3 杏仁过敏原荧光PCR灵敏度实验Fig.3 Sensitivity of fluorescent PCR for the detection of allergenic almond
2.4 ELISA检测试剂盒比较
2.4.1 3种杏仁ELISA检测结果
对于分别添加3种杏仁的样品,3种品牌ELISA检测试剂盒检测均为阳性,回收率在80%~120%之间,说明国外公司的杏仁过敏原试剂盒并非只是针对美国大杏仁的特异性检测试剂盒。

表1 ELISA试剂盒参数比较Table 1 Comparison between fluorescent PCR and ELISA kits
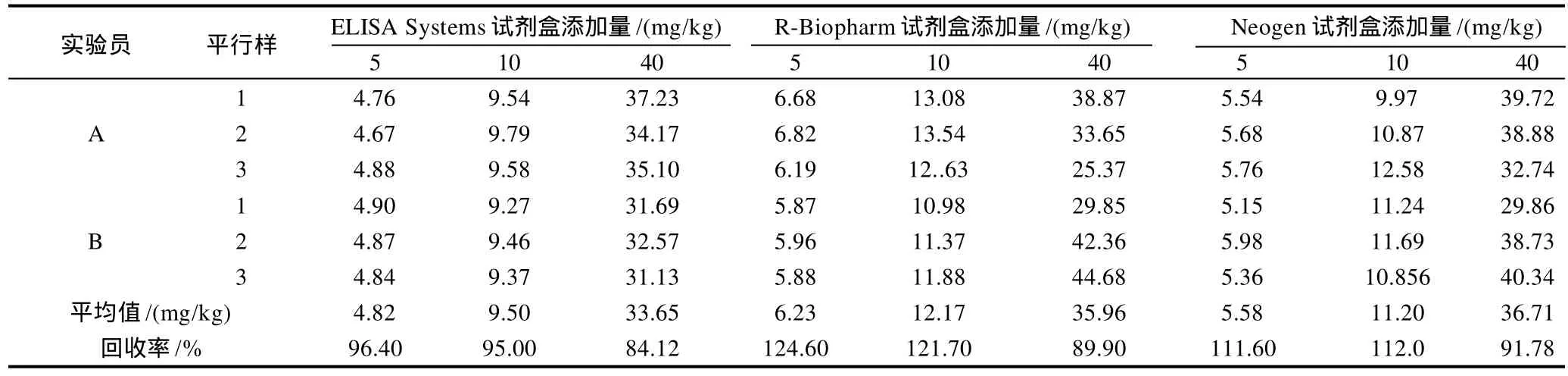
表2 ELISA试剂盒准确度验证数据Table 2 Verification for accuracy of ELISA kits
2.4.2 3种品牌试剂盒技术参数对比
在针对杏仁过敏原蛋白检测方面,三者从样品提取、处理及检测时间都大致相同。ELISA Systems试剂盒检测样品种类较其余二者较广,定量检测范围大致相同,具体对比参数见表1。
2.5 3种试剂盒ELISA准确度实验结果
根据两个实验员,每个水平样品各取IFP参考物质3份按照ELISA试剂盒检测方法进行样品前处理及检测,并计算检测平均值及回收率,结果见表2。
由表2可见,ELISA Systems试剂盒的回收率总体的回收率偏高在89%~130%之间。
3 结论与讨论
本研究通过Pru du1基因建立的荧光PCR检测方法在实验中表明,不但可以检测出美国大杏仁过敏原成分,同时可以检测桃仁、甜杏仁及苦杏仁。桃(Prunus persica)与扁桃同属于桃属,也为4类主要过敏蛋白,其基因标识为Pru pu1至Pru pu4,二者具有高度同源性,达到96%~99%,无法区分。虽然杏(Prunus armeniaca)在分类学中属蔷薇科、李亚科、杏属,其仁分为甜杏仁及苦杏仁,但是通过对其Pru du1基因PCR扩增测序分析,与桃仁及美国大杏仁同源性为100%。故建立可同时检测桃仁、杏仁过敏原成分的荧光PCR方法。
3种ELISA试剂盒经用IFP购买的参考物质比对实验表明,操作方便快捷,区别在回收率及定量检出范围及结果报告方面,ELISA Systems公司试剂盒的回收率总体偏低在84%~96%之间,其余两公司回收率偏高,在89%~130%之间。ELISA Systems可定量检出过敏原杏仁蛋白含量,定量范围0.5~5.0mg/kg,同时可换算为杏仁含量,定量范围为2.4~24.0mg/kg,结果既可出具过敏原蛋白含量,又可报告过敏物质含量;其余两个试剂盒均是直接给出杏仁物质含量,无法得出杏仁蛋白含量。
目前国内外对杏仁过敏原的检测研究主要集中在ELISA、PCR、荧光PCR及生物传感器检测等方面[10-13],荧光PCR法与ELISA法是最常用的过敏原检测方法。ELISA是一种传统的检测过敏原的方法,它具备直接的优点,这也是其普遍使用ELISA方法进行检测的最根本原因。过敏原本身就是蛋白质,检测蛋白质存在与否最能够说明该产品是否会引起人过敏。除此之外,ELISA方法还有一个优点就是灵敏度比较高。荧光PCR方法是5~10mg/kg,即5mg/kg,而ELISA方法可达0.1mg/kg[14],就目前而言ELISA方法灵敏度更高。但近年来,随着生产加工工艺不断复杂化,产品中添加了各种复杂的成分,如添加剂和色素等,ELISA的缺点也就暴露出来:第一,对于加工过的产品由于其蛋白质成分遭到破坏,ELISA方法将不能检测得出来而PCR方法不受影响,因此ELISA方法的准确性遭到质疑;第二,ELISA方法检测的通常是其中的一种蛋白质,然而不同的人可能对不同的蛋白质过敏,因此ELISA方法进行检测也将不准确,可能有漏检出现,这也是PCR方法的优势。所以应该分析情况,结合使用两种方法。
[1] SICHERER S H, MUNOZ-FURLONG A, MURPHY R, et al.Symposium:Pediatric food allergy[J]. Pediatrics, 2003, 111(6):1591-1594.
[2] POLTRONIERI P, CAPPELLO M S, DOHMAE N, et al. Identification and characterization of the IgE-binding protein 2S albumin and congultin in almond (Prunus dulcis) seeds[J]. Int Arch Allergy Immunol, 2002,128(2):97-104.
[3] 李东栋, 何韶衡. 食入性过敏原:杏仁蛋白组分的双向电泳分析[J].细胞与分子免疫学杂志, 2004, 20(4):473-477.
[4] LADIZINSKY G. On the origin of almond[J]. Genetic Resources and Crop Evolution, 1999, 46:413-147.
[5] CHEN Lin, ZHANG Shuiming, ILLA E, et al. Genomic characterization of putative allergen genes in peach/almond and their synteny with apple[J]. BMC Genomics, 2008, 9:543-578.
[6] POMS R E, KLEIN C L, ANKLAM E. Methods for allergen analysis in food:a review[J]. Food Additives and Contaminants, 2004, 21(1):1-31.
[7] HOLZHAUSER T, WANGORSCH A, VIETHS S, et al. Polymerase chainreaction (PCR) for detection of potentially allergenic hazelnutresidues in complex food matrixes[J]. European Food Research and Technology,2000, 211(5):360-365.
[8] POMS R E, ANKLAM E, KUHN M. Polymerase chain reaction techniques for food allergen detection[J]. Journal of AOAC International,2004, 87(6):1391-1397.
[9] TORP A M, OLESEN A, STEN E. Specific, semi-quantitative detection of the soybean allergen Gly m Bd 30K DNA by PCR[J]. Food Control,2006, 17(5):30-36.
[10] ACOSTA M R, ROUX K H, TEUBER S S, et al. Production and characterization of rabbit polyclonal antibodies to almond (Prunus dulcisL.) major storage protein[J]. J Agric Food Chem, 1999, 47(10):4053-4059.
[11] BARGMAN T J, RUPNOW J H, TAYLOR S J. IgE-binding protein in almonds (Prunus amygdalus):identification by immunoblotting with sera from almond allergic adults[J]. J Food Sci, 1992, 57(3):717-720.
[12] HLYWKA J J, HEFLE S L, TAYLOR S L. A sandwich enzyme-linked immunosorbent assay for the detection of almonds in foods[J]. J Food Prot, 2000, 63(2):252-257.
[13] LISA C, CHRIS R T, LIGLER S. Applications of array biosensor for detection of food allergens[J]. Journal of AOAC International, 2004, 87(6):1498-1502.
[14] HOLZHAUSER T, VIETHS S. Quantitative sandwich ELISA for determination of traces of hazelnut (Corylus avellana) protein in complex food matrixes[J]. J Agric Food Chem, 1999, 47(10):4209-4218.
Allergen Detection of Almond and Peach Seeds in Food
ZHANG Xia,ZHANG Hai-ying,GAO Qi-li,LIU Pei,ZHONG Hong-wei,ZHENG Wen-jie
(Tianjin Entry-Exit Inspection and Quarantine Bureau, Tianjin 300461, China)
Q789
A
1002-6630(2010)18-0220-04
2009-11-18
国家公益性行业科研专项(10-46-1)
张霞(1975—),女,工程师,硕士,研究方向为微生物检测。E-mail:zhangxia_75@126.com
