黄秋葵多糖组分对人体肿瘤细胞增殖的抑制作用
2010-10-19任丹丹
任丹丹,陈 谷*
(华南理工大学轻工与食品学院,广东 广州 510640)
黄秋葵多糖组分对人体肿瘤细胞增殖的抑制作用
任丹丹,陈 谷*
(华南理工大学轻工与食品学院,广东 广州 510640)
近年来多糖的抗肿瘤生物活性日益受到关注,本研究探讨黄秋葵多糖对人体卵巢癌细胞(OVCAR-3)、乳腺癌细胞(MCF-7)、宫颈癌细胞(Hela)、胃腺癌细胞(MCG-803)增殖的抑制作用。通过水提醇沉提取黄秋葵粗多糖(raw polysaccharide,RPS),经DEAE-纤维素阴离子交换层析柱分离得到3种多糖洗脱组分E1、E2和E3;不同质量浓度黄秋葵多糖作用于人体肿瘤细胞72h,采用MTT法对其抗癌活性进行分析。结果显示:RPS和E1组分可抑制OVCAR-3细胞的生长,随质量浓度的增加细胞存活率降低,呈剂量依赖关系,最低可分别降至72.30%和52.31%;E3组分可抑制MCF-7、Hela和MCG-803细胞的生长,抑制作用呈剂量依赖关系,细胞的存活率最低可分别降至63.90%、63.51%和67.71%。故而黄秋葵多糖组分可抑制多种肿瘤细胞生长,有开发成抗癌功能食品的前景。
黄秋葵;多糖;MT T;抗癌生物活性;功能食品
Abstract:The anticancer bioactivity of polysaccharide has gained more and more attention in recent years. Herein, the inhibitory effect of polysaccharides extracted from okra,Abelmoschus esculentus(L.) Moench, was investigated on different human cancer cell lines, OVCAR-3, MCF-7, Hela and MCG-803 cells. Raw polysaccharide (RPS) was extracted from fresh okra fruit by ethanol precipitation and further purified by DEAE anion exchange chromatography to obtain fractions E1, E2 and E3. These cancer cells were treated with different concentrations of okra polysaccharides for 72 h and their proliferation were analyzed by MTT assay. RPS and E1 had a significant inhibition effect on the proliferation of OVCAR-3 cells in a dose-dependent manner, and the lowest survival rates were 72.30% and 52.31%, respectively. E3 had an obvious inhibition effect on MCF-7, Hela and MCG-803 cells with the lowest survival rates of 63.90%, 63.51% and 67.71%, respectively. Therefore, these investigations are significance of exploring and developing okra as functional foods.
Key words:okra;polysaccharide;MTT assay;anticancer bioactivity;functional food
在中国中医学自古就有“药食同源”理论,食物与药物同样能够防治疾病,且副作用小,这也是食物疗法的基础。据称世界范围内30%~40%的癌症可通过健康饮食得到预防[1],在日常生活中多吃新鲜的水果和蔬菜在癌症预防方面起着重要的作用。多糖作为天然生物大分子物质,具有多种多样的生物活性,如调节免疫系统,提高机体免疫力,并在抗肿瘤方面发挥生物活性作用[2]。研究发现,云芝多糖[3]、香菇多糖[4-5]、灵芝多糖[6-7]、茶多糖[8]、苹果多糖[9]等均能够以某种形式抑制肿瘤细胞的生长。
黄秋葵[Abelmoschus esculentus(L.) Moench]又名补肾草、秋葵和羊角豆等,为锦葵科秋葵属一年生草本植物。可供食用的嫩果部分充满黏液,营养成分丰富,富含蛋白质、不饱和脂肪酸、维生素、多糖、黄酮类化合物等,是一种营养保健蔬菜[10],还可作为脂肪代替物制作低脂巧克力[11]。经常食用可增强人体体质,具有很高的开发价值和潜力。除此之外,实验证明黄秋葵的嫩果具有抗疲劳[12-13]、治疗皮肤癌[14]等功能。
卵巢癌、乳腺癌、宫颈癌和胃腺癌均为发病率高、严重危害人类健康的恶性肿瘤。目前,顺铂(cisplatin)和5-氟尿嘧啶(5-fluorouracil)等是临床上预防和治疗肿瘤的有效药物,但因其毒副作用大而限制着这些药物的长期使用,因此开发研制新的抗肿瘤活性物质日益引起科研工作者的广泛关注。本研究通过提取分离黄秋葵中的多糖,发现所得多糖组分对4种人体肿瘤细胞生长有抑制作用,为研制新的抗癌活性物质和进一步开发利用黄秋葵提供实验依据。
1 材料与方法
1.1 材料与试剂
人体卵巢癌细胞OVCAR-3、乳腺癌细胞MCF-7、宫颈癌细胞Hela和胃腺癌细胞MCG-803均从中山大学动物实验中心购得。黄秋葵购于广州蔬菜批发市场。
DMEM(低糖)培养基、新生胎牛血清 美国Gibco公司;噻唑兰(MTT) Sigma公司;青-链霉素、0.25g/100mL胰蛋白酶、二甲基亚砜(DMSO) 北京普博欣生物科技有限公司;DEAE-纤维素 上海楷洋生物技术有限公司;无水乙醇、磷酸二氢钠、磷酸氢二钠、氢氧化钠、苯酚(重蒸)、浓硫酸、氯化钠等均为国产分析纯试剂。
1.2 仪器与设备
洁净工作台 上海博讯实业有限公司医疗设备厂;XDS-1R倒置显微镜 意大利Optika公司;CO2培养箱、冷冻干燥机 美国Thermo Electron公司;低速台式离心机 上海安亭科学仪器厂;Sunrise酶标仪 奥地利Tecan公司;全自动高压灭菌锅 英国Astell公司;EYELA真空旋转蒸发器 上海爱朗仪器有限公司;台式高速离心机 美国贝克曼公司;冷冻离心机 德国Eppendorf公司;HL-2B恒流泵、SBS-100数控计滴自动部份收集器 上海沪西分析仪器厂有限公司;UV-2300紫外-可见分光光度计 上海天美科学仪器有限公司。
1.3 方法
1.3.1 细胞培养
细胞培养在含10%新生牛血清的DMEM完全培养基(含100U/mL青霉素和100μg/mL链霉素)中,于37℃、5% CO2,饱和湿度的培养箱内培养,用0.25g/100mL胰蛋白酶消化传代,取对数生长期细胞用于实验。
1.3.2 黄秋葵多糖的分离纯化
黄秋葵粗多糖(RPS)的提取[15],采用水提醇沉法:取新鲜黄秋葵嫩果,蒸馏水清洗干净,捣碎加蒸馏水浸泡过夜,离心去除沉淀。上清液中加无水乙醇(乙醇的终体积分数为45%),静置过夜,离心取醇沉淀,真空抽滤去除残留的乙醇。加少量蒸馏水至提取物完全复溶,用分子截留量为6kD的透析袋于蒸馏水透析72h,真空浓缩,冷冻干燥,得黄秋葵粗多糖。
DEAE-纤维素经碱酸碱预处理,用蒸馏水洗至中性。抽真空脱气,装入层析柱(3.0cm×18cm),蒸馏水平衡过夜。黄秋葵粗多糖的分离[16]:称取黄秋葵粗多糖,完全溶于去离子水中,过DEAE-纤维素层析柱,分别用去离子水、0.25mol/L PBS(pH6.0)、0.5mol/L PBS(pH6.0)、0.5mol/LNaOH溶液洗脱,收集洗脱液10mL/管。用苯酚-硫酸法快速检测出含糖管,得洗脱曲线。收集同一洗脱峰的各含糖管,洗脱液经过透析,真空浓缩,冷冻干燥,得黄秋葵多糖各洗脱组分,分别为E1、E2和 E3,-20℃密封保存备用。
1.3.3 细胞增殖抑制实验
经黄秋葵多糖的分离纯化得到4种黄秋葵多糖组分:RPS、E1、E2和E3。采用4种人体肿瘤细胞(OVCAR-3、MCF-7、Hela和MCG-803)的增殖抑制模型MTT法[17],研究4种黄秋葵多糖对人体癌细胞的生长抑制作用,筛选有效组分。选取对数生长期的细胞,用0.25g/100mL胰蛋白酶消化调整细胞悬液浓度,以4×103个/孔接种于96孔板中,每孔补足完全培养基至200μL。另设不加细胞只加培养基的空白调零组。待细胞贴壁后,吸除旧培养液,加入不同质量浓度黄秋葵多糖干预,质量浓度分别为50、100、200、400、800μg/mL,每孔加药量200μL,每个质量浓度设置6个复孔。同时设一对照组,即加等量培养液(多糖质量浓度0μg/mL)。于加药72h后,每孔加入MTT(5mg/mL)溶液20μL,37℃继续孵育4h。完全弃除孔内上清液,每孔加入DMSO 200μL,振荡10min,使结晶物充分溶解。酶标仪检测492nm波长处的吸光度(A492nm)。按照下式计算细胞存活率。

2 结果与分析
2.1 黄秋葵多糖对人卵巢癌OVCAR-3细胞增殖的抑制作用
不同质量浓度黄秋葵RPS组分作用于OVCAR-3细胞72h后的A492nm及存活率如表1所示。2、3组与1组的吸光度相比,无显著性差异;4、5、6组与1组的吸光度相比,有显著性差异(P<0.05)。实验结果显示:RPS组分低质量浓度时对OVCAR-3细胞生长无影响。当质量浓度升高至200μg/mL时,开始显著地抑制细胞生长;当质量浓度达到800μg/mL时,存活率最低可降至72.30%,且抑制作用呈剂量依赖关系。

表1 不同质量浓度黄秋葵粗多糖对人卵巢癌OVCAR-3细胞生长的抑制作用Table 1 Effects of different concentrations of RPS on proliferation of OVCAR-3 cells
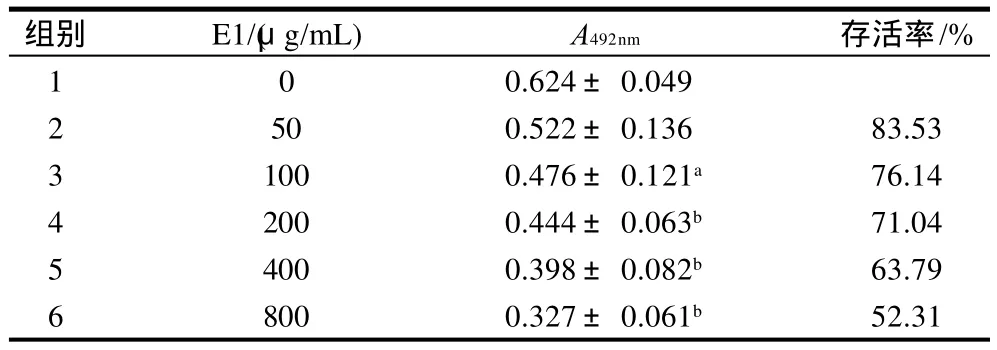
表2 不同质量浓度E1对人卵巢癌OVCAR-3细胞生长的抑制作用Table 2 Effects of different concentrations of E1 on proliferation of OVCAR-3 cells
由表2可知,2组与1组的吸光度相比,无显著性差异;3组与1组的吸光度相比,有显著性差异(P<0.05);4、5、6组与1组的吸光度相比,差异极显著(P<0.01)。说明E1低质量浓度组对OVCAR-3细胞的生长无影响,随着质量浓度的逐渐升高,抑制作用逐渐增强;当质量浓度达到800μg/mL时,最低存活率为52.31%,且抑制作用呈剂量依赖关系。
另外两种多糖组分E2和E3均未对OVCAR-3细胞显示出抑制生长的作用。由此可见,对卵巢癌OVCAR-3细胞而言,RPS和E1组分对其有显著抑制生长的作用。
2.2 黄秋葵多糖对人乳腺癌MCF-7细胞增殖的抑制作用

表3 不同质量浓度E3对人乳腺癌MCF-7细胞生长的抑制作用Table 3 Effects of different concentrations of E3 on proliferation of MCF-7 cells
由表3可知,2、3、4、5、6组与1组的吸光度相比,有极显著差异(P<0.01)。说明与对照组相比,E3组分对MCF-7细胞增殖有显著的抑制作用。在200μg/mL时,细胞的存活率最低为63.90%。而数据显示:RPS、E1和E2组分未对MCF-7细胞显示出生长抑制作用。
2.3 黄秋葵多糖对人宫颈癌Hela细胞增殖的抑制作用
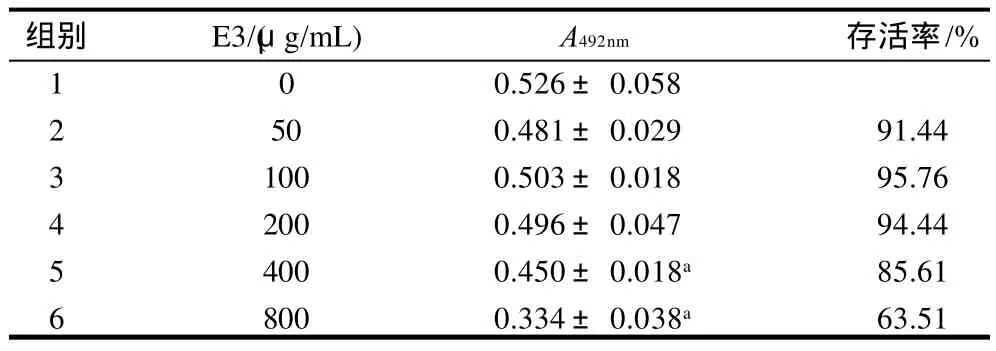
表4 不同质量浓度E3对人宫颈癌Hela细胞生长的抑制作用Table 4 Effects of different concentrations of E3 on proliferation of Hela cells
由表4可知,2、3、4组与1组的吸光度相比,无显著性差异;5、6组与1组的吸光度相比,差异极显著(P<0.01)。说明E3组分在低质量浓度时对Hela细胞的生长无影响;当质量浓度增高至800μg/mL时,细胞存活率仅为63.51%。数据显示:RPS、E1和E2组分未对Hela细胞显示出生长抑制作用。
2.4 黄秋葵多糖对人胃腺癌细胞MCG-803增殖的抑制作用

表5 不同质量浓度E3对人胃腺癌细胞MCG-803生长的抑制作用Table 5 Effects of different concentrations of E3 on proliferation of MCG-803 cells
由表5可知,2组与1组的吸光度相比,无显著性差异;3组与1组的吸光度相比,差异显著(P<0.05);4、5、6组与1组的吸光度相比,差异极显著(P<0.01)。说明E3低质量浓度组对MCG-803细胞的生长无影响,随着质量浓度的逐渐升高,抑制作用逐渐增强,最低存活率为67.71%,抑制作用呈剂量依赖关系。数据显示:RPS、E1和E2组分未对MCG-803细胞显示出生长抑制作用。
3 结 论
本实验用水提醇沉法提取黄秋葵粗多糖,并将粗多糖经DEAE-纤维素分级纯化,得到3种不同的含糖组分E1、E2和E3。采用噻唑兰MTT法分别检测RPS、E1、E2和E3对4种人体肿瘤细胞(OVCAR-3、MCF-7、Hela、MCG-803)的生长抑制作用。研究结果显示:对OVCAR-3细胞,RPS和E1组分可抑制其生长,细胞的存活率最低可分别降至72.30%和52.31%,且呈剂量依赖关系;而E2和E3组分未显示抑制作用。另外,E3组分可抑制MCF-7、Hela和MCG-803细胞的生长,细胞的存活率最低可分别降至63.90%、63.51%和67.71%。结果表明,黄秋葵多糖组分RPS、E1和E3可对不同的人体肿瘤细胞特异性起抑制作用。
伍焕杰等[9]研究表明小分子改构苹果多糖对人结肠癌HT29细胞增殖有显著的抑制作用且能诱导细胞的凋亡。吕俊等[17]研究表明银耳多糖可诱导肝癌HepG-2细胞凋亡,从而抑制细胞的增殖。银耳多糖的主链结构为甘露聚糖,支链由葡萄糖醛酸和木糖组成。朱劲华等[18]研究发现极大螺旋藻胞内多糖可抑制SMMC7721肿瘤细胞的生长,诱导SMMC7721细胞凋亡。极大螺旋藻胞内多糖组成为鼠李糖、木糖、岩藻糖、甘露糖、半乳糖等。细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序死亡,它涉及一系列基因的激活、表达以及调控,在肿瘤的生长过程中起着重要的作用。黄秋葵多糖的主要成分为葡萄糖醛酸、鼠李糖、半乳糖、阿拉伯糖、甘露糖、葡萄糖等[16]。因此推测黄秋葵多糖对人体肿瘤细胞的生长抑制作用机理可能与其诱导肿瘤细胞凋亡有关,但具体的作用机制还有待进一步研究。
目前,相对于动物实验存在费用高、实验周期长和社会道德等问题,利用体外培养细胞筛选抗肿瘤药物已成为非常重要的手段[19]。MTT法中,活细胞线粒体中的琥珀酸脱氢酶可使噻唑兰MTT还原为水不溶性的甲瓒(formazan),并沉积在细胞中,而死细胞无此功能。DMSO溶解甲瓒,测吸光度可间接反映活细胞的数量,这是目前检测细胞增殖与活性的常用方法,但是体外二维细胞培养系统并不能完全模拟人体内三维立体的环境。因此,我们正在建立介于二维细胞培养系统和复杂的动物模型之间的三维细胞培养模型,通过三维支持物扩大细胞的生长空间,增加细胞数量和增强细胞间的相互依赖性,更真实的模拟体内情况,实现快速高通量地筛选抑制肿瘤增殖的生物活性分子[19]。
[1] JACKSON C L, DREADEN T M, THEOBALD L K, et al. Pectin induces apoptosis in human prostate cancer cells:correlation of apoptotic function with pectin structure[J]. Glycobiology, 2007, 17(8):805-819.
[2] YOSHIDA T. Synthesis of polysaccharides having specific biological activities[J]. Prog Polymer Sci, 2001, 26:379-441.
[3] 刘燕, 林瑞超, 李波. 云芝多糖抗肿瘤作用研究进展[J].中成药, 2001,23(10):755-757.
[4] 田庚元, 冯宇澄, 林颖. 植物多糖的研究进展[J]. 中国中药杂志, 1995,20(7):441-444.
[5] 孙卫国, 张学东. 香菇多糖用于晚期或复发癌症的疗效观察[J]. 医药论坛杂志, 2003, 24(23):19-21.
[6] DUNCAN C J G, PUGH N, PASCO D S, et al. Isolation of a galactomannan that enhances macrophage activation from the edible fungusMorchella esculents[J]. Journal of Agricultural and Food Chemistry, 2002, 50(20):5683-5685.
[7] 林志彬. 灵芝抗肿瘤活性和免疫调节作用的研究进展[J]. 北京大学学报, 2002, 34(5):494-495.
[8] 聂少平, 谢明勇, 曹树稳. 纯化茶多糖的抗氧化活性剂其对两种结肠癌细胞增殖抑制作用[J]. 营养学报, 2007, 29(1):46-50.
[9] 伍焕杰, 甘洪全, 李宇华, 等. 改构苹果多糖对人结肠癌HT29细胞凋亡的影响[J]. 现代生物医学进展, 2009, 9(11):2080-2082.
[10] SAVELLO P A, MARTINS F, HULL W. Nutrition composition of okra seed meals[J]. Journal of Agricultural and Food Chemistry, 1980, 28(6):1163-1166.
[11] ROMANCHIK-CERPOVICZ J E, TILMON R W, BALDREE K A.Moisture retention and consumer acceptability of chocolate bar cookies prepared with okra gum as a fat ingredient substitute[J]. Journal of the American Dietetic Association, 2002, 102(9):1301-1303.
[12] 李建华, 陈珊. 黄秋葵水提液抗疲劳的药效学观察[J]. 中国运动医药学杂志, 2004, 23(2):196-197.
[13] 王君耀, 周峻, 汤谷平. 黄秋葵抗疲劳作用的研究[J]. 中国现代应用药学杂志, 2003, 20(4):316-317.
[14] 金忠浇, 林建龙. 治疗皮肤癌的苗头中草药:秋葵[J]. 中华实用中西医杂志, 2001, 29(10):2256.
[15] 王文平, 郭汜远, 李琳, 等. 野木瓜水溶性多糖的提取、分离及结构分析[J]. 华南理工大学学报, 2008, 36(7):128-132.
[16] LENGSFELD C, TITGEMEYER F, FALLER G, et al. Glycosylated compounds from okra inhibit ashesion of helicobacter pylori to human gastric mucosa[J]. Journal of Agricultural and Food Chemistry, 2004, 52(6):1459-1503.
[17] 吕俊, 李璐, 毕富勇. 银耳多糖抑制肝癌HepG-2细胞体外增殖机制的实验研究[J].中国肿瘤, 2009, 18(5):413-415.
[18] 朱劲华, 张威, 王敏, 等. 极大螺旋藻胞内多糖对体外肿瘤细胞抑制作用的实验研究[J]. 海洋科学, 2007, 31(1):1-5.
[19] YANG S T, ZHANG X, WEN Y, et al. Microbioreactors for highthroughput cytotoxicity assays[J]. Current Opinion in Drug and Development, 2008, 11(1):1-12.
Inhibition Effect of Okra Polysaccharides on Proliferation of Human Cancer Cell Lines
REN Dan-dan,CHEN Gu*
(College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China)
TS201.2
A
1002-6630(2010)21-0353-04
2010-03-17
任丹丹(1987—),女,硕士研究生,研究方向为糖类物质及其药物的制备与生物利用。E-mail:rendandan619@163.com
*通信作者:陈谷(1973—),女,副教授,博士,研究方向为糖类物质及其药物的制备与生物利用。E-mail:chengu@scut.edu.cn
