蜂胶醇提物对人肝癌细胞Hep G2增殖及凋亡的影响
2010-10-19吴正双张红城高文宏
吴正双,董 捷,张红城,高文宏*
(1.华南理工大学轻工与食品学院,广东 广州 510641;2.中国农业科学院蜜蜂研究所,北京 100093)
蜂胶醇提物对人肝癌细胞Hep G2增殖及凋亡的影响
吴正双1,2,董 捷2,张红城2,高文宏1,*
(1.华南理工大学轻工与食品学院,广东 广州 510641;2.中国农业科学院蜜蜂研究所,北京 100093)
为探讨蜂胶醇提物对人肝癌细胞Hep G2增殖和凋亡的影响,采用MTT法检测蜂胶醇提物对Hep G2细胞增殖的抑制作用,用荧光倒置显微镜和流式细胞仪分析蜂胶醇提物对Hep G2细胞凋亡的影响。结果表明:12.5~200μg/mL质量浓度的蜂胶醇提物作用24、48h后,均能不同程度地抑制Hep G2细胞的增殖,呈明显的时间、剂量依赖关系,半数抑制质量浓度(IC50)分别是115、78μg/mL。作用8h后,Hep G2细胞出现不同程度的凋亡,凋亡率由6.36%上升到21.9%,呈现出剂量依赖关系。故蜂胶醇提物可显著抑制人肝癌细胞Hep G2的生长,诱导其凋亡。
蜂胶;Hep G2细胞;增殖;凋亡
Abstract:In order to investigate the effect of propolis on cell proliferation and apoptosis, the ethanol extract of propolis was used to treat human liver carcinoma Hep G2 cells. The inhibitory rate of ethanol extract from propolis on the proliferation of human liver carcinoma Hep G2 cells was determined by MTT assay and the apoptosis of human liver carcinoma Hep G2 cells was examined by using inverted fluorescence microscope and flow cytometry analysis. Results indicated that 12.5-200 μg/mL ethanol extract of propolis exhibited an obvious inhibition effect on the proliferation of Hep G2 cells after 24 h and 48 h treatment in a time- and dose-dependent manner. The apoptosis of Hep G2 cells was obviously observed after treatment and apoptosis rate was in the range of 6.36% to 21.9% in a dose-dependent manner. These results confirm that propolis can significantly inhibit the proliferation and induce apoptosis of Hep G2 cells.
Key words:propolis;Hep G2 cell;proliferation;apoptosis
蜂胶是蜜蜂从杨树、桦树、柳树以及针叶树等胶原植物的皮或者嫩芽中采集的树脂和汁液,与蜜蜂本身的喉腺分泌物(主要是酶)混合而成。蜂胶富含黄酮类、萜烯类等生物活性物质,具有多重医疗及保健功效,如抗菌消炎、抗肿瘤、抑制病毒、增强机体免疫力等[1-2]。Najafi等[3]发现蜂胶水提物能够抑制McCoy、HeLa、SP2/0、Hep-2、BHK21细胞的生长。Temiz等[4]发现蜂胶能够促进小鼠结肠的愈合。高寅飞等[5]用蜂胶超临界CO2萃取物做了体外抗肿瘤实验,结果发现其对肿瘤细胞U937、95D、SGC-7901和TE-1都具有较强的抑制作用,IC50分别为117. 42、138. 92、37. 76μg/mL和67. 89μg/mL。Syamsudin等[6]研究发现蜂胶的乙酸乙酯提取物孵育人乳腺癌MCF-7细胞24h后,细胞凋亡率达到13.21%。
细胞凋亡(apoptosis)又称程序性死亡,指在一定的生理、病理情况下,机体为维护内环境的稳定,通过基因调控,在一系列酶参与下,使生物体内一些无用的、老化的细胞高度有序的、自动死亡的过程。细胞凋亡是生物体内一种普遍存在的现象,它贯穿于机体的整个生命过程。在凋亡过程中,细胞的自身形态学特点和生化特性发生改变:形态上细胞膜发生皱缩,细胞核固缩,特异性的细胞浆大泡,染色质浓集,核破裂后被细胞膜包裹形成凋亡小体等。对于肿瘤癌细胞,由于细胞凋亡相关的信号通路产生障碍,使得癌细胞具有不死性,因此通过诱导癌细胞的凋亡能够抑制肿瘤的生长。近来人们对细胞凋亡研究的兴趣越来越大,使用各种药物以及天然产物作用于肿瘤细胞诱导其凋亡并研究其凋亡机制[7-10]。细胞凋亡检测主要是利用细胞凋亡形态学特点和生化特征来进行的。本实验以人肝癌细胞Hep G2为研究对象,采用四甲基偶氮唑(MTT)法检测蜂胶醇提物对人肝癌细胞Hep G2增殖的影响,并用荧光倒置显微镜和流式细胞仪检测蜂胶对Hep G2细胞凋亡的影响,进一步探讨其抗癌的作用机制。
1 材料与方法
1.1 材料与试剂
人肝癌细胞株Hep G2 中国科学院细胞库;蜂胶醇提物 中国农业科学院蜜蜂研究所;胰蛋白酶-EDTA消化液(含0.25%的胰蛋白酶和0.53mmol/L的EDTA)、含青霉素和链霉素的RPMI-1640培养液 Solarbio公司;胰酶、胎牛血清 Gibco公司;二甲基亚砜(DMSO;细胞培养级) Sigma公司;培养皿 Corning公司;Annexin V-FITC/PI细胞凋亡试剂盒 南京凯基生物科技发展有限公司。
1.2 仪器与设备
AL204型精密天平 上海梅特勒-托利多仪器有限公司;HERA-cell150 CO2培养箱 美国Thermo公司;EPPENDORF 5417R型冷冻离心机 德国Eppendorf 公司;SynergyTM HT型多功能酶标仪 美国Bio-tek公司;IX71型荧光倒置显微镜 日本Olympus公司;Cell Lab QuantaTM SC型流式细胞仪 美国Beckman公司。
1.3 方法
1.3.1 细胞培养
将人肝癌细胞Hep G2用含10%胎牛血清的RPMI-1640 培养基在5% CO2、37℃、饱和湿度下的CO2培养箱中传代培养[11]。
1.3.2 蜂胶醇提物工作液的制备
称取0.2g蜂胶醇提物溶于10mL DMSO中,配成质量浓度为20mg/mL的溶液,实验前用RPMI-1640培养液稀释成不同质量浓度,备用。
1.3.3 MTT法检测蜂胶醇提物对Hep G2细胞的增殖活性[12]
取对数生长期的Hep G2细胞,配制成2×104个/mL的单细胞悬液,接种于96孔培养板,每孔190μL,每组设5个复孔,做两板,于5% CO2、37℃条件下的CO2培养箱中培养24h,除去培养液;之后每个96孔板均加入新的培养液190μL与不同质量浓度的蜂胶醇提物工作液10μL分别培养24、28h,蜂胶醇提物的终质量浓度分别为12.5、25、50、100、200μg/mL,空白组加10μL新培养液,实验结束前4h,每孔加100μL质量浓度为5mg/mL的MTT染色液,37℃、5% CO2培养箱中继续培养4h。结束后离心,去除上清,然后每孔加入150μL DMSO,充分振荡后,在酶标仪上570nm波长处测定吸光度。
细胞抑制率/%=(1-A实验组/A对照组)×100
1.3.4 荧光倒置显微镜观察蜂胶诱导的Hep G2细胞凋亡
取对数生长期的Hep G2细胞,经不含EDTA的0.25%胰酶消化后,用RPMI-1640培养液调整细胞密度为1×105个/mL单细胞悬液,接种于事先置于6孔培养板里的盖玻片上培养,每个盖玻片上95μL,培养24h贴壁后;加入5μL不同质量浓度的蜂胶醇提物工作液,使蜂胶醇提物终质量浓度分别为12.5、25、50、100、200μg/mL继续培养8h,空白组加5μL的培养基,相差显微镜下观察细胞形态。PBS洗涤细胞两次,在500μL的Binding Buffer中加入5μL Annexin V-FITC、5μL 碘化丙啶(PI),混匀后加入到盖玻片表面,使盖玻片表面均匀覆盖;避光、室温反应10min。将盖玻片倒置于载玻片上于荧光倒置显微镜下,蓝色光激发、双色滤光片观察,Annexin V-FITC荧光信号呈绿色,PI荧光信号呈红色。
1.3.5 流式细胞仪检测蜂胶诱导的Hep G2细胞凋亡[7]
取对数生长期的Hep G2细胞,经不含EDTA的0.25%胰酶消化后,用RPMI-1640培养液调整细胞密度为1×105个/mL单细胞悬液,接种于6孔培养板,每孔950μL,培养24h;然后加入50μL不同质量浓度的蜂胶醇提物工作液,混匀使蜂胶醇提物终质量浓度分别为12.5、25、50、100、200μg/mL,空白对照组加50μL培养基,每个稀释度设4个平行孔,继续培养8h。收集上述药物处理的Hep G2细胞,用PBS洗涤细胞2次(1000r/min离心5min),加入500μL的Binding Buffer悬浮细胞,加入5μL Annexin V-FITC混匀后,再加入5μL PI,混匀,室温避光反应10min,1h内用流式细胞仪分析。
1.4 数据处理
2 结果与分析
2.1 蜂胶醇提物对人肝癌细胞Hep G2细胞增殖的影响

图1 蜂胶醇提物对人肝癌细胞Hep G2增殖的抑制作用Fig.1 Inhibitory effect of ethanol extract of proplis on proliferation of Hep G2 cells
由图1可看出,蜂胶醇提物对人肝癌细胞Hep G2的生长有明显的抑制作用,且抑制作用随着蜂胶醇提物质量浓度的增大、作用时间的延长而增强,并呈良好的剂量-效应关系。当蜂胶质量浓度为200μg/mL时,对Hep G2细胞的抑制作用达到最高,作用24、48h的抑制率分别是70.9%、91.30%,半数抑制质量浓度(IC50)分别是115、78μg/mL。
2.2 蜂胶醇提物对人肝癌细胞Hep G2凋亡的影响
2.2.1 相差显微镜下观察蜂胶醇提物对人肝癌细胞Hep G2形态的影响
从空白对照样品中可以看出,未经蜂胶醇提物处理的Hep G2细胞生长正常,没有出现凋亡特征,并且进行正常的分裂生长(图2 a)。而经不同质量浓度的蜂胶醇提物处理8h后,与空白对照组相比,图2b中的Hep G2细胞核分裂相对减少,细胞贴壁能力下降,部分细胞脱落。并且随着质量浓度的增加,图2c中悬浮细胞逐渐增多,部分细胞变形,从上清液中可以看见少许细胞碎片,出现发泡现象但细胞膜仍保持完整;贴壁细胞收缩变小变圆,与周围细胞脱离(图2d);图2e中的Hep G2细胞的细胞膜和核膜上出现空洞,膜内外在进行物质交换;当质量浓度为200μg/mL时,出现了许多被膜包裹的凋亡小体(图2f)。故从形态学上可以直观地观察到Hep G2细胞的凋亡程度随蜂胶醇提物质量浓度的增大而升高。
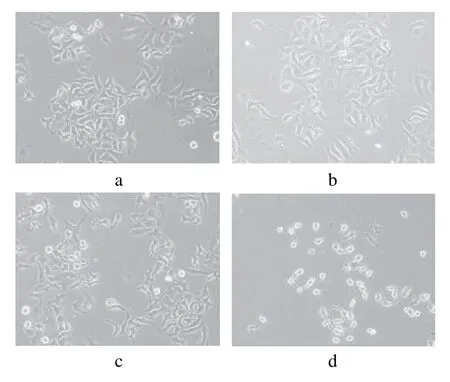

图2 蜂胶醇提物诱导人肝癌细胞Hep G2凋亡的形态学观察Fig.2 Morphological change of Hep G2 cells induced by ethanol extract of propolis
2.2.2 荧光倒置显微镜下观察蜂胶醇提物诱导的人肝癌细胞Hep G2凋亡
正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的PS由脂膜内侧翻向外侧。故可与FITC标记的Annexin V结合而发出绿色荧光。PI是一种核酸染料,它不能透过完整的细胞膜,但凋亡中晚期和坏死细胞的细胞膜完整性被破坏,PI能够透过细胞膜而使细胞核染成红色。因此将Annexin V-FITC与PI匹配使用,就可以将处于不同凋亡时期的细胞区分开来。

图3 荧光倒置显微镜下观察蜂胶醇提物对人肝癌细胞Hep G2的影响Fig.3 Effect of ethanol extract of propolis on Hep G2 cells observed under inverted fluorescence microscope
由图3a可以观察到,空白对照样品的人肝癌细胞Hep G2既没有被FITC荧光染色也没有被PI染色,因此未经蜂胶醇提物处理的正常生长的Hep G2细胞,PS不会发生翻转,细胞膜通透性也没有改变。但经终质量浓度为12.5、25、50、100、200μg/mL的蜂胶醇提物处理8h后,结果表明,Hep G2都被不同程度的染色,蜂胶醇提物质量浓度越低,诱导细胞凋亡的作用越弱,只有较少的细胞被FITC染色(图3b),随着蜂胶醇提物质量浓度的增加,被FITC染色的细胞数目也不断增加,同时能染上微弱的红色染料PI(图3c、3d),这表明Hep G2细胞已进入凋亡早期。随着蜂胶醇提物质量浓度增加,在荧光倒置显微镜下可以观察到Hep G2细胞异染色质浓缩,沿核膜内侧排列,凝结成块,绿色荧光分布在细胞膜周围,红色荧光分布在细胞核上(图3 d、3e),这表明Hep G2细胞已由凋亡早期逐步过渡到凋亡中晚期。当蜂胶醇提物质量浓度达到200μg/mL时,被FITC染色的Hep G2细胞显著减少,被PI染色的细胞明显增多(图3f),这表明Hep G2细胞几乎全部进入凋亡中晚期。
实验中的Annexin V是一种Ca2+依赖性磷脂结合蛋白,与PS有高度亲和力,故可通过细胞外侧暴露的PS与凋亡早期细胞的胞膜结合。如果使用含EDTA的胰酶消化液,EDTA就会与Annexin V 竞争性结合Ca2+,使得标记FITC荧光素的Annexin V不能与PS结合,因此,收集Hep G2细胞进行流式细胞仪检测时,必须用不含EDTA的胰酶消化液。
2.2.3 流式细胞仪检测蜂胶醇提物诱导的人肝癌细胞Hep G2的凋亡
流式细胞仪以FITC和PI荧光作双参数散点图,细胞分为4个区:左上象限Q1(Annexin V-FITC-,PI+)代表细胞膜几乎不存在的坏死细胞;右上象限Q2(Annexin V-FITC+,PI+)代表凋亡晚期和死亡细胞;左下象限Q3(Annexin V-FITC-,PI-)代表正常细胞;右下象限Q4(Annexin V-FITC+,PI-)代表凋亡早期细胞。


图4 流式细胞仪分析人肝癌细胞Hep G2凋亡的散点图Fig.4 Scattering diagram of Hep G2 cell apoptosis detected by flow cytometer
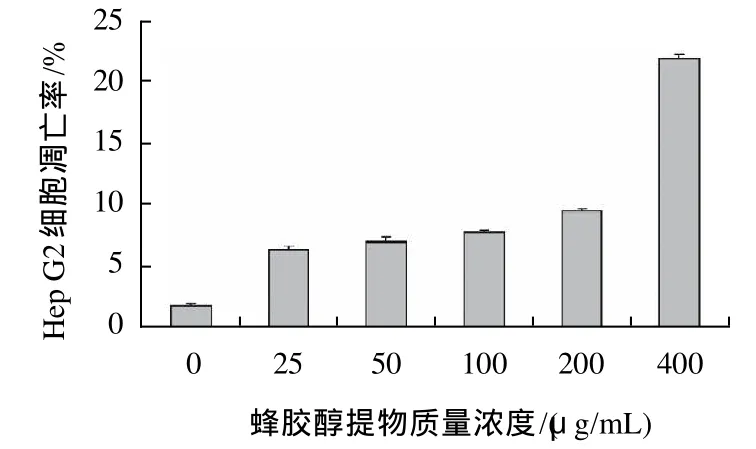
图5 蜂胶醇提物对人肝癌细胞Hep G2凋亡率的影响Fig.5 Effect of ethanol extract of propolis on apoptosis of Hep G2 cells
由图4、5及流式细胞仪生成的数据可知,未经蜂胶醇提物处理的细胞,绝大多数为正常细胞,占总细胞数的96.43%,但也有一定比例的凋亡细胞和坏死细胞,可能是因为消化细胞时,外力导致部分细胞发生机械损伤。蜂胶醇提物处理Hep G2细胞8h后,Hep G2细胞凋亡率随着蜂胶醇提物质量浓度的升高逐渐增加,由6.36%上升到21.9%;进入凋亡晚期的以及死亡的细胞比例也明显增加,由0.92%提高到20.82%;同时,正常细胞的比例显著下降,由原来的96.43%下降到56.11%,并呈浓度依赖性。经t检验,蜂胶醇提物处理组的细胞凋亡率与未处理组(1. 87%)相比均有显著性差异(P<0.01)。这说明蜂胶醇提物在较低的质量浓度和较短的时间内就可以诱导Hep G2细胞的凋亡。本实验之前还做了DMSO溶剂对照组实验,发现当细胞培养液中细胞培养级别的DMSO体积分数不超过2%时,对细胞的增殖和凋亡几乎无影响,因此实验中DMSO的最大体积分数选择1%。
3 结 论
质量浓度12.5~200 μ g/mL的蜂胶醇提物作用24、48h后,均能不同程度的抑制Hep G2细胞的增殖,呈明显的时间、剂量依赖关系,半数抑制质量浓度(IC50)分别是115、78μg/mL。作用8h后,Hep G2细胞出现不同程度的凋亡,凋亡率由6.36%上升到21.9%,呈现出剂量依赖关系。因此认为,蜂胶醇提物能够通过诱导人肝癌细胞Hep G2的凋亡而表现出很强的抗肿瘤活性,在较低的质量浓度和较短的时间内就能够抑制Hep G2细胞的增殖和诱导Hep G2细胞的凋亡。
本实验中应用的流式细胞技术具有快速、灵敏、准确的特点,并日益成为检测细胞凋亡的主要手段。该方法还可以在完整细胞的基础上,直接分析DNA含量的改变;并可同时对细胞表型和调控蛋白进行测定。因此流式细胞技术为本课题进一步研究蜂胶诱导Hep G2细胞凋亡的作用机理,包括研究细胞端粒酶活性、bcl-2蛋白的表达等,提供了新手段[13-14]。
[1] 王亚群, 任永新. 蜂胶的化学成分及其保健作用[J]. 食品与药品,2006, 8(12):75-76.
[2] MISHIMA S, NARITA Y, CHIKAMATSU S. Effects of propolis on cell growth and gene expression in HL-60 cells[J]. Journal of Ethnopharmacology, 2005, 99(1):5-11.
[3] NAJAFI M F, VAHEDY F, SEYYEDIN M, et al. Effect of the water extracts of propolis on stimulation and inhibition of different cells[J].Cytotechnology, 2007, 54:49-56.
[4] TEMIZ M, ASLAN A, CANBOLANT E. Effect of propolis on healing in experimental colon anastomosis in rats[J]. Advances in Therapy,2008, 25(2):159-167.
[5] 高寅飞, 马海乐, 王振斌, 等. 蜂胶超临界CO2萃取物的体外抗肿瘤试验研究[J]. 肿瘤, 2007, 27(2):115-117.
[6] SYAMSUDIN, SIMANJUNTAK P, DIAMIL R, et al. Apoptosis of human breast cancer cells induced by ethylacetate extracts of propolis[J].American Journal of Biochemistry and Biotechnology, 2010, 6(2):84-88.
[7] 梁智辉, 朱慧芬, 陈九武. 流式细胞术基本原理与实用技术[M]. 武汉:华中科技大学出版社, 2008:60-67.
[8] CASTANEDA F, ZIMMERMANN D, NOLTE J, et al. Role of undecan-2-one on ethanol-induced apoptosis in HepG2 cells[J]. Cell Biology Toxicology, 2007, 23:477-485.
[9] AGNIESZKA S C, KRZYSZTOF P, JADWIGA D, et al. Zinc inhibits ethanol-induced HepG2 cell apoptosis[J]. Toxicology and Applied Pharmacology, 2008, 229:1-9.
[10] HUANG Jian, TANG Xiaohui, TAKASHI I, et al. A New Triterpenoid from panax ginseng exhibits cytotoxicity through p53 and the caspase signaling pathway in the HepG2 cell line[J]. Archives of Pharmacal Research, 2008, 31(3):323-329.
[11] 刘玉琴. 细胞培养实验手册[M]. 北京:人民军医出版社, 2009:31-34.
[12] 李燕, 张健. 细胞与分子生物学常用实验技术[M]. 西安:第四军医大学出版社, 2009:8-10.
[13] MIRNA M M, WILLIAMS G T. Protein phosphatase 4 regulates apoptosis, proliferation and mutation rate of human cells[J]. Biochimica et Biophysica Acta, 2009(1783):1490-1502.
[14] ZHANG Lijuan, LI Zaiquan, YANG Yepeng, et al. Tunicamycin suppresses cisplatin-induced HepG2 cell apoptosis via enhancing p53 protein nuclear export[J]. Molecular Cell Biochemistry, 2009, 327:171-182.
Effect of Ethanol Extract of Propolis on Proliferation and Apoptosis of Human Liver Carinoma Hep G2 Cells
WU Zheng-shuang1,2,DONG Jie2,ZHANG Hong-cheng2,GAO Wen-hong1,*
(1. College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510641, China;2. Bee Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100093, China)
S896.6
A
1002-6630(2010)21-0344-05
2010-05-07
国家现代农业(蜂)产业技术体系资助项目(NYCYTX-43);国家公益性行业(农业)科研专项经费项目(nyhyzx07-041)
吴正双(1985—),男,硕士研究生,研究方向为食品质量与安全。E-mail:zhshwu1208@163.com
*通信作者:高文宏(1970—),女,副教授,博士,研究方向为食品质量与安全。E-mail:zzhc@sohu.com
