漂洗方式对鲢鱼鱼糜凝胶劣化性能的影响
2010-10-19雷跃磊熊善柏
刘 茹,钱 曼,雷跃磊,熊善柏,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
漂洗方式对鲢鱼鱼糜凝胶劣化性能的影响
刘 茹1,2,钱 曼1,2,雷跃磊1,2,熊善柏1,2,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
以新鲜鲢鱼为原料,研究不同漂洗方式下鱼糜凝胶劣化性能,并通过内源性蛋白酶活性的变化来分析其凝胶劣化。结果表明:鱼糜凝胶劣化程度与漂洗方式有关,盐水漂洗可有效地去除鱼糜中的蛋白酶,抑制凝胶劣化,从而形成较理想的凝胶品质;酸洗最不易除去内源性蛋白酶,并且还可能导致部分蛋白质的酸变性,形成的鱼糜凝胶性能最差,不适于鲢鱼鱼糜的加工。鱼糜凝胶劣化与其内源性蛋白酶密切相关,在热处理前若蛋白质已变性会增大凝胶劣化的程度。
鲢鱼鱼糜;漂洗;凝胶劣化;凝胶品质;内源性蛋白酶
Abstract:The effect of four rinsing modes (with saline, acid, alkaline or plain waters) on the modori and endogenous protease activity of silver carp surimi was investigated in this work. Modori depended on rinsing solution type. Rinsing with salt water could remove effectively endogenous protease and inhibit modori. Acidic water was not an ideal rinsing solution for the removal of endogenous protease. Rinsing with acidic water resulted in the poorest gel properties due to acidic denaturation of some proteins among these four rinsing modes and therefore, was unsuitable for processing silver carp surimi. In conclusion, modori is closely related to endogenous protease and protein denaturation before heating would augment modori.
Key words:silver carp surimi;rinsing;modori;gel property;endogenous protease
鱼糜制品是全球生产、消费量最大的水产食品之一,其原料主要是狭鳕等海水鱼类,近年来随着海洋资源日益萎缩,海水鱼的捕捞量越来越少,而鱼糜制品的需求量在增加,开发新的鱼糜制品原料具有重要意义,与海水鱼相比,淡水鱼都是人工养殖的,产量可以控制,如果发展得好,对鱼糜行业来说将是一个很好的出路,鲢鱼是我国产量最大的淡水鱼,用其生产鱼糜是解决目前鱼糜制品原料不足的最有效途径。但是鲢鱼鱼糜极易凝胶劣化的性质严重影响其制品的品质[1-2],因此如何抑制鲢鱼鱼糜凝胶劣化,是水产品研究的重要课题。
鱼糜的凝胶劣化(modori)是指在接近60℃的温度导致鱼糜凝胶形成能力和凝胶强度不可逆降低的现象[3],鲢鱼属于易凝胶劣化鱼种[4],目前对于鲢鱼鱼糜凝胶劣化的控制主要是通过两段加热或添加蛋白酶抑制剂来实现[5-7]。鱼肉中水溶性蛋白质中富含妨碍凝胶形成的酶和诱发凝胶劣化的活性物质,而漂洗是鱼糜加工过程中必不可少的一步,其目的是为了除去鱼肉中的有色物质及腥臭成分,以及脂肪、残余的碎屑、血液、水溶性蛋白质,从而获得色白、无腥味、富有弹性的鱼糜制品。汪之和等[8]、孔保华等[9]报道了漂洗方式对鱼糜凝胶性能的影响,认为选择合适的漂洗条件可明显改善鱼糜凝胶性能,而对其原因还没有全面的理解,该凝胶性能的提高是否与漂洗掉了部分内源性蛋白酶有关还未见报道。
本实验以新鲜鲢鱼为原料,研究不同漂洗模式对鱼糜凝胶劣化及内源性蛋白酶活性的影响,分析漂洗模式与蛋白酶的残留及凝胶劣化之间的关系,从而提出如何通过控制凝胶劣化的漂洗方法来提高鱼糜的凝胶性能。
1 材料与方法
1.1 材料与试剂
鲢鱼,约1000g/条,购于华中农业大学菜市场。
三羟甲基氨基甲烷(Tris)、牛血清白蛋白均为生化试剂 国药集团化学试剂有限公司;酪蛋白(生化试剂)北京市海淀区微生物培养基制品厂;其他试剂均为分析纯。
1.2 仪器与设备
TA-XTPlus质构仪 英国Stable Micro System公司;WSC-S测色色差仪 上海物理光学仪器厂。
1.3 方法
1.3.1 鱼糜凝胶的制备
鲢鱼→去头、内脏、鱼鳞→清洗→采肉→漂洗→擂溃→灌肠→加热→冷却→鱼糜凝胶样品
取鱼肉分别用以下5种漂洗液漂洗后加2.5%的食盐和80%的水擂溃成鱼糜,手工灌入直径为20mm的肠衣,在45、50、55、60、65、70℃条件下分别加热30、60min,迅速流水冷却,冰箱里(4℃)放置过夜,测定鱼糜凝胶特性。凝胶性能的变化率(Δ)按式(1)计算。
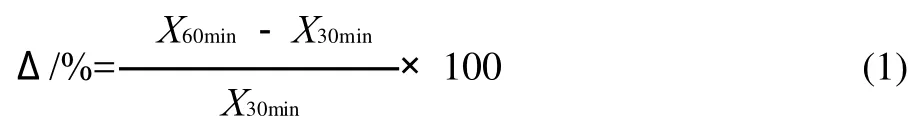
式中:X30min和X60min分别代表在相应温度加热30min和60min凝胶的凝胶性能大小。
漂洗模式如下:1)水洗,5倍清水漂洗3次,每次5min;2)酸洗,两次5倍体积0.5g/100mL的柠檬酸漂洗,一次5倍体积清水漂洗,每次5min;3)碱洗,两次5倍体积0.5%的碳酸钠漂洗,一次5倍体积清水漂洗,每次5min;4)盐洗,一次5倍体积清水,两次5倍体积0.5%盐水漂洗,每次5min;以未进行漂洗的鱼糜凝胶作为对照。
1.3.2 鱼糜凝胶穿刺强度的测定[10]
用TA-XTPlus质构仪进行测定,参数设定为:压缩距离15mm,测试速度1mm/s,接触力5.0g,探头P/0.25s,样品高20mm,直径20mm,穿刺强度为压缩过程中的最大力,每个样品重复4次。
1.3.3 鱼糜凝胶咀嚼性和弹性的测定[10]
用TA-XTPlus质构仪进行测定,参数设定为:选TPA(texture profile analysis)压缩模式,中间停留5s,测试速度1mm/s,接触力5.0g,变形程度50%,探头型号P/36R,样品高20mm,直径20mm,每个样品重复4次。
1.3.4 白度的测定[11]
将鱼糜凝胶切成0.5mm的薄片,采用WSC-S测色色差仪测定样品的L*、a*、b*值,白度由式(2)计算。
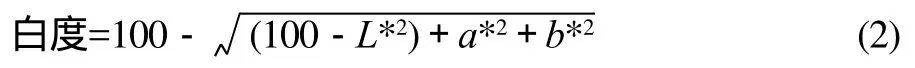
1.3.5 TCA-可溶性肽含量的测定[12]
称取3g绞碎的鱼糜凝胶于试管中,加入27mL 15g/100mL的TCA(三氯乙酸),均质后于0℃下静置1h。将溶液在4000r/min下离心10min,取上清液用Lowry法[13]测可溶性肽含量,并用μmol Tyr/g来表示。
1.3.6 鲢鱼白肉中蛋白酶的提取
将鱼肉与pH7.0的磷酸盐缓冲液以体积比1:1混合,经组织捣碎机搅打10~15s后于4℃下提取1h,于8000 r/min转速下离心20min (4℃),将上清液保存于0℃冰箱中待用。
1.3.7 鱼糜蛋白酶活性的测定
参照高雯等[14]的方法,根据鲢鱼糜中蛋白酶的特性进行酶活测定,反应温度为70℃,反应时间30min。采用Lowry法[13]测生成的酪氨酸的量。
单位酶活:在反应条件下,1min内能够水解底物并释放出1μg酪氨酸的酶体积(mL)。
1.3.8 数据处理
所有实验重复3~4次,采用Excel、SAS软件进行数据分析,结果取其平均值,Duncan分析用来评价不同处理条件下,各指标之间差异的显著性,Pearson法分析TCA-可溶性肽与质构性能的相关性,显著水平为P<0.05。
2 结果与分析
2.1 漂洗方式对鱼糜凝胶质构性能的影响
不同漂洗方式下鱼糜凝胶的质构性能见表1,其中加热60min相对于30min的变化率(Δ)小于零说明延长时间加热会降低该凝胶指标,这与凝胶劣化有关。盐洗鱼糜凝胶的穿刺强度和咀嚼性都明显高于其他漂洗方式,且它们分别在50~70℃和55~70℃温度段的变化率小于零,其中在60℃减少率最大,并且弹性也是在该温度下降得最多。碱洗鱼糜的穿刺强度和咀嚼性的变化率小于零的温度段均在50~70℃,并于60℃降低的幅度最大,弹性也是在该温度下降得最多。酸洗鱼糜的穿刺强度和咀嚼性分别在50~70℃和45~70℃随加热时间的延长而下降,穿刺强度在70℃下降幅度最大,而咀嚼性在45~55℃下降幅度相对较大,弹性在50~60℃随加热时间的延长而下降,此外,酸洗鱼糜的穿刺强度和咀嚼性都明显低于其他漂洗方式的,且低于未漂洗的,表明酸性漂洗液对鱼糜凝胶的形成具有一定的破坏作用。水洗鱼糜的穿刺强度和咀嚼性的负变化率均发生在55~70℃,且55~65℃时下降幅度较大。
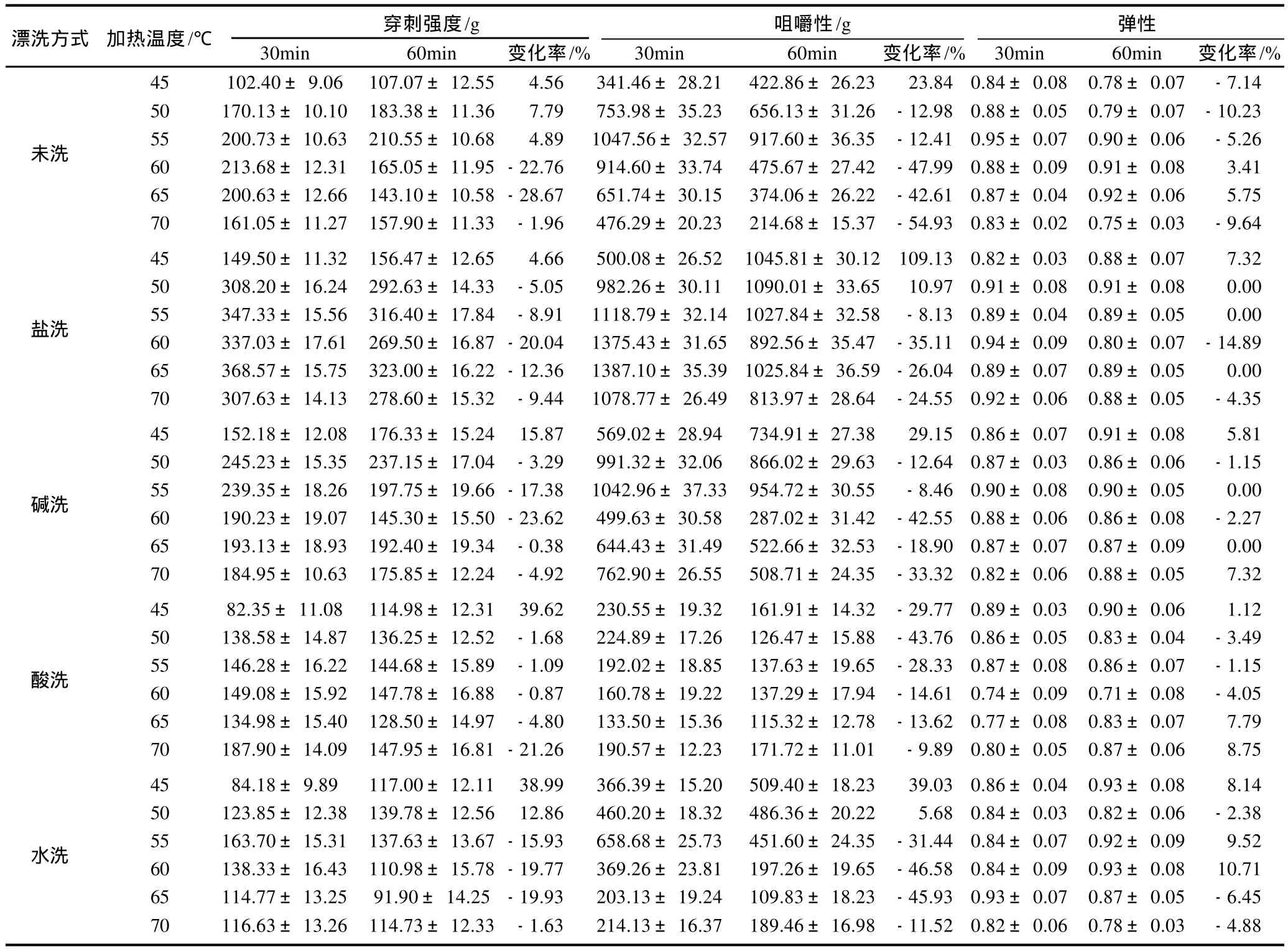
表1 不同漂洗方式下鱼糜凝胶的质构性能Table 1 Textural Properties of surimi gel with various rinsing modes
2.2 漂洗模式对鱼糜凝胶中蛋白质降解的影响
TCA-可溶性肽反映的是鱼糜中小分子肽的含量,其生成量越多,说明蛋白质被降解的程度越大[12,15],本实验中以TCA-可溶性肽生成量来反映蛋白质的降解程度。由图1可知,随着加热时间的延长TCA-可溶性肽含量都有所增加,在45~55℃加热形成的鱼糜凝胶中TCA-可溶性肽含量受温度的影响不大,温度超过55℃,鱼糜凝胶中TCA-可溶性肽含量受温度的影响较大。从总体上看,在所有温度段加热形成的盐洗鱼糜凝胶TCA-可溶性肽含量均最小,低于未漂洗和其他漂洗方式的鱼糜凝胶,说明盐水漂洗可有效抑制鱼糜中蛋白质的降解。清水漂洗鱼糜凝胶中TCA-可溶性肽含量明显低于未漂洗的而略高于盐水漂洗的,说明,虽然清水和碱水漂洗可部分抑制鱼糜中蛋白质的热降解,但其效果不如盐水漂洗的效果好。酸洗鱼糜凝胶TCA-可溶性肽含量峰值出现在60℃,而且TCA-可溶性肽含量最大,表明鱼糜凝胶降解程度最大,虽然60℃以后肽含量有所下降,但较其他鱼糜凝胶仍较高,验证了酸性漂洗液对鱼糜凝胶有较大的破坏作用。
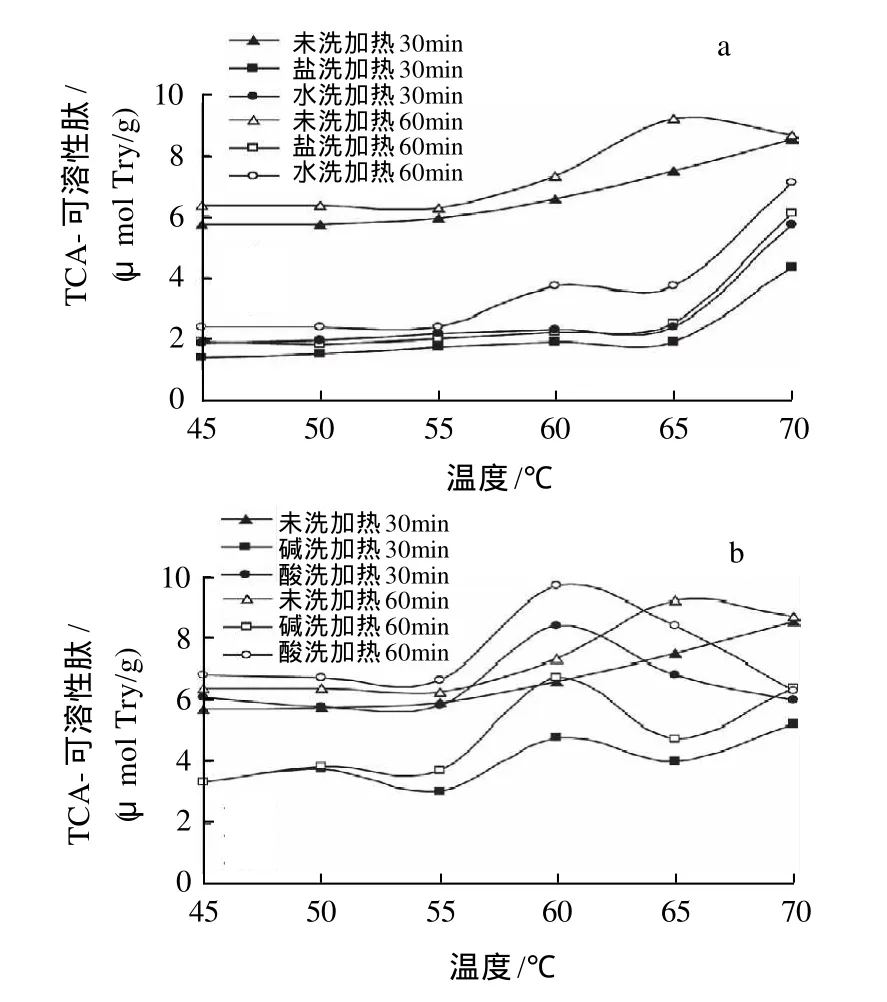
图1 漂洗方式对鱼糜凝胶中TCA-可溶性肽的影响Fig.1 Effect of rinsing mode on TCA-soluble peptide in surimi gel
对TCA-可溶性肽与凝胶质构指标进行了相关性分析,结果见表2。TCA-可溶性肽与穿刺强度、咀嚼性和弹性都呈极显著负相关,说明凝胶性能的下降与蛋白质被降解为小肽具有很大的相关性。而蛋白质降解多是由蛋白酶诱导产生的,故最后研究了不同漂洗条件下残留的蛋白酶活性。

表2 TCA-可溶性肽与凝胶质构指标的相关系数Table 2 Correlation coefficient between TCA-soluble peptide and textural indexes
2.3 漂洗方式对鱼糜蛋白酶活性的影响
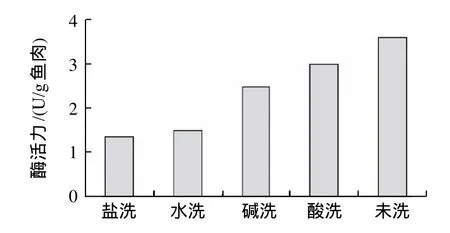
图2 漂洗方式对鱼糜内源蛋白酶活性的影响Fig.2 Effect of rinsing mode on endogenous protease activity in surimi
经不同的漂洗模式进行处理后鱼糜中蛋白酶的活性见图2。各种漂洗方法均能去除部分内源性蛋白酶,其效果由强到弱的顺序为:盐洗>水洗>碱洗>酸洗。由前面分析可知,盐洗鱼糜形成的凝胶性能也最好,酸洗的最差,由此可推测:鱼糜中内源性蛋白酶活性是影响鱼糜凝胶劣化的一个重要因素。此外,酸洗也可除去少量的蛋白酶,但是经酸洗后鱼糜形成的凝胶性能却低于未漂洗的,原因可能是酸洗引起了肌球蛋白与肌动蛋白的酸变性,导致凝胶性能较低,这同时说明了鱼糜蛋白的天然构象对凝胶性能也有一定的影响,即蛋白质的天然构象也是影响鱼糜凝胶劣化的因素之一。
2.4 漂洗方式对鱼糜凝胶白度的影响
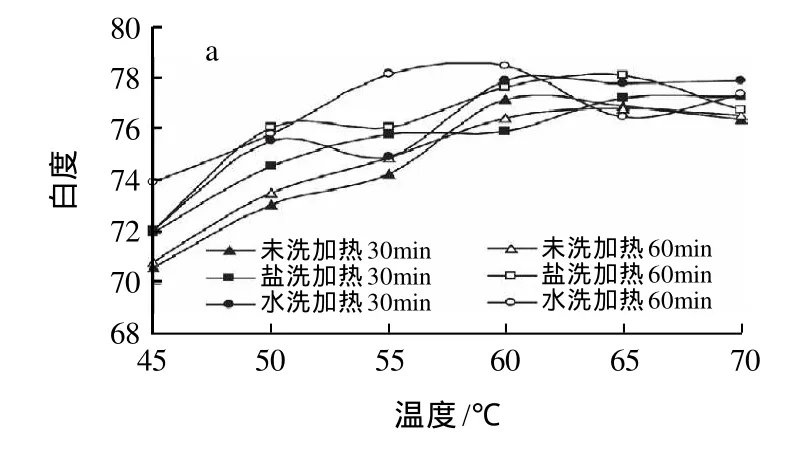
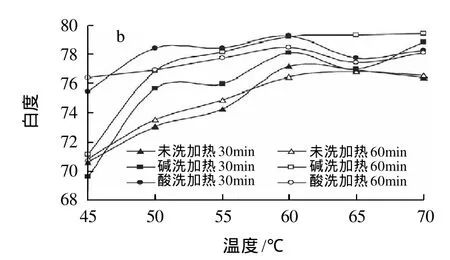
图3 漂洗方式对鱼糜凝胶白度的影响Fig.3 Effect of rinsing mode on whiteness of surimi gel
由图3可知,漂洗可不同程度地提高鱼糜凝胶的白度,这是因为漂洗可以除去鱼肉中存在的有色物质,从而改善鱼糜凝胶的色泽。此外,鱼糜凝胶的白度随着加热温度的升高总体呈上升趋势,且在低于50℃时白度上升较快。
3 讨 论
盐水比其他漂洗液可更有效地提高鱼糜凝胶性能。其原因可能如下:1)盐水漂洗可更有效地去除部分蛋白酶,蛋白酶的存在会使鱼糜蛋白质降解[16-18],导致由蛋白质形成的网络结构强度降低,因此用盐水漂洗可以提高鱼糜的凝胶性能;2)盐水漂洗除去了部分水溶性蛋白:有报道说水溶性蛋白质的存在会干扰由盐溶性蛋白质形成的网络结构[19],漂洗可使盐溶性蛋白含量相对提高,从而增加了凝胶性能。
经柠檬酸溶液漂洗的鱼糜形成的凝胶性能最差,且TCA-可溶性肽的含量明显高于盐水漂洗的。说明用酸性漂洗液对鱼糜凝胶的形成具有一定的破坏作用。其存在的原因可能是:首先,随着pH值的降低,可能引起肌球蛋白与肌动蛋白的酸变性[20-21];其次,酸液不易洗去内源蛋白酶,有更多的蛋白酶残留;再次,酸洗使得鱼糜的pH值较接近鱼糜蛋白质的等电点,此时蛋白质所带的净负电荷最少,蛋白质在热变性前就由于蛋白质间的引力作用发生了部分聚集,因而凝胶性也最差。
关于鱼糜凝胶劣化,目前认为主要是由被激活的内源热稳定蛋白酶快速降解肌球蛋白而产生的弱凝胶或者糊状凝胶引起的。Toyohara等[22]认为不同温度对蛋白质凝胶劣化的影响可能是由于不同的蛋白酶引起的。本研究发现经不同漂洗模式处理获得的鱼糜其凝胶劣化温度有所不同,由实验结果推测:在不同漂洗模式下鱼糜凝胶劣化温度的差异可能是由于漂洗模式的不同导致鱼糜中内源性蛋白酶分布的变化所引起的,此外,蛋白质的天然构象对鱼糜凝胶劣化也起到一定的作用。
4 结 论
漂洗可部分去除鱼糜的内源性蛋白酶,进而影响鱼糜的凝胶劣化。盐洗、水洗、碱洗、酸洗4种漂洗方式相比,盐水漂洗对内源性蛋白酶去除的效果最好,对凝胶劣化的抑制作用也最大,形成了较理想的凝胶品质,其次是水洗和碱洗,而酸洗去除内源性蛋白酶的效果最差,并且还可能导致部分蛋白质的酸变性,形成的鱼糜凝胶性能最差,且低于未漂洗的,不适于鲢鱼鱼糜的加工。
[1] LIU Ru, ZHAO Siming, LIU Haimei, et al. Studies on fish and pork paste gelation by dynamic rheology and circular dichroism[J]. Journal of Food Science, 2007, 72(7):E399-E403.
[2] 曹敏杰, 李燕, 翁凌, 等. 鲢鱼肌原纤维结合型丝氨酸蛋白酶的研究[J]. 食品科学, 2005, 26(1):91-94.
[3] AN H, PETERS M Y, SEYMOUR T A. Role of endogenous enzymes in surimi gelation[J]. Trends in Food Science and Technology, 1996, 7:321-326.
[4] 吴汉民, 王海洪, 韩素珍, 等. 几种淡水鱼鱼糜特性的研究[J]. 食品科学, 1999, 20(9):15-19.
[5] RAWDKUEN S, BENJAKUL S, VISESSANGUAN W, et al. Chicken plasma protein affects gelation of surimi from bigeye snapper (Priacanthus tayenus)[J]. Food Hydrocolloids, 2004, 18:259-270.
[6] VISESSANGGUAN W, BENJAKUL S, AN H. Porcine plasma proteins as a surimi protease inhibiter:Effect on actomyosin gelation[J].Journal of Food Science, 2000, 65:607-611.
[8] 汪之和, 王慥. 漂洗条件对鲢鱼糜蛋白质冷冻变性的影响[J]. 上海水产大学学报, 1999, 8(3):210-214.
[9] 孔保华, 耿欣, 高兴华, 等. 不同漂洗方法对鲢鱼凝胶特性的影响[J].食品工业, 2000(1):42-43; 41.
[10] BOURNE M C. Texture profile analysis[J]. Food Technology, 1978, 32(7):62-66; 72.
[11] 刘茹, 熊善柏, 赵思明, 等. 鱼糜冻藏过程中的品质变化动力学研究[J]. 食品工业科技, 2007, 28(2):78-85.
[12] BENJAKUL S, VISESSANGUAN W, TUEKSUBAN J, et al. Effect of some protein additives on proteolysis and gel-forming ability of lizardfish(Saurida tumbil)[J]. Food Hydrocolloids, 2004, 18:395-401.
[13] LOWRY O H, ROSEBROUGH N J, RANDALL R J. Protein measurement with Folin phenol reagent[J]. Jounal of Biological Chemistry,1951, 193:256-275.
[14] 高雯, 姜培荣, 张之佳, 等. 食品酶学原理与分析方法[M]. 哈尔滨:黑龙江科学技术出版社, 1991.
[15] CHAIJAN M, PANPIPAT W, BENJAKUL S. Physicochemical properties and gel-forming ability of surimi from three species of mackerel caught in Southern Thailand[J]. Food Chemistry, 2010, 121:85-92.
[16] PARK S, CHO S, YOSHIKA T, et al. Influence of endogenous protease and transglutaminase on thermal gelation of salted squid muscle paste[J]. Journal of Food Science, 2003, 68(8):2473-2478.
[17] BENJAKUL S, VISESSANGUAN W, TUEKSUBAN J, et al. Effect of some protein additives on proteolysis and gel-forming ability of lizardfish(Saurida tumbil)[J]. Food Hydrocolloids, 2004, 18:395-401.
[18] RAWDKUEN S, BENJAKUL S, VISESSANGUAN W, et al. Effect of cysteine proteinase inhibitor containing fraction from chicken plasma on autolysis and gelation of Pacific whiting surimi[J]. Food Hydrocolloids,2007, 21(7):1209-1216.
[19] LANIER T C. Functional properties of surimi[J]. Food Technology,1986, 40(3):107-112.
[20] LIU T M, LIN T S, LANIER T C. Thermal denaturation and aggregation of actomyosin fromAtlantic croaker[J]. Journal of Food Science,1982, 47:1916-1919.
[21] SHIKHA F H, HOSSAIN M I, MORIOKA K, et al. Effect of pH-shifting on the gel forming characteristics of salt-ground meat from walleye pollack[J]. Fisheries Science, 2006, 72:870-876.
[22] TOYOHArah, SASAKI K, KINOSHITA M, et al. Detection of inhibitor for mordori inducing proteinase in fish and calf serums[J]. Nippon Suisan Gakkishi, 1991, 57(3):521-525.
Effect of Rinsing Mode on Modori of Silver Carp Surimi
LIU Ru1,2,QIAN Man1,2,LEI Yue-lei1,2,XIONG Shan-bai1,2,*
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;2. The Sub Centre (Wuhan) of National Technology and R&D of Staple Freshwater Fish Processing, Wuhan 430070, China)
TS254.4
A
1002-6630(2010)21-0089-05
2010-07-02
国家现代农业产业技术体系建设专项(nycytx-49-23);华中农业大学青年教师科技创新专项(52204-10024);华中农业大学人才科研启动项目(52204-08075)
刘茹(1982—),女,讲师,博士,研究方向为水产品加工与贮藏。E-mail:liuru@mail.hzau.edu.cn
*通信作者:熊善柏(1963—),男,教授,硕士,研究方向为水产品加工与贮藏。E-mail:xiongsb@mail.hzau.edu.cn
