膜技术在乳品工业中的应用
2010-10-19董晶莹JeanLouisMaubois
马 莺,董晶莹,Jean-Louis Maubois
(1.哈尔滨工业大学食品科学与工程学院,黑龙江 哈尔滨 150090;2.北京三元食品股份有限公司技术中心,北京100085;3.法国农科院,法国 布列塔尼大区 雷恩 35042)
膜技术在乳品工业中的应用
马 莺1,董晶莹2,Jean-Louis Maubois3
(1.哈尔滨工业大学食品科学与工程学院,黑龙江 哈尔滨 150090;2.北京三元食品股份有限公司技术中心,北京100085;3.法国农科院,法国 布列塔尼大区 雷恩 35042)
综述膜的设计及结构,以及膜技术在乳品工业中应用的研究进展。随着膜技术的发展以及人们对乳成分知识的深入了解,膜技术在液态乳的除菌、乳蛋白的分离、干酪的加工、乳清的处理、初乳的处理,乃至干酪盐水及废水处理与纯化等方面的应用日益广泛。膜技术将为提高乳制品质量、新产品开发、提高生产效率及增加产品利润提供新的途径,成为在不破坏乳成分的前提下保证乳制品安全的强有力的加工手段。
膜技术;液态乳;乳蛋白;干酪;乳清;初乳;盐水;
Abstract:In this paper, membrane design and configuration, and the applications of membrane technology in dairy industry have been reviewed. Due to the development of membrane technology and clear analysis of milk compositions, membrane technology exhibits an extensive application in dairy industry including the sterilization of liquid milk, separation of milk proteins, production of cheese, preparation of whey and colostrum, and purification of waste water. Membrane technology will provide a new strategy to improve product quality, accelerate product development, increase productivity and earn more profit for diary products.
Key words:membrane technology;liquid milk;milk protein;cheese;whey;colostrum;brine
1963年Loeb等[1]采用反渗透膜(醋酸纤维素材料的各向异性膜)实现了海水的脱盐,自此,膜技术分离分子或粒子的研究得到了长足的发展,逐渐实现了工业化的应用,其中包括根据孔径分离的反渗透技术、纳滤技术、超滤技术与微滤技术,根据电荷不同分离的电渗析技术以及根据化学电势不同分离的渗透汽化膜技术。
膜技术(微滤、超滤、纳滤及反渗透技术)在食品工业中应用最为广泛的领域是乳品工业(截止至2007年膜面积已经超过500000m2[2])。随着对乳及乳清化学特性了解的加深,人们不断优化分离条件,避免分离过程不可逆变化的发生;同时随着对丢弃乳清造成环境污染认识的不断加深,膜技术在此领域的应用日益广泛,乳品加工厂的膜设备已经和奶油分离机一样普遍。
不同膜分离技术的定义如下:微滤(MF):孔径大于0.1μm的多孔膜在压力驱动下的分离过程,能够实现体细胞、脂肪球、微生物及酪蛋白的截留;超滤(UF):孔径在0.001~0.1μm(很多情况下也以截留分子质量表示,kD)的多孔膜在压力驱动下的分离过程,能够实现乳糖、可溶性矿物质、小分子及水分的透过;纳滤(NF):孔径小于0.001μm(1nm)的多孔膜在压力驱动下的分离过程,能够实现一价可溶性矿物质及水分的透过;反渗透(RO):压力驱动下的非多孔膜过滤过程,能够实现水分的透过,达到浓缩的目的;电渗析(ED):电场下根据电荷不同进行膜分离的过程。随着膜技术的发展及人们对乳品知识了解的深入,膜技术在乳品工业中的应用日益广泛。
1 膜设计及膜结构
乳品工业中广泛应用的膜组件按照结构分为4种:1) 管式膜;2) 中空纤维膜;3)平板膜;4)螺旋卷式膜。Mistry等[3]详细综述了每种膜结构的优缺点。乳品工业中应用最为广泛的是螺旋卷式膜(UF、NF及RO)和管式膜(MF)。
螺旋卷式膜多为聚砜材料,价格低廉,耐受pH值为1~12,清洗阶段可耐受氯为200mg/L,短期贮存耐受氯为50mg/L,耐受温度小于80℃,高浓缩倍数时的清洗消毒较为困难[4]。与之相比,管式膜(尤其是陶瓷材料,氧化锌、氧化钛或者两者的混合物固定于铝基支撑层)耐受pH值范围较广(1~14),耐受温度高达350℃,耐受氯高达2000mg/L,但是价格相对昂贵。聚砜膜的寿命为6~18个月,陶瓷膜的寿命可以长达14年[4]。
膜材决定了膜(微滤、超滤及纳滤)的理化特性及机械特性,料液中溶质的孔径决定了膜的选择。但是想要测定乳品工业中孔径特性却是件比较困难的事情,除了“Nuclepore”微滤膜[5]是孔径理想的过滤装置外,其他过滤装置的孔径或多或少的存在高斯分布。微滤膜的孔径多以“μm”表示,通过至少两个膜层沉积于支撑层来改善过滤的效果。超滤及纳滤膜多以截留分子质量来表示,标准操作条件下截留分子质量90%的物质能够实现有效的截留[4]。
乳品工业对膜的清洗消毒用水要求较高(为通过0.2μm孔径的软质水,细菌总数小于1/100mL)[6],一般情况下,连续工作10h后需要对膜设备进行清洗消毒,步骤如下:1)物料处理温度下进行清水的清洗;2)高于60℃的温度下使用碱液清洗20min;3)50~60℃热水清洗;4)20~50℃的硝酸清洗15min(磷酸会导致不溶性钙盐的沉淀);5)50~60℃热水清洗;6)每周至少用次氯酸钠(100~200mg/L活性氯)或者过氧乙酸在20℃条件下清洗20min;7)清水润洗;根据膜材的不同,最后清洗液的pH值对水通量及过滤效能有着显著地影响,例如,聚合膜必需用碱,无机膜必需用酸[6-7]。事实上,当物料与膜相接触时,最初较低的水通量更容易增加浓差极化的发生。
2 膜技术在液态乳中的应用
乳的杀菌可以通过不同时间不同杀菌温度来实现:比巴氏杀菌更为温和的杀菌方法、巴氏杀菌及超高温杀菌。虽然它们保证了乳及乳制品的安全,但是对乳中的某些成分也带来了不可逆转的变化,例如,破坏钙盐与蛋白质的平衡,降低乳制品的感官质量,降低干酪的产量等。而且,乳中还存在某些耐热的酶类,随着耐热微生物的生长其对乳品货架期的影响也是不容忽视的。
1984年Holm等[8]提出微滤技术是替代热处理的良好方式,利乐公司由此发明了“B a c to c a tc h”技术。Saboya等[6]综合瑞士和法国的诸多研究,对过滤参数进行了优化,50℃的脱脂乳以7.2m/s的流速通过1.4μm的微滤膜(SteriloxⓇ或者equivalent),均一跨膜压力为0.5Bar,透过液循环通过微滤膜[9]。其中,通过支撑层孔径的变化实现均一跨膜压力的称为Membralox GPⓇ膜,通过膜层厚度的变化来实现均一跨膜压力的称为Isoflux膜。截留液浓缩20倍时,几乎所有的体细胞、脂肪及微生物都能够实现有效的截留。工业化生产中将浓缩20倍后的截留液于二级微滤设备再次浓缩10倍,即浓缩因子为200。该操作10h的渗透通量可以达到500L/(h·m2)。浓缩20倍和200倍时透过液的蛋白质可以分别占原料液蛋白质的99.0%和99.4%,总固形物可以分别占原料液总固形物的99.5%和99.9%。原料脱脂乳的微生物数量小于200000CFU/mL时,微生物可以下降3.5个数量级,如果原料乳的质量较差,则下降的数量级甚至高于6.0个数量级。而能够耐受巴氏杀菌的孢子形成菌的细胞体积相对较大,其截留效果可以大于4.5个数量级[10]。Madec等[11]综述了巴斯德研究所及法国农业科学院的研究结果,微滤处理可以使得李斯特单杆菌、流产布鲁氏杆菌、伤寒沙门氏菌及结合杆菌分别下降3.4、4.0、3.5个及3.7个数量级。脱脂乳经过1.4μm微滤处理后致病菌的数量小于1CFU/L[6],因此,其与巴氏杀菌乳一样安全。
法国是唯一一个允许出售长货架期(extended shelf life,ESL)微滤原料乳的国家。微滤后的脱脂乳与热处理的稀奶油(95℃,20s)混合进行脂肪的标准化,然后均质灌装,即名为“MargueriteⓇ”的乳制品,在4~6℃贮藏条件下其货架期可以达到3周,2008年的产量达到了10000000L。而其他国家混合均质后进行高温短时杀菌(72℃,20s)货架期能够达到5周[12]。微滤处理取得商业化成功的原因在于产品风味(没有蒸煮味道)及贮藏期的优势[12]。有些乳品企业也将1.4μm微滤处理的乳用于生产UHT乳,降低其热处理强度(140℃,4s或者更低),充分体现其在风味及贮藏期(死菌及体细胞)方面的优势。
Lindquist[13]提出选择0.8μm而不是1.4μm的微滤膜进行除菌,其在瑞士、法国及加拿大都进行了研究,50℃条件下的通量可以达到400L/(h·m2),肉毒梭菌下降13个数量级,微滤透过液与稀奶油(142℃,4s)混合,80℃均质,95℃、6s失活内源酶类,20℃条件下无菌灌装,该“UltimaⓇ”乳产品被利乐公司称为商业无菌[14]。事实上,该产品40℃条件下的货架期能够达到62d,室温下的货架期能够达到8个月,感官质量与高温短时巴氏杀菌乳相当,但是其乳果糖含量降低了71%。但是不知道什么原因,利乐公司并没有将该专利技术用于商业化生产,而许多乳品企业采用1.4μm的微滤技术生产微滤巴氏杀菌乳,大大提高了货架期。
原料乳的成分因奶牛品种、饲喂条件、季节及泌乳期等的变化而有所差异,许多年来脂肪的标准化已经被接受并立法,而蛋白质的标准化则不然(蛋白质含量对乳品加工者而言也是重要的指标),虽然有采用乳清粉或者脱脂粉标准化蛋白质的应用,但是尚未有国家作出相应的规定,Maubois[14]综述了蛋白质标准化过程中遇到的问题。而超滤技术为乳成分的标准化提供了新的途径与方法。
体细胞含有蛋白酶、酯酶及过氧化氢酶等耐热酶类,其粒径为6~15μm,这些酶类对机械处理非常的敏感,释放于乳中对乳制品(巴氏杀菌乳及UHT乳)的质量造成负面的影响。有报道称,热处理过程中这些酶类也能够保护李斯特单杆菌,乳粒细胞中含有疯牛病朊病毒,这在牛乳及初乳中都到了证实[15]。5~12μm的微滤膜都能够特异性的去除乳中的体细胞,运行8h的通量为1490~2000L/(h·m2)[16-17]。截留液中包含了原料乳93%~100%的体细胞,体积占原料乳的4%~5%。透过液中的脂肪含量分别为89%和83%。如果截留液中的朊病毒得到了证实,也为相应的科学研究提供了便利(现在的研究多以乳房炎乳为研究对象,其乳成分也必然发生了一定的变化)。研究表明[18],采用反渗透或者纳滤技术生产的酸奶制品,其质构与风味都要优于添加乳粉生产的制品。其中的原因可能是:乳粉是引起美拉德反应的主要原因,即便高质量的乳粉也或多或少的存在一些不溶性颗粒,与此同时,纳滤去除了一些一价的离子(Na+及Cl-),而消费者对这些粒子是不欢迎的。
3 膜技术在乳蛋白分离中的应用
膜技术在蛋白质分离方面的应用最为广泛,在蛋白质的功能特性(溶解性、乳化性、搅打性、起泡性、持水性、黏度)、营养特性(对人体有益的氨基酸及生物活性肽)等方面均取得了一定的经济效益[19-20]。初始只是使用膜技术分离纯化蛋白质,但是现在已经将膜技术与色谱等技术相结合对乳中主要的蛋白质及微量的蛋白质进行分离。其工业化生产过程的迅速发展源于对乳品生化知识的深入了解。
应用超滤及微滤技术,截留液中的蛋白质占总固形物的含量可以达到50%~90%,该浓缩蛋白可以用于肉品工业、发酵乳制品、干酪加工及乳粉的加工等[21]。超滤过程的温度通常为50~55℃,该温度下超滤截留液的黏度较低,微生物生长速度最低。为了避免乳浓缩蛋白所带来的蛋白降解过度(超滤过程增加了微生物的数量),可以采用1.4μm的微滤技术事先对乳中的微生物进行除菌,该方法也能降低喷雾干燥的强度。微滤处理同时也能够降低超滤过程脂肪的浓缩,延长蛋白粉的保质期。高纯度浓缩蛋白的复水像纯化的酪蛋白一样,需要较高的温度(50℃)及较快的搅拌速度[22]。
截留液稀释后再次通过膜过滤,称为渗滤。0.1μm的微滤技术结合反渗透水的渗滤技术[23],经喷雾干燥后可以制备酪蛋白[23]。37℃或者50℃浓缩3倍处理可以避免免疫球蛋白或者β-乳球蛋白的变性,其渗透通量可以分别达到42L/(h·m2)和75L/(h·m2)。然后用4倍体积的反渗透水渗滤并将其浓缩6倍。该酪蛋白粉能够替代食品工业中使用的酪朊酸钠。其在保存马精液方面也有着特定的效果[24],稀释液被称作“INRA 96Ⓡ”。同时也为酪蛋白的相关研究提供了较好的原料,例如:低温下β-乳球蛋白的特性、生物活性肽或κ-酪蛋白的C端、糖巨肽的生物活性[25]、肠促胰酶肽(CCK)[26]及其对人体的调节作用[27]。
4 膜技术在干酪加工中的应用
与液态乳的处理相同,1.4μm的微滤除菌技术也可以用于控制干酪用乳的微生物质量。如果采用35~37℃的微滤技术除菌,生产的干酪则存在“原产地保护命名”(质量或者特性完全或者基本上与地域紧密联系,包括自然条件或者加工方法)的问题。由上述内容可以看出,从安全角度而言,经1.4μm微滤处理的脱脂乳与巴氏杀菌稀奶油混合后得到的牛乳,至少与牛乳直接进行巴氏杀菌一样安全。
另一方面,1.4μm或者0.8μm微滤乳为干酪研究者探讨酸化剂(外加发酵剂)、成熟体系(非发酵剂乳酸菌、酵母、霉菌、丙酸菌等)对蛋白降解、脂肪分解、风味物质的生物基因及代谢等提供了便利条件[28-31]。例如,蜂窝哈福尼亚菌对Camembert干酪含硫芳香成分(甲硫醇及其衍生物)的影响;酵母对Cantal干酪风味代谢的影响[32]。最近的研究表明,干酪用乳中的酪乳杆菌、植物乳杆菌、弯曲乳杆菌、短乳杆菌及发酵乳杆菌等非发酵剂乳酸菌的加入对Cheddar及Emmental干酪成熟期的风味没有积极的作用[33]。
超滤技术广泛应用于干酪加工过程中蛋白质的标准化。干酪加工厂的膜分离设备和奶油分离机一样的司空见惯。乳蛋白的标准化已经从单纯弥补泌乳期、饲喂等原因带来的乳成分差异发展到使其标准化至蛋白质与脂肪含量与干酪凝块相当的阶段,Maubois等[34]将其称为干酪前体。该MMV(maubois mocquot vassal)超滤过程已经将蛋白质和脂肪转化成干酪的传统过程变成凝块和乳清转化成干酪的过程。尽管其在增加干酪产量(20%)、提高生产效力(连续化生产及新品种开发)、增加产品均一性、降低凝乳酶用量(80%)等方面的优势十分的明显,但是因其是全新的干酪加工技术,十年的时间才实现大规模的工业化生产。0.1μm微滤技术是干酪加工中新型的加工技术,其在干酪加工之前将酪蛋白分开,实现了乳成分的有效利用[18],也由此开发出了许多干酪新品种。
虽然反渗透及纳滤技术均能够对干酪用乳进行固形物的浓缩[35],但是由于乳糖含量较高(成熟过程中的后酸化)、矿物质含量较高(砂质质地),并且感官质量不高及损失在乳清中的脂肪较多[3]等原因,反渗透及纳滤技术在干酪加工中没有得到广泛的应用。
超滤技术和0.1μm微滤技术生产干酪由于对蛋白质成分的不同截留而对成品干酪的品质有着不同的影响,两种方法各有利弊。
4.1 缓冲能力
pH6.6~6.8时的超滤或者0.1μm微滤,与酪蛋白结合的磷酸钙盐也以相同的比例浓缩,因此截留液的缓冲能力增加,干酪加工工艺参数也有所变化:乳酸菌的酸化动力学特性、最终pH值、酶凝乳动力学特性、凝块的流变学特性、中温菌的自溶作用[36-37]、酶活力、存活腐败菌的生长速率,甚至持水能力等[3]。干酪用乳的浓缩因子(料液的体积与截留液的体积之比)越高,凝块达到最佳pH值(半硬质及硬质干酪的pH值为5.2,软质及新鲜干酪的pH值为4.6)所需要的乳酸菌越多。对软质及新鲜干酪而言,乳酸菌的需要量为QL=4.4VCF+1.5,式中VCF为浓缩因子,QL为每千克 pH6.7的截留液所需要的乳酸菌的质量[38];对多数干酪品种而言,截留液为pH6.7,但不调节加工参数生产干酪会导致成品的质构及风味产生一定缺陷[3]。调节钙盐在酪蛋白相及液相的分布情况,可以避免由此带来的缺陷[3,38]。例如,生产Quarg干酪、稀奶油干酪、法国Fromages frais干酪等无需成熟的新鲜干酪时,需要预酸化后再与稀奶油混合,使其剪切力最小[39]。MMV过程生产软质干酪则要在凝乳前加入0.8%的氯化钠,使其凝乳pH值达到5.4~5.2,降低酪蛋白磷酸丝氨酸残基的离子化程度,增加凝块中可溶性钙的含量,从而利于干酪的质量控制。Dong等[40]研究认为0.1μm微滤浓缩2.3倍生产Mozzarella干酪时调节钙盐的浓度即可获得拉伸性和融化性均较佳的干酪。
4.2 流变学变化
乳是一种牛顿流体,其黏度不受剪切应力的影响。反之,0.1μm微滤浓缩酪蛋白或者超滤浓缩蛋白使其黏度随着蛋白质含量的增加呈现对数增加趋势,表现出假塑性流体特性[41],而这些都是选择膜组件(膜长、跨膜压力、膜孔径、循环泵、阀门、弯头等)及操作参数时需要考虑的问题。高浓缩因子的超滤截留液黏度较高,因此需要特定的真空设备排气以避免凝块呈现出海绵状,需要特定的混合装置将发酵剂与凝乳酶混入[42]。超滤前将原料乳酸化至pH4.6以生产Quarg、French Fromages frais及稀奶油干酪,这些产品对机械处理更加的敏感,因此需要加工者对超滤设备的性能有更为全面和深刻的认识[42]。超滤截留液蛋白质含量低于7.3%时,对成品干酪没有负面影响,但是当蛋白质的含量高于7.3%时,需要加配容积式泵。
4.3 对酶凝乳的影响
Maubois等[43]、Garnot等[44]均报道超滤或者 0.1μm微滤截留液生产干酪都能够节约凝乳酶的用量,且凝乳酶的用量与浓缩的倍数负相关。随着干酪用乳蛋白质含量的增加,酶反应速度增加,凝胶阶段的蛋白降解程度降低。pH6.6的原料乳中如果有80%~90%的酪蛋白巨肽(κ-CMP)释放即可发生凝乳,但是浓缩因子为4的超滤截留液有50%的κ-CMP释放即可发生凝乳[45],这是由于聚合速率直线增加的缘故[46]。与此同时,热处理对酶凝乳是不利的,β-乳球蛋白与κ-酪蛋白共价结合增加了酪蛋白的电负性[47],凝乳酶对UHT乳的κ-酪蛋白几乎不能发生作用。但是,UHT处理之前或者之后进行超滤处理仍然能够发生凝乳作用[48]。Ferron-Baumy等[49]认为这是由于超滤处理减小了酪蛋白与β-乳球蛋白之间的距离,负电荷之间存在屏蔽作用,酪蛋白的zeta电势较低。
4.4 干酪用乳成分的调节
无论是0.1μm的微滤技术,还是超滤技术,都可以通过渗滤技术调整干酪用乳的成分。加水稀释(乳糖、可溶性矿物质)原来只应用于半硬质干酪的生产,现在在一些干酪新品中也有使用,这就为研究盐类(NaCl、MgCl2、MnCl2、柠檬酸盐、乳酸盐)及糖类(葡萄糖)对干酪体系中乳酸菌等“原位”代谢的作用,酸对钙盐溶解性及对氧化还原电势(抗坏血酸)的影响作用提供了新的途径。牛乳中乳酸的含量比较低,向干酪中添加α-酮戊二酸(0.9~3.6mg/g)有助于增加双乙酰及醋酸的生物合成,促进氨基酸代谢为芳香成分,对风味的形成是有益的[50]。另外,也有报道说增加盐的浓度能够降低疏水性肽的产生,因此减少苦味的产生[51]。乳酸菌胞外多糖结合水的特性使得干酪液相中可溶性成分增加,自然该部分的盐浓度也增加,苦味减少。
4.5 膜技术生产干酪
现在许多干酪品种都是采用超滤及微滤等膜过滤法生产的,尤其根据消费者的口味和质构要求生产新鲜干酪,改善添加乳粉给干酪带来的缺陷。超滤技术生产Quarg干酪、Cream干酪、Mascarpone干酪及Fromages frais干酪已经替代了原来的过滤分离技术[3]。
Hannon等[37]报道,与传统方法生产的干酪相比,超滤浓缩乳生产的干酪中中温菌的降解作用降低。而Creamer等[52]认为嗜热乳酸菌加工的干酪不存在这种情况,Lawrence[53]研究表明,超滤过程截留了乳清蛋白,抑制了凝乳酶的蛋白降解活性。而实际上,即便是0.1μm的微滤(乳清蛋白含量与传统的加工方法相接近),较高的钙盐含量使其缓冲能力较大,也会抑制乳球菌的分解能力。
畜牧业管理条件、气候条件、饲喂方式、产犊时间等不同都会引起乳成分的变化,而干酪又是对乳质量要求较高的乳制品,20世纪80年代人们将超滤截留液进行冷冻储藏以避免氧化味及牛油味[54],一般来讲,每块(25、50kg或100kg)于-20℃迅速冷冻,可以保藏几个月的时间,当然,迅速冷冻的同时也必然要求迅速解冻,这种方法生产的干酪与一般的超滤截留液生产的干酪的相比,未见品质缺陷。许多奶源不甚充足的国家都会进口乳粉以备不时之需。乳粉加工过程中的高热处理对干酪的产量及品质是不利的,而超滤处理热处理过的牛乳却能够提高干酪产量及干酪的感官品质。另外,高热乳粉凝乳能力较差的原因是β-乳球蛋白与κ-酪蛋白发生了共价结合作用,0.1μm微滤处理去除乳清蛋白之后进行喷雾干燥得到的蛋白粉与原料乳的酪蛋白组成相近,再重新与稀奶油进行复配,可以生产一系列的干酪制品[55-56]。
5 膜技术在乳清处理中的应用
乳清是干酪加工及酪蛋白加工过程的副产物,乳清的成分因干酪的品种及加工过程的不同有所差异,但是一般来说,乳中90%~95%的酪蛋白及脂肪回收于干酪中,乳清中含有诸多高营养价值的成分(蛋白质、乳糖、微量活性蛋白、生长因子等)。乳清根据pH值的不同分为甜乳清(pH>6.4)和酸乳清(pH4.6~6.4)两种,直到19世纪60年代末期,乳清还只是作为动物饲料或者以废物的形式排除,而乳清的五日生化需氧量(BOD5)值为30~50g/L,1000L乳清所带来的污染问题与400个人产生的生活废物相当[57]。
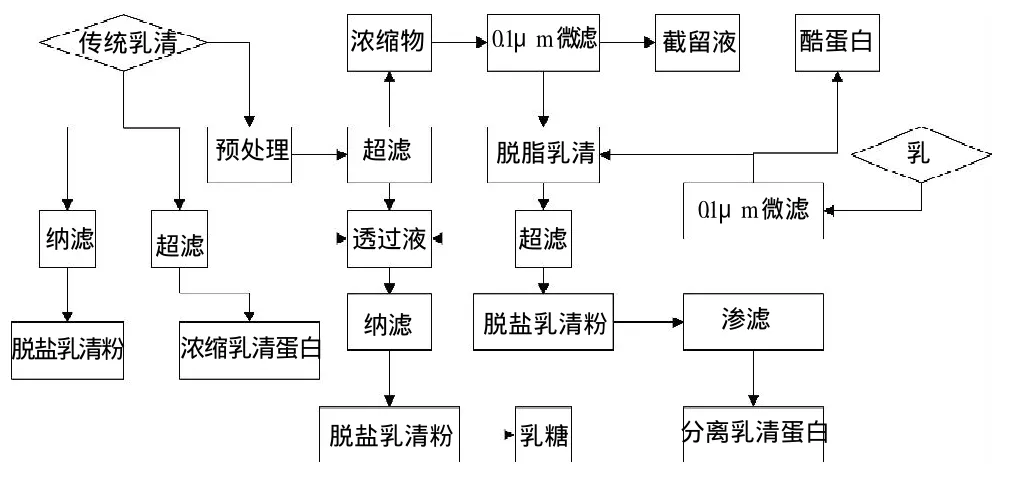
图1 膜技术在乳清分离中的应用Fig.1 Applications of membrane technology in whey separation
随着膜技术的发展,乳清的分离及相关的生物技术也得到了前所未有的发展(图1),0.1μm微滤分离的截留液可以用于干酪的生产,透过液无菌[58]、无脂、无κ-GMP、未经加热处理,为“理想乳清”[59]。再经超滤及渗滤可以生产乳清浓缩蛋白(WPC)或者乳清分离蛋白(WPI),其中的蛋白质含量与总固形物含量的比值可以达到0.77%~0.95%[18],其营养价值与功能特性均高于传统乳清生产的乳清浓缩蛋白(WPC)或者乳清分离蛋白(WPI)[60]。
前面提到的乳清处理开辟了膜技术在乳品工业中应用的先河,反渗透技术与真空蒸发技术相比,节约了大量的能源,前者每除去一吨水分耗能9kWh,而后者需要耗能90~1509kWh[61]。而现在多采用纳滤技术替代反渗透技术处理甜乳清,纳滤技术对物料进行浓缩的同时(固形物含量为22%~25%)实现了脱盐(25%~50%的矿物质),能耗更低、废液更少、解决了乳糖结晶的问题。酸乳清由于矿物质含量较高而不适合作为饲料,污染问题更为凸显,而纳滤处理酸乳清取得了较好的效果。
超滤技术广泛应用于乳清浓缩蛋白系列产品的生产(蛋白质/总固形物为35%~80%)[62]271-316,相关产品的生产[62]195-230及特性研究颇多[62]231-270。总之,热处理对乳清蛋白的热敏感性的影响;嗜冷菌及中温菌释放的蛋白降解酶增加了蛋白降解程度,增加了非蛋白氮含量;超滤过程中乳清被浓缩30~50倍的同时,微生物也以相应的比例增加;酪蛋白及脂肪要充分去除等因素都需要考虑。但尚未见体细胞数对乳清影响的相关报道,尽管干酪加工过程中15%的体细胞进入乳清,但是超滤过程中体细胞也增加30~50倍,达到1.5×106~3×106cells/mL甚至更多。乳清超滤的最佳温度为50℃,流量较大,蛋白的变性程度最低。但是多数加工厂选择更低的超滤温度(10~12℃),通量只有50℃时的一半左右[63],为的只是限制螺旋卷式膜耐热微生物的生长,增加钙盐的溶解度,降低膜污染程度。乳清蛋白中的脂肪对其功能性质(乳化性、起泡性及凝胶性)、超滤通量及风味起着负面的作用[64],为此,Maubois[65]及Pearce[66]提出了热钙聚合方法。即超滤浓缩4~5倍的乳清截留液加入NaOH调节pH值为7.5,55℃保温8min,0.1μm微滤分离脂蛋白-钙、脂肪及微生物,无脂的透过液再经过超滤(<5000D),其运行时间缩短,通量增加两倍,α-乳白蛋白的损失减小。超滤后的渗滤操作很容易得到蛋白质/总固形物为80%的乳清分离蛋白,其起泡性及凝胶性较佳,尽管与0.1μm得到的理想乳清得到的乳清分离蛋白相比稍差一些。例如,10%的乳清分离蛋白溶液即可替代鸡蛋蛋白生产蛋白酥皮,其延展性及稳定性相当。Maubois[65]及Pearce[66]指出,脱脂乳清分离蛋白是纯化β-乳球蛋白及α-乳白蛋白较佳的原料,α-乳白蛋白在pH3.8(盐酸或者柠檬酸)55℃处理30min条件下即可分离。工业化生产的α-乳白蛋白纯度只有70%~75%(变性的免疫球蛋白、β-乳球蛋白及血清白蛋白),生产更高纯度的β-乳球蛋白还存在一定的困难[67]。而α-乳白蛋白在保健(色氨酸含量较高)及医疗方面[68]的生物作用不断得到认识,未来蛋白结构及构象的研究有待深入。另外,微滤截留液中丰富的磷脂(150g/1000L)也是食品工业中较佳的原料[69]。而乳清的超滤透过液可以作为动物饲料或者脱盐后生产乳糖。有些国家,也用超滤乳清的透过液进行酵母发酵生产乙醇,作为饮料或者燃料的原料[70]。
纳滤具有脱盐(Na+、K+、H+及Cl-等一价离子)及浓缩两种功能,超滤透过液经纳滤其脱盐效果可以达到35%,如果附加渗滤则可以达到42%,其优势在于:固形物达到62%(纳滤除去了75%的水分)降低了成本;减少了蒸发器的沉积;简化了乳糖的结晶过程;纳滤也是解决甜乳清及酸乳清处理较为理想的方法[71]。纳滤后进行喷雾干燥运行参数较佳,产品的吸湿性降低了3倍[72]。
6 膜技术在初乳处理中的应用
0.1 μm的微滤技术为改善初乳(动物分娩后的第一次泌乳)的微生物质量提供了完美的方法。该过程得到的透过液“serocolostrum”清澈、透明、无菌。初乳的透过液比牛乳或者干酪乳清的成分更为丰富,再进行超滤可以浓缩免疫球蛋白、生长因子、乳铁蛋白等成分,这些成分促进了后代免疫调节功能(仔猪、马驹、犊牛、羔羊及儿童),因此,其纯化的形式可以制成兽药或者人药。最近通过100人的临床实验表明:初乳中的colostrinin(富含脯氨酸的多肽)能够预防阿尔茨海默病[73]。Toba等[74]研究认为初乳中碱性蛋白的含量较高,它能够调节造骨细胞及成骨细胞的生长,预防骨质疏松。一旦这些生物活性成分的作用得到确凿的证实,“serocolostrum”必将得到迅速发展。
7 膜技术在盐水纯化中的应用
尽管人们不断采取措施减少废水的排放量,乳品工业仍然是排污大户(每处理1L牛乳排出1~5L废水),而膜技术对减少废水排放量及废水的处理方面有着积极的作用。采用反渗透技术或者纳滤与反渗透技术结合的手段可将其排放量减少20倍[75]。得到的透过液可用于加热料液、清洗或者蒸汽源。各种不同pH值的废水都可以应用膜技术进行处理,甚至应用于原位清洗中。Daufin等[75]报道说1000L的工业废水(pH6.5~9.0,固形物含量为0.8 g/L)的BOD5为2.0g/kg,膜处理后得到的950L透过液不含固形物,其BOD5仅为处理前的1/100。而50L截留液(固形物含量为30g/kg,BOD5为20g/kg)可进一步净化处理[76-77]。陶瓷膜材料的微滤、超滤及纳滤设备能够耐受所有的pH值范围,而有机膜能够耐受较高的pH值,因此可以用于原位清洗过程中的酸碱清洗。清洗效率的提高和污染程度的降低可在1.5~5.3年内将膜设备的成本收回[75]。
保证干酪盐水的清洁卫生对防止干酪后污染是至关重要的,诸如金黄色葡萄球菌、李斯特单杆菌、酵母及霉菌等即便是在20%的盐含量下也能够生长。0.1μm或者0.8μm的微滤处理是替代巴氏杀菌及硅藻土过滤的有效方法,能使微生物失活的同时也改变了蛋白质与矿物盐的平衡[78]。该操作在浓缩因子30~100,20℃(避免钙盐的沉淀)条件下透过液的通量为600L/(h·m2),当然可以每日处理盐水或者攒起来一起处理。
8 结 语
膜技术为提高乳制品质量、新产品开发、提高生产效率及增加产品利润提供了新的途径,成为在不破坏乳成分的前提下保证乳制品安全的强有力的加工手段。微滤除体细胞技术为乳品研究者研究体细胞耐热内源酶类对乳制品的影响提供了途径,为发酵乳制品(尤其是干酪)成熟期间代谢机制的深入研究提供了便利。膜技术分离乳成分得到了较快的发展,0.1μm微滤分离酪蛋白、乳蛋白的纯化等都已经实现了工业化生产,但是膜技术分离大小脂肪球还没有实现工业化生产[79]。膜技术处理稀奶油中的细菌还存在一定的技术问题,很长一段时间人们还是会使用稀奶油预处理的方式。膜技术(微滤、超滤、纳滤及反渗透)与色谱等技术的结合使用为蛋白质纯化技术的发展开辟了新的途径。营养学与医学学科的交叉,使得乳品加工者纯化了乳中的生物活性成分从而为人类的保健创造新的条件。功能性成分的功能特性通常是在较高的纯度下被予以研究和证实,但是不得不考虑实际的工业化生产和市售时是否达到或者是否需要如此的纯度,毕竟这和医药还是有一定差别的。同时,酶(微生物)膜反应器还没有得到普及,毕竟这需要对酶膜反应技术及过程产物都有较为深刻的认识。随着膜发酵技术的发展,连续化生产是必定会实现的。
目前,膜技术已经得到了广泛的应用,在改善乳制品质量、开发新产品、满足消费者需求等方面都起到了积极的作用。
[1] LOEB S, SOURIRAJAN S. Advanced in Chemistry[M]. Calif:American Chemistry Society, 1963:117-132.
[3] MISTRY V V, MAUBOIS J L. Application of membrane separation technology to cheese production[M]//FOX P F. Cheese:chemistry,physics and microbiology. Amsterdam:Elesier, 2004:261-285.
[4] CHERYAN M. Ultrafiltration and microfiltration handbook[M]. Lancaster:CRC Press, 1998:69-71.
[5] PORTER M C. Handbook of industrial membrane technology[M]. Noyes:William Andrew, 1990:92-95.
[6] SABOYA L V, MAUBOIS J L. Currents developments of microfiltration technology in the dairy industry[J]. Lait, 2000, 80:541-553.
[7] BRAGULLA S, LINTNER K. Basic of cleaning and disinfection for UF,reverse osmosis and electrodialysis plants[J]. Alimenta, 1986, 5:111-116.
[8] HOLM S, MALMBERG R, SVENSSON K. Methodand and plant for producing milk with a low bacteria content:World international patent organization, 001687[P]. 1986-03-27.
[9] MEERSHON M. Nitrate free cheesemaking with Bactocatch[J]. North European Food Dairy Journal, 1989, 55:108-113.
[11] MADEC M N, MEJEAN S, MAUBOIS J L. Retention ofListeriaandSalmonellacells contaminating skim milk by tangential membrane microfiltration ("Bactocatch" process)[J]. Lait, 1992, 72:327-332.
[12] EINO M F. Lessons learned in commercialization of microfiltered milk[J]. Bulletin of the International Dairy Federation, 1997, 320:32-36.
[13] LINDQUIST A. A method for the production of sterile skimmed milk:World international patent organization, 057549[P].1998-06-15.
[14] MAUBOIS J L. Applications of membrane techniques in the dairy industry-proposals for a new IDF group of experts[J]. IDF Bulletin,1989, 244:26-29.
[15] MAUBOIS J L, SCHUCK P. Membrane technologies for the fractionation of dairy components[J]. IDF Bulletin, 2005, 400:2-7.
[16] le SQUEREN J C, CANTERI G.les cellules somatiques des milieux alimentaires ou biologiques et produits correspondants:France, 2731587[P]. 1995-06-12.
[17] MAUBOIS J L, FAUQUANT J, FAMELART M H, et al. Milk microfiltrate, a convenient starting material for fractionation of whey proteins and derivatives. The importance of whey and whey components in food and in nutrition[C]//Proceedings of the 3rd International whey conference. Munich:3rd International whey conference, 2001:59-72.
[18] TAMIME A, ROBINSON R. Yoghurt:science and technology[M]. New York:Pergamon Press, 1985:28.
[19] MAUBOIS J L, OLLIVIER G. Extraction of milk proteins in food proteins and their applications[M]. New York:M. Dekker, 1997:579-595.
[20] MAUBOIS J L.du lait,de toujours,det lactopeptides P[M]. Paris:INRA, 2002:11-16.
[21] NOVAK A. Milk protein concentrate in new applications of membrane processes[C]//IDF Special Issue, Belgium:IDF Conferrence, 1992:51-66.
[22] SCHUCK P, PIOT M, MEJEAN S, et al.des laits enrichis enmicellaire par microfiltration; comparaison des propriétés des poudres obtenues avec celles d'une poudre de lait ultrapropre[J]. Le Lait, 1994, 74(1):47-63.
[23] PIERRE A, FAUQUANT J, leY, et al. Préparation de phosphocaséinate natif par microfiltration sur membrane[J]. Lait, 1992,72(5):461-474 .
[24] LEBOEUF B, GUILLOUET P, BATELLIER F, et al. Effect of native phosphocaseinate on thein vitropreservation of fresh semen[J].Theriogenology, 2003, 60:867-877.
[25] BRODY E P. Biological activities of bovine glycomacropeptide[J].British Journal of Nutrition, 2000, 84(Suppl 1):839-846.
[26] CORRING T, LEVENEZ F, CUBER J C, et al. Release of cholecystokinin in humans after the ingestion of glycomacropeptide in proceedings of whey[C]//Proceedings of the 2nd International Whey Conferrence.Chicago:2nd International Whey Conferrence, 1997.
[27] PORTMANN R. Composition for reducing caloric intake:US, 0077530[P]. 2003-10-17.
[28] DEMARIGNY Y. Rle de la flore naturelle du lait cru et detechnologiquesdes caractéristiques biochimiques, microbiologiques et sensorielles des[D]. France:INRA University,1997.
[29] MAUBOIS J L, CAUDRON B, DAVIAU C, et al. Membrane technologies:tools for a total control of the cheesemaking process[C]//IDF Conferrence. Banff:IDF Seminar, 2000.
[30] MAUBOIS J L. Membrane microfiltration:a tool for a new approach in dairy technology[J]. Australian Journal of Dairy Technology, 2002, 57:92-96.
[31] de FREITAS I.du fromage AOC Cantal au lait cru[D]. Franc:INRA University, 2006.
[33] LAWRENCE R C, GILLES J, CREAMER L K, et al. Cheddar cheese and related dry-salted varieties[M]// FOX P F. Cheese:chemistry, physics and microbiology. Amsterdam:Elsevier, 2004:71-102.
[34] MAUBOIS J L, MOCQUOT G, ET VASSAL L. Procédéde traitement du lait et de sous produits laitiers:France, 2052121[P]. 1969-09-12.
[35] JEANTET R. Nanofiltration de liquides laitiers[D]. France:INRA University, 1995 .
[36] SABOYA L V, GOUDDRANCHE H, MAUBOIS J L, et al. Impact of broken cells of lactococci and propionibacteria on the ripening of Saint-Paulin UF cheeses:extent of proteolysis and GC-MS profiles[J]. Lait,2001, 81:689-713.
[37] HANNON J, DEUTSCH S M, MADEC M N, et al. Lysis of starters in UF cheeses:Behaviour of mesophilic lactococci and thermophilic lactobacilli[J]. International Dairy Journal, 2006, 16(4):324-334.
[39] MAHAUT M. Approfondissement des connaissances sur la nature des mécanismes physiques et biochimiques intervenant sur les propriétés rhéologiques des fromages frais[D]. France:Rennes University, 1990.
[40] DONG Jingying, CHEN Lijun, MAUBOIS J L, et al. Influence of medium concentration factor microfiltration treatment on the characteristics of low moisture Mozzarella cheese[J]. Dairy Science & Technology,2009, 89:139-154.
[41] CULIOLI J, BON J P, MAUBOIS J L, et al. Etude de la viscositédes rétentats et des préfromages obtenus après traitement dulait par ultrafiltration sur membrane[J]. Lait, 1974, 54:481-500.
[42] MAUBOIS J L, PIERRE A, FAUQUANT J, et al. Industrial fractionation of main whey proteins[J]. IDF Bulletin, 1987, 212:154-159.
[43] MAUBOIS J L, MOCQUOT G.fromage liquide obtenu par ultrafiltration du lait[J]. Lait, 1971, 51:495-533.
[44] GARNOT P, RANK T C, OLSON N F. Influence of protein and fat contents of ultrafiltered milk on rheological properties of gels formed by chymosin[J]. Journal of Dairy Science, 1982, 65:2267-2273.
[45] DALGLEISH D G. Effect of milk concentration on the rennet coagulation time[J]. Journal of Dairy Research, 1980, 47:231-235.
[46] GARNOT P. Influence of milk concentration by UF on enzymatic coagulation[J]. IDF Bulletin, 1988, 225:11-15.
[47] DALGLEISH D. The effect of denaturation ofβ-lactoglobulin on renneting:a quantitative study[J]. Milchwisssenschaft, 1990, 45:491-494.
[48] MAUBOIS J L, MOCQUOT G, VASSAL L. Procédéde traitement du lait et de sous produits laitiers:France, 2166315[P]. 1972-02-13.
[49] FERRON-BAUMY C, MAUBOIS J L, GARRIC G, et al. Coagulation pressure du lait et des retentats d’ultrafiltration. Effets de divers traitements thermiques[J]. Lait, 1991, 71:423-434.
[50] YVON M, BERTHELOT S, GRIPON J C, et al. Cheese flavour formation by amino acid catabolism[J]. International Dairy Journal, 2001,11(4/7):185-201.
[51] ALAIS C. Science du lait, principes des techniques laitiè res[M]. Paris:SEPAIC, 1984:99-104.
[52] CREAMER L K, IYER M, LELIEVRE J. Effect of various levels of rennet addition on characteristics of Cheddar cheese made from ultrafiltered milk[J]. New Zealand Journal of Dairy Science and Technology, 1987,22:205-214.
[53] LAWRENCE R C. The use of ultrafiltration technology in cheeesemaking[J]. IDF Bulletin, 1989, 240:1-15.
[54] le JAOUEN J C. Cheesemaking[M]. Paris:Gillis, 2000:341-349.
[55] QUIBLIER J P, FERRON-BAUMY C, GARRIC G, et al. Procédéde traitement des laits permettant au moins de conserver leur aptitude fromagè re:France, 2681218[P]. 1991-09-11.
[56] GAREM A, SCHUCK P, MAUBOIS J L. Cheesemaking properties of a new dairy based powder made by a combination of microfiltration and ultrafiltration[J]. Lait, 2000, 80:25-32.
[57] MARSHALL P G, DUNKLEY W L, LOWE E. Fractionation and concentration of whey by reverse osmosis[J]. Food Technology, 1968,22(8):969-970.
[58] GAUTIER M, ROUAULT A, MEJEAN S, et al. Partition ofLactococcus lactisbacteriophage during the concentration of micellar casein by tangential 0.1μm microfiltration[J]. Lait, 1994, 74:419-423.
[59] FAUQUANT J, MAUBOIS J L, PIERRE A, et al. Microfiltration du lait sur membrane minerale. Tech[J]. Lait, 1988, 1028:21-23.
[60] BACHER T, KONIGSFELDT P. WPI by microfiltration of skim milk[J]. European Dairy Magazine, 2000, 5:14-16.
[61] DAUFIN G, GEZAN-GUIZIOU G, DRESCH M, et al. Traitement et recyclage des effluents de I’industrie laitiè re in Lesséparations par membrane dans les procédés de l’ industrie laitière[M]. Paris:Lavoisier,1998:343-371.
[62] ZADOW J G. Whey and lactose processing[M]. New York:Elesier,1992:271-316; 195-230; 231-270.
[63] MARSHALL K R, HARPER W J. Whey protein concentrate[J]. IDF Bulletin, 1988, 233:21-32.
[64] ROSENBERG M. Current and future applications for membrane processes in the dairy industry[J]. Trends in Food Science and Technology,1995, 6:12-19.
[65] MAUBOIS J L. Cheese biotechnology in international food development[C]//Proceedings Symposium. Ithaca:Conell University Conferrence,1987:24.
[66] PEARCE R J. Fractionation of whey proteins[J]. Australian Journal of Dairy Technology, 1987, 42:75-78.
[68] HAKANSSON A, ZHIVOTOVSKY B, ORRENIUS S. Apoptosis induced by a human milk protein[J]. Proceedings of the National Academy of Science USA, 1995, 92(17):8064-8068.
[69] BAUMY J J, GESTIN L, FAUQUANT J, et al. Technologies de purification des phospholipides dulactosérum[J]. Process, 1990, 1047:29-33.
[70] BARRY J A. Alcohol production from cheese whey[J]. Dairy Industries International, 1998, 47(10):19-22.
[71] KELLY P, HORTON B S, BURLING H. Partial demineralization of whey by nanofiltration in New applications of membrane processes[J].IDF Special Issue, 1992, 9201:130-140.
[72] JEANTET R, SCHUCK P, FAMELART M H, et al. Intérêt de la nanofiltration dans la production de poudres de lactosérum démineralisées[J]. Lait,1996, 76(3):283-301.
[73] LESZEK J, INGLOT A D, JANUSZ M, et al. Colostrinin Proline-rich polypeptide complex from ovine colostrum- a long-term study of its effiency in Alzheimer’s disease[J]. Medicine Science Monitor, 2002, 8(10):193-196
[74] TOBA Y, TAKADA Y, YAMAMURA J, et al. Milk basic protein:a novel protective function against osteoporosis[J]. Bone, 2000, 27(3):403-408.
[75] DAUFIN G, GEZAN-GUIZIOU G, MULLER A, et al. Lactosérum in Les séparations par membrane dans les procédés de l’ industrie laitière[M]. Paris:Technique Documentation, 1998:310-329.
[76] MAUBOIS J L. Utilisation des techniques amembranes, osm ose inverse et ultrafiltration, dans les industries agricoles et alimentaires[J].Bulletin Technology Information, 1974, 291:1-9.
[77] KULOZIK U. Membranes in microbial fermentations[C]//Bulletin International Dairy Federation, IDF Special Issue N 9201, 1992:141-160.
[78] PEDERSEN P J. Microfiltration for the reduction of bacteria in milk and brine[C]//Bulletin International Dairy Federation, IDF Special Issue N 9201, 1992:33-50.
Applications of Membrane Technology in Dairy Industry:a Review
MA Ying1,DONG Jing-ying2,Jean-Louis Maubois3
(1. College of Food Science and Engineering, Harbin Institute of Technology, Harbin 150090, China;2. Technical Center, Beijing Sanyuan Foods Co. Ltd., Beijing 100085, China;3. Laboratoire de Recherches de Technologie Laitiè re, INRA Bretagne 35042, France)
TS252 .1
A
1002-6630(2010)17-0402-08
2009-10-14
马莺(1961—),女,教授,博士,研究方向为农产品加工。E-mail:maying@hit.edu.cn
