凡纳滨对虾主要过敏原鉴定及酶法消减技术的研究
2010-10-19吴海明胡志和王丽娟
吴海明,胡志和*,王丽娟
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
凡纳滨对虾主要过敏原鉴定及酶法消减技术的研究
吴海明,胡志和*,王丽娟
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
以凡纳滨对虾为研究对象,用免疫印迹法检测其主要过敏原蛋白组分;用胰蛋白酶、木瓜蛋白酶和菠萝蛋白酶对凡纳滨对虾水溶性蛋白水解,消减过敏原。并且通过间接酶联免疫吸附实验和致敏豚鼠全身免疫实验对过敏原消减情况进行检测,确定酶法消减过敏原条件。结果表明,凡纳滨对虾的主要过敏原为99、33、19kD以及14kD的蛋白质组分。胰蛋白酶最佳水解条件为:pH8.0,酶与底物比1:100(m/m,下同),45℃,底物质量浓度3g/100mL,水解时间3h;木瓜蛋白酶最佳水解条件为pH6.5,酶与底物比1:100,60℃,底物质量浓度3g/100mL,水解时间3h;菠萝蛋白酶最佳水解条件:pH7.5,酶与底物比1:100,55℃,底物质量浓度5g/100mL,水解时间3h。并且胰蛋白酶水解产物和木瓜蛋白酶水解产物对致敏豚鼠的全身免疫实验安全性很好。
凡纳滨对虾;过敏原消减;蛋白酶水解;酶联免疫
Abstract:The major allergenic protein components inLitopenaeus vannameiwere determined by Western blotting. Either trypsin, papain or bromelain was used to hydrolyze water-soluble proteins fromLitopenaeus vannameifor the elimination of allergens. ELISA and general immunity experiments in allergic guinea pigs were used to evaluate the elimination of allergens. The optimum hydrolysis conditions for achieving a maximum elimination of allergens were also determined. The results showed that the major allergens inLitopenaeus vannameiwere found to have molecular weights of 99, 33, 19 kD and 14 kD, respectively. The optimal conditions for trypsin hydrolysis were as follows:pH 8.0, hydrolysis temperature 45 ℃, enzyme-to-substrate ratio 1:100, protein concentration 3 g/100 mL and hydrolysis time 3 h; those for papain digestion were pH 6.5, hydrolysis temperature 60 ℃, enzyme-to-substrate ratio 1:100, protein concentration 3 g/100 mL and hydrolysis time of 3 h; and pH of 7.5, hydrolysis temperature of 55 ℃, enzyme-substrate ratio of 1:100, protein concentration of 5 g/100 mL and hydrolysis time of 3 h were found optimum for bromelain hydrolysis. The hydrolysates derived from trypsin and papain hydrolysis were safer for allergic guinea pigs.
Key words:Litopenaeus vannamei;allergen elimination;hydrolysis;ELISA
近年来食品安全问题受到越来越多人的重视,过敏疾病的发病率越来越高,全世界约有30%~40%的人患有各种各样的过敏疾病,且发病率和死亡率呈逐年上升趋势[1],过敏疾病被世界卫生组织(WHO)认定为当今世界性的重大卫生问题之一。在西方发达国家,有2.5%的成年人和6%~8%的儿童会对某些食品过敏[2]。美国有600~700万的过敏患者,每年平均有100~125例因食品过敏而致死的病例。在这些引起过敏的食品中,虾及其制品产品是其中重要的一类[3-5],有关食用或加工海产品导致过敏的报道层出不穷[6-11]。蛋白酶能够对海虾过敏原蛋白的结构进行破坏,破坏过敏原的抗原表位,从而降低过敏原的免疫活性。通过筛选出高效专一性的酶对过敏原进行定向酶解,可以有效的降低过敏原。本实验以凡纳滨对虾为研究对象,对其蛋白质抽提后鉴定其主要过敏原,并用胰蛋白酶、木瓜蛋白酶和菠萝蛋白酶对其蛋白抽提物水解,通过间接酶联免疫技术和致敏豚鼠全身免疫实验对水解后过敏原消减的程度进行检测。以期为开发低敏性凡纳滨对虾虾制品提供依据。
1 材料与方法
1.1 材料与试剂
新鲜活的凡纳滨对虾 市售;伊利高蛋白脱脂奶粉内蒙古伊利实业集团股份有限公司。
海虾过敏人血清(临床症状均为喉咙痒,严重时全身肿)、海虾非过敏人血清 天津商业大学校医院(自制),血清均放在-25℃的冰箱中冻存。
胰蛋白酶(try p s in,250 U/mg)、木瓜蛋白酶(papain,2U/mg)、菠萝蛋白酶(bromelain,6U/mg)、HRP标记的羊抗人IgE抗体 美国Sigma公司;Westren发光检测试剂盒 普洛麦格(北京)生物技术有限公司;柯达XBT-1型医用X射线胶片 北京世纪红门科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
HWS24型电热恒温水浴锅 上海一恒科学仪器有限公司;PHS-3C精密pH计 天津市盛邦科学仪器有限公司;KDC-160HR型高速冷冻离心机 科大创新股份有限公司中佳分公司;FA1104N型电子天平 上海精密科学仪器有限公司;JJ-2型组织捣碎匀浆机 常州国华电器有限公司;Centrifuge5424型离心机 Eppendorf公司;Trans-Blot SD cell电转化仪、UNIVERSAL HOOD Ⅱ凝胶电泳成像仪 美国Bio-Rad公司;RT-6000型酶标分析仪 深圳雷杜生命科学股份有限公司。
1.3 实验动物
英国种豚鼠,200~350g,健康,雌雄兼用。
1.4 方法
1.4.1 过敏原的提取
将虾去壳去头去尾去肠线后放在匀浆器中匀浆,1g组织大约用1mL的生理盐水悬浮,将该悬浮液在冰上悬浮5min后加入4倍体积的冷丙酮(-20℃预冷过夜),充分混匀,于0℃作用30min,期间混匀数次。4℃、8000r/min离心15min,收集沉淀物,沉淀物用冷丙酮重悬并混匀,再在4℃、8000r/min离心15min,将沉淀物转移至干净的滤纸上,分散并让其在室温下空气中风干后为丙酮粉[12-13]。
取丙酮粉与抽提液(1mol/L KCl、0.5mmol/L DTT(1,4-dithiothreitol,pH7.4))按1:10(m/V)的比例抽提过夜,4℃、8000r/min离心15min后,取上清,沉淀用抽提液继续抽提4h,离心取上清。透析过夜,两次获得的上清液合并后冷冻干燥,于-20℃的冰箱中保存备用。
1.4.2 免疫印迹(western-blotting)
采用SDS-PAGE电泳体系,分离胶12%,浓缩胶为5%进行电泳后将蛋白条带转印至PVDF膜上。待测蛋白条带进行免疫印迹检测,将膜置于封闭液(质量分数5%脱脂乳的TBST)中室温封闭2h,期间确保膜与封闭液完全接触。倒掉封闭液后用TBST洗膜3次,每次10min,洗膜结束后加一抗即过敏人血清(阴性对照加入非海虾过敏人血清)反应1h,反应结束后用TBST洗涤10min,连续洗涤3次后,加入HRP标记的羊抗人IgE室温下孵育1h,用TBST连续洗涤3次,每次10min,将Westren发光检测试剂盒的A液和B液等体积混合后加到膜表面,反应30s后通过X光片进行曝光,显影定影后水冲净室温下晾干,标记好蛋白标准后拍照。
1.4.3 3种蛋白酶水解凡纳滨对虾蛋白抽提物
1.4.3.1 胰蛋白酶水解凡纳滨对虾蛋白抽提物
在用胰蛋白酶对凡纳滨对虾蛋白抽提物进行水解时,以酶与底物比(m/m)、底物质量浓度和pH值为影响因素。在水解温度45℃,pH8.0,底物质量浓度5g/100mL的条件下,改变酶与底物比(1:50、1:100、1:200、1:500);在水解温度45℃,pH8.0,酶与底物比1:100的条件下,改变底物质量浓度(3、5、7、9 g/100mL);在水解温度45℃,酶与底物比1:100,底物质量浓度5g/100mL的条件下,改变pH值(7.0、7.5、8.0、8.5)进行水解。水解3h后,将反应体系置于80℃,10min使酶失活,将水解物离心处理后进行冷冻干燥,然后对水解产物进行检测。
1.4.3.2 木瓜蛋白酶水解凡纳滨对虾蛋白抽提物
在用木瓜蛋白酶对凡纳滨对虾蛋白抽提物进行水解时,以酶与底物比、底物质量浓度和pH值为影响因素。在水解温度60℃、pH6.5、底物质量浓度5g/100mL的条件下,改变酶与底物比(1:50、1:100、1:200、1:500);在水解温度60℃、pH6.5、酶与底物比1:100的条件下,改变底物质量浓度(3、5、7、9g/100mL);在水解温度60℃、酶与底物比1:100、底物质量浓度5g/100mL的条件下,改变pH值(6.0、6.5、7.0、7.5)进行水解。水解3h后,将反应体系置于80℃,10min使酶失活,将水解物离心处理后进行冷冻干燥,然后对水解产物进行检测。
1.4.3.3 菠萝蛋白酶水解凡纳滨对虾蛋白抽提物
在用菠萝蛋白酶对凡纳滨对虾蛋白抽提物进行水解时,以酶与底物比、底物质量浓度和pH值为影响因素。在水解温度为55℃、pH7.0、底物质量浓度5g/100mL的条件下,改变酶与底物比(1:50、1:100、1:200、1:500);在水解温度为55℃、pH7.0、酶与底物比1:100的条件下,改变底物质量浓度(3、5、7、9g/100mL);在水解温度55℃、酶与底物比1:100、底物质量浓度5g/100mL的条件下,改变pH值(6.5、7.0、7.5、8.0)进行水解。水解3h后,将反应体系置于80℃,10min使酶失活,将水解物离心处理后进行冷冻干燥,然后对水解产物进行检测。
1.4.4 间接酶联免疫吸附法对水解物检测
在对水解后的凡纳滨对虾水解物过敏性消减程度进行检测时用未水解的虾蛋白抽提物作为阳性对照,用正常人血清作为一抗作为阴性对照。
包被抗原时为减小误差每6孔作为一组,每板有1组做空白,在酶标板中每孔加入100μL质量浓度为10mg/mL后4℃放置过夜后用洗涤液(PBST)洗涤3次,每次5min,在滤纸上拍干后每孔加入封闭液(含1g/100mL BSA的PBST)200μL,37℃水浴2h。封闭结束后,同样用洗涤液洗涤3次,每次5min,拍干后每孔加一抗(含1g/100mL BSA的PBST将海虾过敏人血清稀释20倍)100μL,37℃水浴2h后洗涤,拍干后加入HRP标记的羊抗人IgE 37℃水浴2h后洗涤,拍干后每孔加入100μL邻苯二胺底物液室温放置15min,每孔加入50μL终止液(5mol/L H2SO4)后在492nm波长处测定其OD492nm值[14]。
1.4.5 豚鼠全身免疫实验
根据斑点酶联免疫和间接酶联免疫的检测结果,将3种蛋白酶(胰蛋白酶、木瓜蛋白酶和菠萝蛋白酶)水解后对过敏原性消减最好条件的蛋白做豚鼠全身免疫实验。每组6只豚鼠,雌雄各半,豚鼠腹腔注射3次(隔天注射),每次1mL/只,7d后足趾静脉注射2mL/只进行激发,分组见表1,激发后观察动物现象[15]。

表1 豚鼠全身免疫实验分组Table 1 Grouping of guinea pigs for general immunity experiments
2 结果与分析
2.1 凡纳滨对虾主要过敏原的鉴定
虾蛋白质抽提物经SDS-PAGE后,经凝胶成像系统分析得知凡纳滨对虾的蛋白质组分有15条可辨蛋白带,如图1所示,分子质量为174、99、79、68、59、48、42、40、33、24、19、17、14、12、11kD,主要蛋白质组分分子质量为33kD。
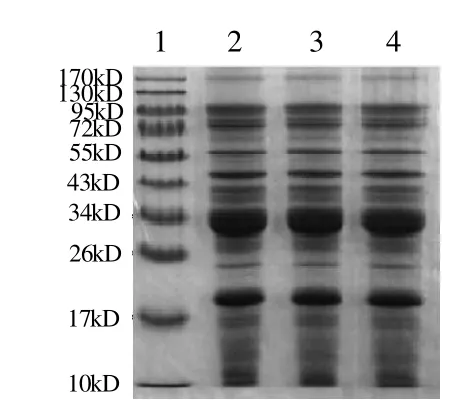
图1 凡纳滨对虾电泳蛋白质抽提物的SDS-PAGEFig.1 SDS-PAGE analysis of protein extracts fromLitopenaeus vannamei
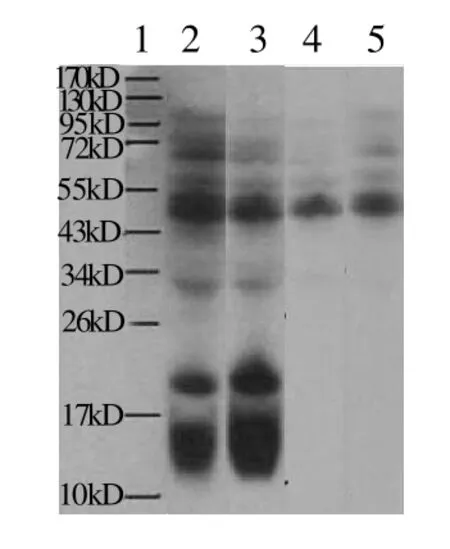
图2 凡纳滨对虾过敏原免疫印迹鉴定Fig.2 Western blotting analysis of allergens inLitopenaeus vannamei
从图2的免疫印迹结果可以发现,不同的海虾过敏人对凡纳滨对虾的免疫印迹结果几乎相同。凡纳滨对虾蛋白质组分出现阳性反应的组分分子质量为99、68、59、48、33、19kD以及14kD。因为在免疫印迹检测中不仅可以检测出抗原抗体之间的特异性结合反应,还会有一些非抗原抗体之间的非特异性结合反应,为进一步说明哪些蛋白组分为研究的主要过敏原,用海虾非过敏人的血清作为一抗进行免疫印迹实验作为阴性对照,一位海虾非过敏人血清和30位海虾非过敏人混合血清作为一抗出现的非特异性蛋白几乎相同,凡纳滨对虾的非特异性反应蛋白质组分分子质量为68、59kD和48kD,去除非特异性反应的蛋白组分可知,凡纳滨对虾的主要过敏原为99、33、19kD以及14kD的蛋白质组分。
2.2 间接酶联免疫法对3种蛋白酶水解物检测结果
在用蛋白酶水解过程中不同蛋白酶的水解温度依次为:胰蛋白酶为45℃、木瓜蛋白酶为60℃、菠萝蛋白酶为55℃,水解时间均为3h,控制酶与底物比、pH值和底物质量浓度3个参数的变化,结果见表2~4。
采用间接酶联免疫吸附法对用上述3种蛋白酶水解后的凡纳滨对虾蛋白过敏原性消减程度检测时,以未水解的蛋白抽提物为阳性对照组,同时以30位海虾非过敏人血清作为一抗进行间接酶联免疫检测作为阴性对照组,阳性对照组的OD492nm值为0.585,阴性对照组的OD492nm值在0.03~0.05之间,阴性对照组的总体OD492nm均值为0.038。3种不同对虾蛋白水解物的OD492nm值均低于阳性对照组的OD492nm值。经胰蛋白酶在pH8.0,酶与底物比1:100,45℃,底物质量浓度3g/100mL的条件下水解后检测其OD492nm值为0.075;木瓜蛋白酶水解时在pH6.5,酶与底物比1:100,60℃,底物质量浓度3g/100mL的条件下水解后检测其OD492nm值为0.054;菠萝蛋白酶水解时在pH7.5,酶与底物比1:100,55℃,底物质量浓度5g/100mL的条件下水解后检测其OD492nm值为0.148。经3种蛋白酶在其最佳水解条件下水解虾蛋白,对其过敏原性消减较好,但也略高于阴性对照组的OD492nm值。
表2 胰蛋白酶水解虾蛋白的产物与过敏人血清反应的OD492nm值(±s,n= 6)Table 2 OD value of trypsin-hydrolyzed shrimp protein reacted with allergic human serum
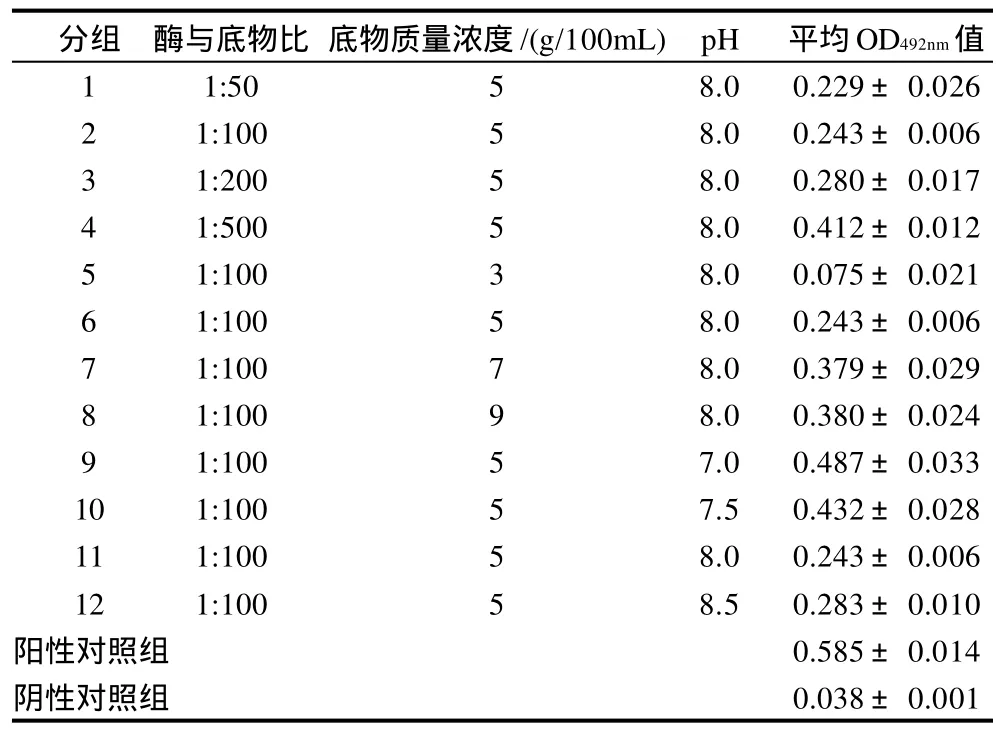
表2 胰蛋白酶水解虾蛋白的产物与过敏人血清反应的OD492nm值(±s,n= 6)Table 2 OD value of trypsin-hydrolyzed shrimp protein reacted with allergic human serum
分组 酶与底物比 底物质量浓度/(g/100mL) pH 平均OD492nm值1 1:50 5 8.0 0.229±0.0262 1:100 5 8.0 0.243±0.0063 1:200 5 8.0 0.280±0.0174 1:500 5 8.0 0.412±0.0125 1:100 3 8.0 0.075±0.0216 1:100 5 8.0 0.243±0.0067 1:100 7 8.0 0.379±0.0298 1:100 9 8.0 0.380±0.0249 1:100 5 7.0 0.487±0.03310 1:100 5 7.5 0.432±0.02811 1:100 5 8.0 0.243±0.00612 1:100 5 8.5 0.283±0.010阳性对照组 0.585±0.014阴性对照组 0.038±0.001
表3 木瓜蛋白酶水解虾蛋白的产物与过敏人血清反应的OD492nm值(±s,n= 6)Table 3 OD value of papain-hydrolyzed shrimp protein reacted with allergic human serum
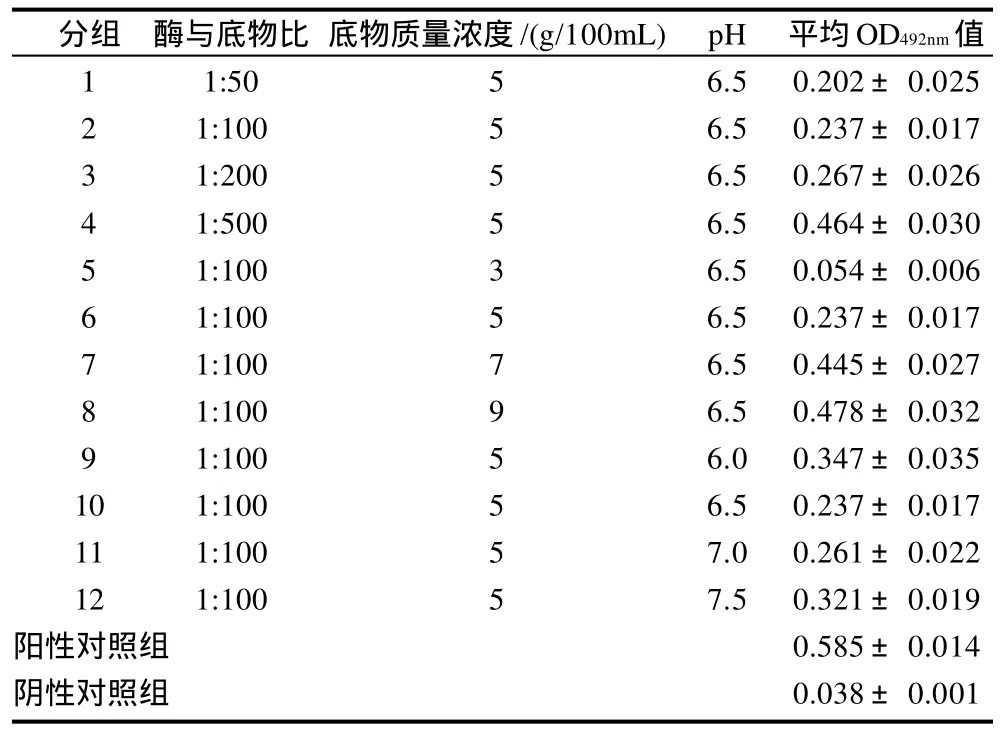
表3 木瓜蛋白酶水解虾蛋白的产物与过敏人血清反应的OD492nm值(±s,n= 6)Table 3 OD value of papain-hydrolyzed shrimp protein reacted with allergic human serum
分组 酶与底物比 底物质量浓度/(g/100mL) pH 平均OD492nm值1 1:50 5 6.5 0.202±0.0252 1:100 5 6.5 0.237±0.0173 1:200 5 6.5 0.267±0.0264 1:500 5 6.5 0.464±0.0305 1:100 3 6.5 0.054±0.0066 1:100 5 6.5 0.237±0.0177 1:100 7 6.5 0.445±0.0278 1:100 9 6.5 0.478±0.0329 1:100 5 6.0 0.347±0.03510 1:100 5 6.5 0.237±0.01711 1:100 5 7.0 0.261±0.02212 1:100 5 7.5 0.321±0.019阳性对照组 0.585±0.014阴性对照组 0.038±0.001
表4 菠萝蛋白酶水解虾蛋白的产物与过敏人血清反应的OD492nm值(±s,n= 6)Table 4 OD value of bromelain-hydrolyzed shrimp protein reacted with allergic human serum

表4 菠萝蛋白酶水解虾蛋白的产物与过敏人血清反应的OD492nm值(±s,n= 6)Table 4 OD value of bromelain-hydrolyzed shrimp protein reacted with allergic human serum
分组 酶与底物比 底物质量浓度/(g/100mL) pH 平均OD492nm值1 1:50 5 7.0 0.261±0.0212 1:100 5 7.0 0.265±0.0123 1:200 5 7.0 0.272±0.0234 1:500 5 7.0 0.462±0.0395 1:100 3 7.0 0.264±0.0116 1:100 5 7.0 0.265±0.0127 1:100 7 7.0 0.443±0.0408 1:100 9 7.0 0.464±0.0319 1:100 5 6.5 0.421±0.02710 1:100 5 7.0 0.265±0.01211 1:100 5 7.5 0.148±0.00712 1:100 5 8.0 0.288±0.015阳性对照组 0.585±0.014阴性对照组 0.038±0.001
2.3 豚鼠全身免疫实验检测过敏原消减结果
在豚鼠全身免疫实验中所用阳性对照蛋白为未水解的凡纳滨对虾蛋白(组别1),分别对3种蛋白酶在最佳水解条件下的虾蛋白水解物进行动物全身免疫实验。其中组别2~4,致敏蛋白为未水解的虾蛋白,组别5~7依次为胰蛋白酶最佳水解物(OD492nm值为0.075)、木瓜蛋白酶最佳水解物(OD492nm值为0.054)、菠萝蛋白酶最佳水解物(OD492nm值为0.148)。豚鼠全身免疫实验结果见表5。

表5 豚鼠全身免疫实验结果(n=6)Table 5 Results of general immunity experiments in guinea pigs
从表5可以看出,用0.1g/100mL未水解虾蛋白致敏豚鼠3次后,再经0.1g/100mL未水解虾蛋白激发后发现,豚鼠死亡率为100%,说明过敏型豚鼠模型建立成功。用未水解的虾蛋白致敏豚鼠,再经胰蛋白酶最佳水解物激发后豚鼠均正常,无死亡;用未水解的虾蛋白致敏豚鼠,再经木瓜蛋白酶最佳水解物激发后豚鼠均正常,无死亡;用未水解的虾蛋白致敏豚鼠,再经菠萝蛋白酶最佳水解物激发后有两例死亡,死亡率达33.3%。
3 讨论与结论
通过SDS-PAGE以及免疫印迹的结果发现,出现强阳性抗原抗体特异性反应的蛋白并不一定是蛋白质组分含量相对多的条带,例如凡纳滨对虾其蛋白质组分在14kD的蛋白含量明显低于分子质量在33kD的蛋白组分,但在14kD的蛋白质组分免疫印迹结果明显强于在33kD的蛋白质组分。
我国也有学者从凡纳滨对虾中提取海虾的主要过敏原[16]。在初步分离的蛋白质组分中分子质量36kD的蛋白含量较高,用海虾过敏者血清及阳性血清池鉴定主要过敏原,鉴定36kD的蛋白为主要过敏原。但在用阳性血清池鉴定该对虾主要过敏原的实验中,没有阴性对照实验,说明在36kD的蛋白未必是非特异性反应。在本实验研究中凡纳滨对虾的蛋白初步分离组分中33kD的蛋白含量较高,但通过免疫印迹实验的阴性对照发现,分子质量为33kD的组分不是其主要过敏原。
凡纳滨对虾在经胰蛋白酶、木瓜蛋白酶和菠萝蛋白酶水解后,其过敏原性都有一定的消减作用,通过酶联免疫的结果可知,胰蛋白酶和木瓜蛋白酶对于凡纳滨对虾过敏原消除效果较好,动物实验安全性也很高。
[1] GEHA R S. Allergy and hypersensitivity. Nature versus nurture in allergy hypersensitivity[J]. Curr Opin Immunol, 2003, 15(6):603-608.
[2] HANSON L, TELEMO E. The growing allergy problem[J]. Acta Paediatr, 1997, 86(9):916-918.
[3] YUNGIGER J W. Fatal food-induced anaphylaxis[J]. Am Med Assoc,1998, 260(10):1450-1452.
[4] SAMPSON H A, MENDELSON L, ROSEN J P. Fatal and near-fatal anaphylactic reaction to food in children and adolescents[J]. The New England Journal of Medicine, 1992, 327(6):380-384.
[5] 吕相征, 刘秀梅, 杨晓光. 健康人群食物过敏状况的初步调查[J]. 中国食品卫生杂志, 2005, 17(2):119-121.
[6] LEMIERE C, DESJARDINS A, LEHRER S, et al. Occupational asthma to lobster and shrimp[J]. Allergy, 1996, 51(4):272-273.
[7] GADDIE J, LEGGE J, REID T M S. Pulmonary hypersensitivity in prawn workers[J]. Lancet, 1980, 316(8208):1350-1353.
[8] GOETZ D W, WHISMAN B A. Occupational asthma in a seafood restaurant worker:cross-reactivity of shrimp and scallops[J]. Ann Allergy Asthma Immunol, 2000, 85(6 Pt 1):461-466.
[9] KIM W H, LEE S K, LEE H C, et al. Shell:Grinder’s asthma[J]. Yonsei Med J, 1982, 23(2):123-130.
[10] 安爱芝, 孙月芹. 食坑虾引起过敏性休克1例[J]. 医学理论与实践,2003, 16(8):877.
[11] 许岩, 许红. 食用虾爬子引起过敏性休克1例[J]. 沈阳医学院学报,2000, 2(2):108.
[12] 王晓雯. 中国对虾主要过敏原的鉴定及性质的研究[D]. 青岛:中国海洋大学, 2008.
[13] 赵振兴. 虾过敏原免疫活性的研究[D]. 青岛:中国海洋大学, 2006.
[14] 白振宇. 牛奶中主要过敏原的消除及检测技术的研究[D]. 天津:天津商业大学, 2007.
[15] 徐叔云, 卞如濂, 陈修, 等. 药理实验方法学[M]. 北京:人民卫生出版社, 1991:1196-1203.
[16] 李振兴, 林洪, 李明华, 等. 不同虾类的过敏原及其过敏原性[J]. 水产学报, 2005, 30(2):281-284.
Identification and Enzymatic Elimination of Major Allergens inLitopenaeus vannamei
WU Hai-ming,HU Zhi-he*,WANG Li-juan
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce,Tianjin 300134, China)
R392.8;S917
A
1002-6630(2010)17-0272-05
2010-01-19
“十一五”国家科技支撑计划重大项目(2008BAD94B09)
吴海明(1986—),女,硕士研究生,研究方向为食品生物技术。E-mail:wuhaiming-22@163.com
*通信作者:胡志和(1962—),男,教授,硕士,研究方向为食品生物技术。E-mail:hzhihe@tjcu.edu.cn
