蓝莓多糖的抗氧化性与抑菌作用
2010-10-19孟宪军刘晓晶孙希云
孟宪军,刘晓晶,孙希云,张 琦,潘 璇
(沈阳农业大学食品学院,辽宁 沈阳 110866)
蓝莓多糖的抗氧化性与抑菌作用
孟宪军,刘晓晶,孙希云,张 琦,潘 璇
(沈阳农业大学食品学院,辽宁 沈阳 110866)
利用水提醇沉法从蓝莓中提取多糖,再经初步纯化后,进行多糖的抗氧化性及抑菌作用实验。结果表明,蓝莓多糖对羟自由基和DPPH自由基有较强的清除作用,且清除率50%所对应的质量浓度IC50分别为2mg/mL和7mg/mL。但蓝莓多糖对超氧阴离子自由基几乎没有作用效果。蓝莓多糖对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌、啤酒酵母均有一定的抑制作用,最小抑制浓度MIC在50~75mg/mL之间,对热带假丝酵母、青霉和黑曲霉无抑制作用。
蓝莓多糖;抗氧化性;抑菌作用
Abstract:Polysaccharides in blueberry fruits were extracted by water extraction and ethanol precipitation, and after preliminary purification, the precipitate was assessed for its antioxidant and antimicrobial activities. The results showed that blueberry polysaccharides had a strong ability to scavenge both hydroxyl and DPPH free radicals, with IC50 values of 2 mg/mL and 7 mg/mL. However, almost no scavenging effect against superoxide anion radicals was observed. The polysaccharides could inhibit the growth of all of the following microorganisms:Bacillus subtilis,Escherichia coli,Staphylosocus aureus, andSaccharomyces cerevisiaeand the corresponding minimal inhibitory concentrations (MIC) varied from 50 to 75 mg/mL. However,no inhibitory effect onG.tropicalis,Penicilliumsp. orAspergillus nigerwas observed.
Key words:blueberry polysaccharide;antioxidant activity;antimicrobial activity
蓝莓(Semen trigonellae),又称越橘、蓝浆果。蓝莓是一种耐寒性极强的野生植物,原产于北美、苏格兰和俄罗斯。在我国东北的大小兴安岭及海南等地区都有野生种分布,目前辽宁省不少地区也有了大面积的种植。蓝莓果实不仅甜酸适度、风味好,且营养丰富,含有大量对人类健康有益的物质,包括抗氧化物、鞣酸、叶酸、抗菌成分和丰富的食用纤维等,因此,常被誉为“浆果之王”。在我国古代医学书籍中,有很多关于越橘入药的记载。其主要功能性有:减轻眼的疲劳及提高夜间视力,保护毛细血管及抗氧化,抑制血小板凝结,预防血栓的形成及动脉硬化,增强关节及软组织的功能,对尿路感染症有医疗效果,有抗癌作用,对与心血管疾病发生有关的生物性酶有很强的抑制作用等[1]。
国外对于蓝莓中活性成分的研究还主要集中在花色苷上,研究了花色苷提取物的诸多生理功能以及一些加工处理对其抗氧化能力的影响[2];对于蓝莓中的黄酮类物质的功能性也有研究。国内对于蓝莓的研究还主要集中在引种栽培技术上,对于蓝莓的中活性成分的提取和开发利用方面的研究还较为落后。有关蓝莓多糖的活性研究未见报道,本实验采用水提醇沉法从蓝莓中提取多糖,再经初步纯化后,进行多糖的体外抗氧化性及抑菌作用的研究,为蓝莓多糖的生产与应用提供参考。
1 材料与方法
1.1 材料与试剂
蓝莓购于辽宁蓝金实业有限公司,品种为蓝丰。
细菌:枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylosocus aureus);真菌:青霉(Penicilliumsp.)、黑曲霉(Aspergillus niger)、热带假丝酵母(G.tropicalis)、啤酒酵母(Saccharomyces cerevisiae)由沈阳农业大学土地与环境学院微生物实验室提供。
无水乙醇、丙酮、乙醚、30%双氧水、三氯乙酸、正丁醇、邻二氮菲、硫酸亚铁、磷酸氢二钠、磷酸二氢钠、邻苯三酚、盐酸、三羟甲基氨基甲烷(分析纯) 国药集团药业股份有限公司;1,1-二苯基-2-三硝基苯肼(分析纯) 北京豪尔思科技有限公司。
1.2 仪器与设备
DK恒温水浴锅 上海精宏实验设备有限公司;RE-52AA旋转蒸发器 上海亚荣实验设备有限公司;TDL-5-A型离心机 上海安亭科学仪器厂;DZF-6050真空干燥箱 上海沪粤明科学仪器有限公司;TU-1810紫外-可见分光光度计 深圳市凯铭杰仪器有限公司;HZP-250型全温振荡培养箱 上海新诺仪器设备有限公司;BOXUN超净台 上海优浦科学仪器有限公司。
1.3 方法
1.3.1 蓝莓多糖样品的制备
1.3.1.1 提取
取蓝莓冻果,融化后,打浆,采用料水比1:8(m/V)加水,在90℃恒温水浴锅中搅拌浸提4h。取出,纱布过滤、离心。取上清液,旋转蒸发浓缩至原体积的1/8,加入乙醇,使乙醇体积分数达到80%,静置8h。离心取沉淀,依次用丙酮、乙醚和乙醇洗涤脱脂,真空干燥,制得蓝莓粗多糖。
1.3.1.2 脱色
干燥后的粗多糖,采用料水比1:2(以上述蓝莓冻果计算)溶于水中,在pH8.5的条件下,加双氧水体积分数达到40%,50℃恒温水浴4h[3]。
1.3.1.3 脱蛋白
脱色后的多糖溶液与1:10(m/V)的三氯乙酸-正丁醇等体积混合,振荡10min,静置1h后,弃去上层有机层和中层蛋白层,保留下层多糖溶液。重复操作3次[4]。
1.3.1.4 透析
流水透析8h,蒸馏水再透析8h,每隔1h换一次蒸馏水。
1.3.1.5 浓缩、干燥
将糖溶液旋转蒸发浓缩至最小体积,真空干燥后,得到蓝莓多糖样品。
1.3.2 蓝莓多糖抗氧化性能实验
1.3.2.1 蓝莓多糖对·OH清除作用的测定
采用邻二氮菲-金属铁离子-H2O2体系:邻二氮菲与Fe2+反应生成Fe2+-邻二氮菲配合物,该配合物在536nm波长处有最大吸收;通过Fenton反应产生·OH;而当·OH氧化Fe2+-邻二氮菲成Fe3+-邻二氮菲时,就使536nm波长处最大吸收消失或减弱。当反应体系中存在·OH清除剂时,此氧化过程受到抑制,536nm波长处最大吸收降低不明显,故可通过536nm波长处吸光度比较抗氧化剂清除·OH的作用[5]。
参照文献[5-7]的方法,略作改进:实验设样品组、损伤组和未损伤组。邻二氮菲先用少量的乙醇溶解,再用水稀释成1.5mmol/L的溶液。取上述邻二氮菲溶液1.0mL,加pH7.4、0.2mol/L磷酸盐缓冲溶液(PBS)2.0mL,充分混匀后,加1.5mmol/L硫酸亚铁溶液1.0mL,加入样品溶液1.0mL,每加一管立即混匀,加0.01% H2O2溶液1.0mL。反应在37℃恒温水浴中进行,准确反应1h后,在536nm波长处测定吸光度。损伤组中用1.0mL去离子水代替样品溶液;未损伤组中用2.0mL去离子水代替样品溶液和H2O2溶液。按式(1)计算样品对·OH的清除率(I),并求出清除率50%所对应的质量浓度IC50。

式中:AX为样品组吸光度;A0为未损伤组吸光度;A1为损伤组吸光度。
1.3.2.2 蓝莓多糖对O2·清除作用的测定
采用改良的邻苯三酚自氧化法[8-10],用10mmol/L HCl溶解邻苯三酚,制得250mmol/L的溶液。取pH8.0、2.99mL 50mmol/mL的Tris-HCl缓冲溶液于试管中,加入10μL上述邻苯三酚溶液(同时按秒计时),立即搅拌混匀,倒入1cm光径比色杯中在325nm波长处测吸光度,1min后开始计数据,每隔30s记一次,一直记到4min。对照管以10μL 10mmol/mL HCl代替邻苯三酚。
自氧化速率(I0):线性范围内,每分钟的吸光度的增值。实际计算取4min内平均每分钟吸光度的增值。要求I0达到0.07/min,若达不到此速率可通过调整邻苯三酚的浓度来达到。

式中:A1为1min时的吸光度;A4为4min时的吸光度。
样品活性测定:样品管代替自氧化管,为消除色素影响,取2.98mL pH8.050mmol/mL的Tris-HCl缓冲溶液,加入10μL的样品溶液,再加入10μL 250mmol/mL的邻苯三酚。其余步骤同上。计算加样后邻苯三酚自氧化速率(IX),算出对O2·清除率(I)。

1.3.2.3 蓝莓多糖对DPPH自由基清除作用的测定
利用DPPH乙醇溶液在517nm波长处有紫色团的特征吸收峰。加入抗氧化剂后,在517nm波长处吸光度的下降表示抗氧化剂对DPPH自由基的清除能力[11-12]。
准确称取0.0100g DPPH溶解在无水乙醇中,用250mL棕色容量瓶定容,放入冰箱中备用。实验设样品组和两个对照组。在2mL的DPPH醇溶液中加入2mL样品溶液,混匀后避光反应30min,立即在517nm波长处测定吸光度。对照组1中用2mL去离子水代替样品溶液。对照组2中用2mL去离子水代替2mL DPPH醇溶液[13]。按下式计算样品对DPPH自由基的清除率(I),并求出清除率50%所对应的质量浓度IC50。
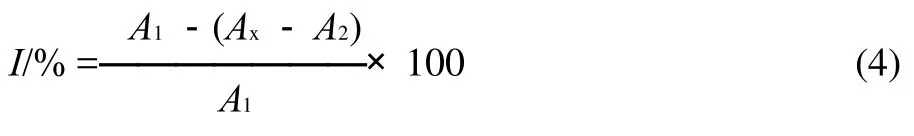
式中:A1为对照组1吸光度;A2为对照组2吸光度;Ax为样品组吸光度。
1.3.3 蓝莓多糖抑菌实验
1.3.3.1 培养基的制备
细菌培养基:牛肉膏3g、蛋白胨10g、NaCl 5g、琼脂15~20g,水1000mL,pH7.0~7.2;霉菌培养基:马铃薯(切碎成块)200g、葡萄糖20g、琼脂15~20g,水1000mL,pH值自然;酵母菌培养基:葡萄糖20g、蛋白胨10g、酵母膏10g、琼脂15~20g,水1000mL,pH值自然。
1.3.3.2 供试菌种的活化及菌悬液的制备
预先将7种供试菌种接入相对应的斜面培养基上进行活化,细菌置37℃恒温培养箱中培养24h,真菌置28℃恒温培养箱中培养48h。然后分别挑取1环已活化好的菌种放入9mL无菌水中,振荡摇匀,制成一系列菌悬液,浓度约为106~108CFU/mL,备用。
1.3.3.3 最小抑制浓度(MIC)的测定[14]
采用菌落直接观察法和琼脂扩散滤纸片法。
菌落直接观察法:无菌条件下,向平皿中分别移取不同质量浓度的蓝莓多糖稀释液各1.0mL,再分别移取各菌悬液0.2mL,然后倒入相应温度在55℃左右的固体培养基(每次实验平皿中培养基倒入量应保持一致),充分混匀,待其冷却凝固后,倒置于恒温培养箱中,在适宜的温度下培养,每个质量浓度做3个重复。取出,观察,以不长菌的最低质量浓度为最小抑制浓度。
琼脂扩散滤纸片法:将定性滤纸加工成9mm的圆形滤纸片,放入干燥的平皿中,121℃干热灭菌20min后,浸入不同质量浓度的蓝莓多糖供试液,使其充分吸收,备用。将已灭菌的固体培养基熔化后倒入平皿中,待冷却凝固后,用取液器分别加入0.4mL供试菌,然后用无菌涂布器涂布均匀,用无菌镊子夹取浸泡处理过的滤纸片贴在上述含菌平皿中,每一浓度的滤纸片间隔一定距离,并以浸泡过无菌水的滤纸片作为对照。每个平皿贴5片,每一种菌种做3个重复。然后将各平皿倒置于适宜温度下进行培养。取出,测量抑菌圈的直径。
2 结果与分析
2.1 蓝莓多糖样品的制备
利用水提醇沉法从蓝莓中提取多糖,再经初步纯化后得到蓝莓多糖样品,进行全波长扫描见图1。

图1 蓝莓多糖全波长扫描Fig.1 Full wavelength scanning spectrum of blueberry polysaccharides
从图1可知,蓝莓多糖样品在280、260nm波长处无吸收,表明其不含蛋白、多肽及核酸。在520nm波长处无吸收,表明其不含花色苷等色素类物质。
2.2 蓝莓多糖对·OH清除作用的测定
·OH被认为是活性最强的自由基,也是毒性最大的自由基,辐射损伤等物理、化学因子都会促进其形成,是造成生物有机体过氧化损伤的主要因素。有研究表明,·OH是通过H2O2与金属离子氧化还原反应产生的,因此可以通过螯合金属离子或使金属离子无反应来清除·OH[15]。VC为已知的·OH清除剂,因此以VC为对照品和蓝莓多糖进行比较,结果见图2。

图2 蓝莓多糖和VC对·OH 清除作用的比较Fig.2 Comparison of hydroxyl radical scavenging capacity between blueberry polysaccharides and VC
由图2可知,在实验质量浓度范围内,蓝莓多糖与对照品VC对·OH都有较强的清除作用,清除率随着二者的质量浓度增加而提高。研究结果还表明,质量浓度0~1mg/mL范围内,二者对·OH的清除作用相差不大;质量浓度0~5mg/mL范围内,二者对·OH的清除作用随质量浓度的增加迅速提高;质量浓度1~25mg/mL范围内,蓝莓多糖的作用效果明显大于对照品VC。对照品VC对清除·OH 50%所对应的质量浓度IC50为5mg/mL,而蓝莓多糖的IC50为2mg/mL。
2.3 蓝莓多糖对O2·清除作用的测定
O2·是生物体内第一个氧自由基,是其他活性氧的前体,对生物体内细胞、酶、DNA及不饱和脂肪酸等物质均能产生影响。以VC为对照品,比较二者对O2·的清除作用。以清除率和质量浓度为横纵坐标作图,结果见图3。

图3 蓝莓多糖和VC对O2·清除作用的比较Fig.3 Comparison of superoxide anion radical scavenging capacity between blueberry polysaccharides and VC
由图3可知,在实验浓度范围内,对照品VC对O2·有较强的清除作用,而蓝莓多糖对O2·几乎没有作用效果。
2.4 蓝莓多糖对DPPH自由基清除作用的测定

图4 蓝莓多糖和VC对DPPH自由基清除作用的比较Fig.4 Comparison of DPPH radical scavenging capaciy between blueberry polysaccharides and VC
清除DPPH自由基的能力可以用来衡量天然抗氧化剂的抗氧化活性。自由基清除剂对DPPH自由基的清除程度与其所接受的电子数成定量关系,也就是说和抗氧化剂的供氢能力有关[16]。图4结果表明,VC对DPPH自由基有很强的清除作用,0.1mg/mL的VC清除率即可达到90%以上。在实验质量浓度范围内,蓝莓多糖对DPPH自由基的清除率随其质量浓度的增加而提高。质量浓度0~1mg/mL范围内,蓝莓多糖对DPPH自由基的清除率迅速提高;质量浓度1~4mg/mL范围内,清除率呈现平稳提升的趋势;质量浓度4~12mg/mL范围内,清除率再次迅速提高。从实验数据可求得蓝莓多糖对DPPH自由基 50%清除所对应的质量浓度IC50为7mg/mL。
2.5 蓝莓多糖的MIC测定

表1 菌落生长情况Table 1 Growth situation of different microorganisms in the presence of blueberry polysaccharides
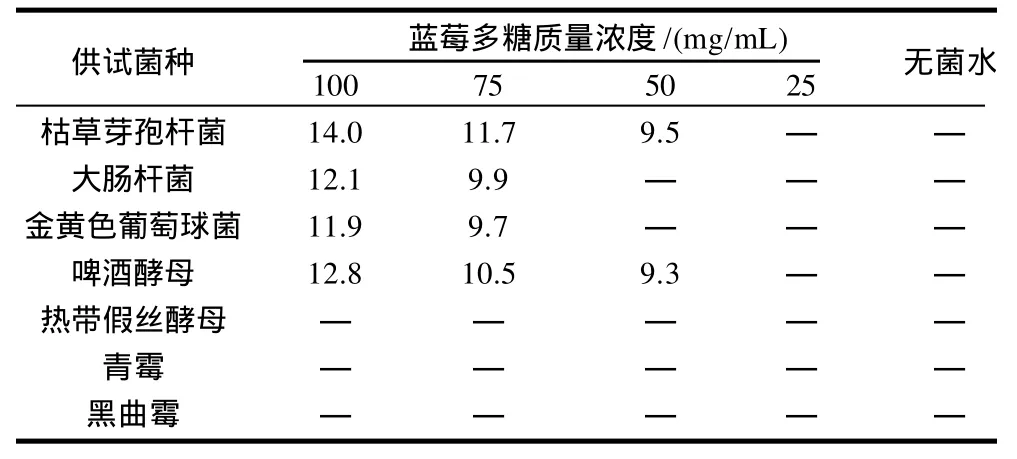
表2 蓝莓多糖对各菌种的抑菌圈直径Table 2 Inhibitory zone diameters of blueberry polysaccharides against different microorganisms mm
由表1、2可知,蓝莓多糖对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌、啤酒酵母均有一定的抑制效果,且作用相当;随着多糖质量浓度的增大,抑制作用增强;最小抑制浓度MIC在50~75mg/mL之间。蓝莓多糖对啤酒酵母有较好的抑制效果,而对热带假丝酵母无抑制作用,这说明蓝莓多糖对酵母的抑制具有选择性。同时,蓝莓多糖对青霉和黑曲霉也没有抑制作用。
3 结 论
3.1 蓝莓多糖的抗氧化性
蓝莓多糖对·OH和DPPH自由基有较强的清除作用,清除率随其质量浓度的增加而提高,且清除率50%所对应的质量浓度IC50分别为2mg/mL和7mg/mL。尤其值得注意的是,蓝莓多糖对·OH的清除作用明显强于VC。但蓝莓多糖对几乎没有作用效果。多糖在生物体内发挥作用更为复杂,它可能直接参与猝灭自由基的途径外,还可能与通过调节机体内内源性抗氧化剂的活性相关[17]。因此,蓝莓多糖的体内生物功效仍需进一步探索。
3.2 蓝莓多糖的抑菌作用
多糖对各类微生物的生长有不同程度的抑制作用,或者说生长拮抗。但多糖抑菌作用的机制还不十分明确。实验表明,蓝莓多糖的抑菌作用还是相对较弱的。对常见的细菌有一定的抑制作用,对酵母的抑制作用具有选择性,对供试的两种常见的霉菌没有抑制效果。对同一菌株而言,抑菌效果随多糖质量浓度的增大而显著。蓝莓多糖对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌、啤酒酵母的最小抑制浓度MIC在50~75mg/mL之间。由于菌种所限,本实验仅对常见的7种菌进行了抑菌实验,因此蓝莓多糖对其他菌种的抑制作用还有待研究。
[1] 胡雅馨, 李京. 蓝莓的保健作用及各国栽培发展趋势[J]. 食品科学,2006, 27(7):600-601.
[2] 李颖畅, 孟宪军. 蓝莓中主要物质含量及处理方式对花色苷的影响[J]. 食品工业科学, 2008, 29(5):163-164.
[3] 吕磊. 大枣多糖的提取分离与脱色研究[D]. 西安:西北大学, 2003.
[4] 李艳红. 山楂多糖的提取、分离纯化及结构研究[D]. 太原:山西大学, 2006.
[5] 王多宁, 张小莉, 杨颖. 百合多糖对羟自由基的清除作用[J]. 陕西中医学院学报, 2006, 29(4):53-55.
[6] 金鸣, 蔡亚欣, 李金荣. 邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J]. 生物化学与生物物理进展, 1996, 23(6):553-555.
[7] 朱金艳. 蓝莓多糖性质及结构初步研究[D]. 沈阳:沈阳农业大学,2009.
[8] HALLOIWELL B, GUTTERIDGE J M C. Free radical in biology and meidicine[M]. London:Oxford Clarendon Press, 1989.
[9] 颜璐璐. 海萝多糖的提取分离及其生理活性的研究[D]. 汕头:汕头大学, 2005.
[10] BEAUCHAMP C, FRIDOVICHET I. Superoxide dismutase improved assays and assay applicable to acrylamid gels[J]. Anal Biochem, 1971,44:276-287.
[11] YINRONG L U, YEAPFOO L. Antioxidant and radical scabenging activities of polyphenols from apple pomace[J]. Food Chemistry, 2000,68:81-85.
[12] EONG L P, SHUI G. An investigation of antioxidant capacity of fruits in Singapore markets[J]. Food Chemistry, 2002, 76:69-75.
[13] 李雷. 茶叶多糖食品功能性研究[D]. 青岛:中国海洋大学, 2006.
[14] 王忠民, 王跃进, 周鹏. 葡萄多糖抑菌特性的研究[J]. 食品与发酵工业, 2005, 31(1):77-79.
[15] MILLER N J, SAMPSON J, CANDELASI P, et al. Antioxidant activities of carotenes and xanthophylls[J]. FEBS Letters, 1996, 384:240-242.
[16] RICE-TVANTS C, MILLER N J, PAGANGA G. Antioxidante properties of phenolic compounds[J]. Trends in Plant Science, 1997, 2:152-159.
[17] 曾凯宏, 明建, 曾凯芳. 真菌多糖的结构与功能[J]. 食品科技, 2001(4):66-68.
Antioxidant and Antimicrobial Activities of Blueberry Polysaccharides
MENG Xian-jun,LIU Xiao-jing,SUN Xi-yun,ZHANG Qi,PAN Xuan
(College of Food, Shenyang Agricultural University, Shenyang 110866, China)
TQ929.2
A
1002-6630(2010)17-0110-05
2010-04-01
孟宪军(1960—),男,教授,博士,研究方向为果蔬贮藏与加工。E-mail:mengxjsy@126.com
