巴西蕉花蕾不同部位提取物的抗氧化活性研究
2010-10-19盛占武唐艳平陈昱洁张伟敏马蔚红金志强
盛占武,唐艳平,陈昱洁,张伟敏,马蔚红,金志强,3,*
(1.中国热带农业科学院海口实验站,海南 海口 570102; 2.海南大学食品学院,海南 海口 570228;3.中国热带农业科学院热带生物技术研究所,海南 海口 571107)
巴西蕉花蕾不同部位提取物的抗氧化活性研究
盛占武1,唐艳平2,陈昱洁2,张伟敏2,马蔚红1,金志强1,3,*
(1.中国热带农业科学院海口实验站,海南 海口 570102; 2.海南大学食品学院,海南 海口 570228;3.中国热带农业科学院热带生物技术研究所,海南 海口 571107)
评价巴西蕉花蕾不同部位的化学组成和乙醇提取物的抗氧化活性。结果表明:3个部位中花的总黄酮含量最高(5.9mg/100g),苞片的总酚含量最高(14.91mg/g),生长点的皂苷含量最高(14.77mg/100g)。3部位提取物均具有一定的清除DPPH自由基、ABTS+自由基、还原力和脂质过氧化抑制作用,且清除率和质量浓度间存在剂量依赖关系。其中,苞片具有最强的清除DPPH自由基、ABTS+·、还原力和抑制脂质过氧化的作用,生长点次之;3部位乙醇提取物的还原力均比没食子酸强。
巴西蕉;花蕾;化学组成;提取物;抗氧化
Abstract:The 70% ethanol extracts from three different tissues of banana (MusaAAA Cavendish subgroup cv. Brazil)inflorescence including petal, bract and growth point were assessed for their free radical scavenging and anti-lipid peroxidation activities and reducing power. Among the three tissues of banana inflorescence, the highest contents of total flavonoids (5.9 mg/100 g), total phenolics (14.91 mg/g) and saponins (14.77 mg/100 g) were found in petals, bracts and growth points, respectively.All the extracts from them could scavenge DPPH and ABTS+free radicals and protect against lipid peroxidation and had pronounced reducing power in a concentration-dependent fashion and the extract from banana bracts had the strongest ability to scavenge DPPH and ABTS+free radicals and reducing power and anti-lipid peroxidation activity, followed by that from banana growth points. Furthermore, compared with galic acid, all the extracts from banana petal, bract and growth point presented higher reducing power.
Key words:MusaAAA Cavendish subgroup cv. Brazil;inflorescence;chemical composition;extract;antioxidation中图分类号:TS201.4 文献标识码:A 文章编号:1002-6630(2010)17-0098-05
抗氧化与人类健康密切相关,正常人体的抗氧化系统处于一种平衡状态[1],但是随着营养缺失、环境污染及抽烟、吸毒等行为,导致了人体自由基增加,抗氧化平衡状态被破坏,出现脂质过氧化、抗氧化酶活力降低等现象,致使体细胞损伤,从而引发心脏病、癌症、衰老等多种疾病[2]。抗氧化剂是食品、医药和日化行业不可缺少的物质。研究表明,一些人工合成的抗氧化剂,如2,6-二叔丁基-4-甲基苯酚(BHT)和丁基羟基茴香醚(BHA)等,能够抑制人体的呼吸酶活性,使用过量甚至可致畸、致癌[3-4]。因此,高效、安全的天然抗氧化剂日益成为研究热点。
香蕉(Musa accminataCoLLa)是重要的热带水果,然而在香蕉生产的过程中产生了诸如香蕉花、茎叶等大量的废弃物,其产量与果实几乎等量,如何开展香蕉废弃物的综合利用是目前香蕉产业亟待解决的问题之一[5]。香蕉花是香蕉生产过程中的副产物,在许多亚洲国家如:斯里兰卡、马来群岛、印尼、菲律宾、老挝、缅甸等国将香蕉花作为蔬菜,通常以煮食和油炸方式食用[3]。除鲜食外,香蕉花可加工成脱水蔬菜,泡菜和罐藏食品[6-7]。在印度,香蕉花被作为提高女性母乳和减缓痛经的药材食用已有上千的历史。此外,香蕉花均有一定的降血糖功效[8-9]。经前期的研究结果发现,巴西蕉花蕾不同部位具有一定的营养价值[10],具备开发的潜质,然而针对其抗氧化方面的研究国内外鲜见报道。本研究以香蕉花蕾为研究对象,通过对其不同部位提取物的抗氧化活性研究,旨在充实香蕉花蕾营养学资料,为香蕉花蕾食品及其饲料的开发参考。
1 材料与方法
1.1 材料、试剂与仪器
选用海南省大面积种植的巴西蕉花蕾作为实验材料。
二苯代苦味酰基自由基(DPPH)、ABTS(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid)、儿茶素、薯蓣皂素 Sigma公司;铁氰化钾、三氯化铁、磷酸氢二钠、碳酸钠、抗坏血酸、巴比妥酸(Tris)均为国产分析纯;其余试剂均为国产化学纯。
2022V1恒温干燥箱 上海实验总厂;冷冻干燥机北京四环科学仪器厂;FW177型中草药粉碎机 天津市泰斯特仪器有限公司;RF-UV1240紫外-可见分光光度计 日本岛津公司;所用试剂均为国产分析纯。
1.2 香蕉花蕾各部位提取液的制备
新鲜香蕉花蕾采摘后,手工剥离花、苞片和生长点,清洗沥干、冷冻干燥、粉碎至25目,料液比(1:10),用70%的乙醇在75℃的条件下回流提取2.5h,浓缩干燥。然后用70%的乙醇配制成不同浓度的粗提物溶液。
1.3 化学成分分析
1.3.1 总酚含量的测定
多酚含量采用Folin-Ciocalteus[11]法测定,根据酚类化合物在碱性条件下可以将钨钼酸还原,生成蓝色的化合物,颜色的深浅与酚含量呈正相关,在760nm波长处测吸光度。
标准曲线的绘制:精确称取0.100g没食子酸,用蒸馏水溶解、定容至100mL,溶液质量浓度为1000mg/L。分别吸取0.0、1.0、2.0、3.0、4.0、5.0mL 至100mL容量瓶中,用蒸馏水定容,所得没食子酸标准溶液的质量浓度分别为0、10、20、30、40、50mg/L。分别吸取1mL上述质量浓度的没食子酸标准溶液于25mL比色管中,加入5.0mL水、1mL Folin-酚显色剂和3mL 7.5%碳酸钠溶液,摇匀,室温下避光显色反应1h,用紫外分光光度计在760nm波长处测定吸光度[12]。以吸光度为纵坐标,没食子酸的质量浓度为横坐标,绘制标准曲线。
1.3.2 VE含量的测定
参照文献[13]方法,液相色谱测定的VE含量为α、γ、δ型V E量的总和。
1.3.3 总皂苷含量的测定
参照文献[14]方法,准确称量0.5g的香蕉花样品,添加10mL 80%的甲醇,磁力搅拌24h,离心,上清液置于25mL容量瓶中 ,残渣用10mL 80%的甲醇洗涤两遍,合并洗涤液后定容,以薯蓣皂素作为标准物进行测定。
1.3.4 总黄酮含量的测定
参照文献[15]方法 ,以儿茶素作为标准物,在波长510nm处用紫外分光光度计测定。
1.4 抗氧化活性测定方法
1.4.1 清除DPPH自由基能力测定
参照参考文献[16]方法,移取3mL浓度为60 μmol/L 的DPPH溶液于多个比色管中,然后分别加入1mL质量浓度分别为4、8、12、16、20μg/mL的提取液溶液,使其充分混匀,室温静置15min,在波长517nm处测定其吸光度,记为样品吸光度A1。以3mL DPPH溶液与1mL 70%乙醇溶液混合,在波长517nm处测定其吸光度,记为空白吸光度A0。自由基的清除率按式(1)计算。
1.4.2 ABTS+·清除能力测定
参照参考文献[17]方法,将ABTS用去离子水稀释成 7mmol/L。将 5mL 的 7mmol/L ABTS 和 500μL 的2.45mmol/L 过硫酸钾混合,在室温、避光静置过夜,形成ABTS+·储备液,使用前用70%乙醇稀释成工作液,使其在室温下于734nm 波长处的吸光度为0.70±0.02,记为空白吸光度A0。分别取3mL ABTS+·储备液移至比色管中,然后分别加入100μL质量浓度分别为1、2、3、4、5μg/mL的粗提物溶液,使其充分混匀,室温静置10min,在波长517nm处测定其吸光度,记为样品吸光度A1。自由基的清除率按式(2)计算。
1.4.3 Fe3+还原能力测定
参照参考文献[18]方法,移取200μL 不同质量浓度(4、8、12、16、20μg/mL)样品液于试管中,加入1mL磷酸盐缓冲溶液(0.2moL/L,pH6.6),1mL 质量分数为1%的铁氰化钾溶液,混合后50℃水浴20min,加入体积分数为10%的三氯乙酸1mL,4000r/min 常温离心10min, 取上清夜2mL,加入2mL 蒸馏水和质量分数为0.1%的三氯化铁400μL,混匀后在700nm波长处测定吸光度,以没食子酸作对照。
1.4.4 脂质过氧化抑制实验
参照参考文献[19]方法,脂质体的制备:称取20mg卵磷脂溶入5mL 0.05moL/L(pH7.4)的磷酸缓冲液中,充氮封口,在超声发生器中超声处理30min,所得液体为单层小体积脂质体,置于0℃条件下保存。
过氧化脂质的测定:移取100μL脂质体液于试管中,与100μL不同质量浓度(20、30、40、50、60μg/mL)的样品液混合后,加入50μL 50 mmol/L亚硫酸铁溶液,再加入3mL磷酸盐缓冲溶液(0.05moL/L,pH7.4)后为样品管,模型管为样品管的制备过程中不加样品溶液,模型和样品空白管为模型和样品管制备过程中不加亚硫酸铁溶液,然后将空白管、模型管、样品管37℃水浴40min,每5min振摇一次,然后加1mL 10%三氯乙酸和1mL 质量分数为0.8%巴比妥酸,混合置100℃水浴15min,冷却后以转速5000r/min离心10min,取上清液在波长532nm处测定吸光度,抑制率按式(3)计算。

1.5 数据处理
2 结果与分析
2.1 没食子酸标准曲线
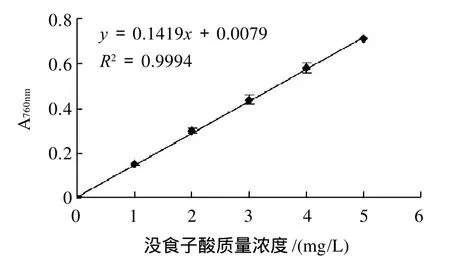
图1 没食子酸的标准曲线Fig.1 Standard curve of galic acid
准确称取一定量的没食子酸标准品,配制成标准溶液。在760nm波长处测定吸光度,以没食子酸标准品的质量浓度为横坐标,以其吸光度为纵坐标绘制标准曲线,并求出相应的回归方程,其标准曲线见图1。由图1可知,求得没食子酸的线性回归方程为y=0.1419x+0.0079,R2=0.9994,表明本方法在没食子酸质量浓度为0~5mg/L时具有良好的线性关系。
2.2 巴西蕉花蕾不同部位化学成分分析

表1 巴西蕉花蕾不同部位化学成分分析Table 1 Chemical composition of different tissues of Brazilian banana inflorescence
由表1可知,花中的总黄酮含量明显高于生长点和苞片(P<0.05),VE的含量和生长点相同,而总皂苷的含量明显低于生长点和苞片(P<0.05)。巴西蕉花蕾3个部位提取物中总酚含量存在明显的差异(P<0.05),其中以苞片中的总酚含量最高(14.91mg/g),生长点次之(13.3mg/g),花的含量最低(10.20mg/g)。
2.3 清除DPPH自由基能力测定结果
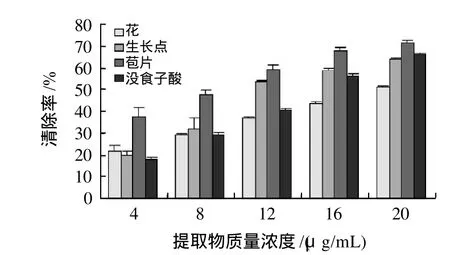
图2 提取物对DPPH自由基的清除能力Fig.2 DPPH radical scavenging capacities of the extracts from different tissues of Brazilian banana inflorescence
为了评价抗氧化剂的抗氧化性能和自由基的清除能力,也常选择清除率为50%或吸光度为0.5时抗氧化剂的质量浓度(EC50)作为评价指标,EC50越小,抗氧化剂清除自由基的能力越强[16]。根据清除率与抗氧化剂质量浓度的线性关系:花为y=7.268x+14.80,R2=0.999;生长点y=11.54x+10.99,R2=0.930;苞片y=8.747x+30.55,R2=0.968;没食子酸y=12.33x+4.943,R2=0.995;通过线性方程计算得出花、生长点、苞片和没食子酸的EC50分别为:4.84、3.38、2.22、3.65μg/mL。由图2可知巴西蕉花蕾不同部位乙醇提取物对DPPH自由基均有一定的清除能力,在实验质量浓度范围内呈明显量效关系。3个部位中以苞片对DPPH自由基的清除能力最强,生长点次之,花最弱。
2.4 ABTS+·清除能力测定
根据清除率与抗氧化剂质量浓度的线性关系:花为y=10.21x+7.567,R2=0.994;生长点y=17.27x+11.77,R2=0.980;苞片y=16.67x+15.37,R2=0.974;没食子酸y=15.84x+10.95,R2=0.989;通过线性方程计算得出花、生长点、苞片和没食子酸的EC50分别为:4.16、2.21、2.08、2.47μg/mL,从而可以得出:巴西蕉花蕾的不同部位和没食子酸都具有一定的清除ABTS+·的能力,且随着质量浓度的增加其清除能力不断增强。3个部位中以苞片的清除能力最强、生长点次之、花最弱,苞片和生长点提取物对ABTS+·的清除能力比没食子酸强。
图3 提取物对ABTS+·的清除能力Fig.3 ABTS+radical scavenging capacities of the extracts fromdifferent tissues of Brazilian banana inflorescence
2.5 Fe3+还原能力
图4 提取物总还原力Fig.4 Reducing powers of the extracts from different tissues of Brazilian banana inflorescence
还原力测定可以检验样品是否为良好的电子供体。通常还原力强的物质,可以提供更多的电子,其供应的电子除了可使Fe3+还原为Fe2+外,还可以参与自由基反应,使自由基形成稳定的物质[18]。以没食子酸为参照测定巴西蕉花蕾不同部位醇提物的总还原力(图4)。根据700nm波长处的吸光度与抗氧化剂质量浓度的线性关系:花为y=0.108x+0.269,R2=0.995;生长点y=0.122x+0.277,R2=0.997;苞片y=0.075x+0.365,R2=0.960;没食子酸y=0.045x+0.138,R2=0.997;通过线性方程计算得出花、生长点、苞片和没食子酸的EC50分别为:2.14、1.83、1.8、8.04μg/mL。还原力随着提取物质量浓度的增加而升高,且在相同质量浓度下,3个部位的还原力均远远高于没食子酸。3个部位中以苞片的还原能力最强,生长点次之,花最弱。
2.6 脂质过氧化抑制实验
以没食子酸为对照,测定巴西蕉花蕾不同部位提取物对脂质过氧化的抑制作用(图5)。随着提取物质量浓度的增加,对脂质过氧化的抑制能力不断提高。根据清除率与抗氧化剂质量浓度的线性关系:花为y=9.972x-4.309,R2=0.975;生长点y=9.062x+25.35,R2=0.998;苞片y=9.162x+37.25,R2=0.973;没食子酸y=8.454x+25.63,R2=0.954;通过线性方程计算得出花、生长点、苞片和没食子酸的EC50分别为:5.45、2.72、1.39、2.88μg/mL。3个部位中除花外,苞片和生长点对脂质过氧化的抑制能力均比没食子酸高,其中以苞片的抑制能力最高。

图5 提取物抑制脂质过氧化能力Fig.5 Anti-lipid peroxidation activities of the extracts from different tissues of Brazilian banana inflorescence
3 结 论
本研究证明,在巴西蕉花蕾3个不同的部位中,花的总黄酮含量最高(5.9mg/100g);苞片的总酚含量最高(14.91mg/g),生长点的皂苷含量最高(14.77mg/100g),花和生长点的VE含量相等(0.87mg/100g)。巴西蕉花蕾不同部位乙醇提取物的抗氧化实验表明:苞片具有最强的清除DPPH自由基、ABTS+·、还原力和抑制脂质过氧化的作用,生长点次之;3部位乙醇提取物的还原力均比没食子酸强。本研究对巴西蕉花蕾的不同部位的抗氧化活性进行了研究,但是对乙醇提取物中的化学成分及其具体抗氧化机制尚未明确,而且其他溶剂提取物的抗氧化活性也有待于进一步研究。
[1] 彭永宏, 曾佑炜, 徐良雄, 等. 花卉的抗氧化作用与保健功效[J]. 华南师范大学学报:自然科学版, 2004(1):136-141.
[2] ARUOMA O I. Free radicals, oxidative stress, and antioxidants in human health and disease[J]. Journal of the American Chemists Society,1998, 75(2):192-212.
[3] 赵振国. Langmuir方程在稀溶液吸附中的应用[J]. 大学化学, 1999,14(5):7-11.
[4] 刘元法, 裘爱泳, 王兴国. Freundlich方程在不同吸附剂的油脂脱色体系中的应用[J]. 食品与生物技术学报, 2007, 26(1):1-4.
[5] 杨培生, 陈业渊, 黎光华, 等. 我国香蕉产业:现状、问题与前景[J].果树学报, 2003, 20(5):415-420.
[6] WICKRAMARACHCHI K S, RANAMUKHAARACHCHI S L. Preservation of fiber-rich banana blossom as a dehydrated vegetable[J]. Science Asia, 2005, 31:265-271.
[7] MONTATIP Y, KANJANARAT T, CHIDCHOM H, et al. Processing of canned banana flower and heart of pseudostem[J]. Kasetsart Journa,1995, 29:55-63.
[8] PARI L, MAHESWARI J U. Hypoglycaemic effect ofMusa sapientumL. in alloxan-induced diabetic rats[J]. Journal of Ethnopharmacol, 1999,68(1/3):321-325.
[9] PARI L, UMAMAHESWARI J. Antihyperglycaemic activity ofMusa sapientumflowers:effect on lipid peroxidation in alloxan diabetic rats[J].Phytotherapy Research, 2000, 14(2):136-138.
[10] 盛占武, 马蔚红, 高锦合, 等. 巴西蕉花蕾不同部位营养成分分析及评价[J]. 食品科学, 2010, 31(7):263-265.
[11] AMIN I, NORAZAIDAH Y, HAINIDA K I E. Antioxidant activity and phenolic content of raw and blanchedAmaranthusspecies[J]. Food Chemistry, 2006, 94:47-52.
[12] 李静, 聂继云, 李海飞, 等. Folin-酚法测定水果及其制品中总多酚含量的条件[J]. 果树学报, 2008, 25(1):126-131.
[13] AHN D U, KAWAMOTO C, WOLFE F H, et al. Dietary alpha-linolenic acid and mixed tocopherols, and packaging influence lipid stability in broiler chicken breast and leg muscle tissue[J]. Journal of Food Science, 1995, 60(5):1013-1018.
[14] BACCOU J C, LAMBERT F, SAMVAIRE Y. Spectrophotometric method for the determination of total steroidal sapogenin[J]. Analyst,1977, 102(1215):458-465.
[15] KIM D O, JEONG S W, LEE C Y. Antioxidant capacity of phenolic phytochemicals from various cultivars of plums[J]. Food Chemistry,2003, 81(3):321-326.
[16] 李姣娟, 黄克瀛, 龚建良, 等. 油茶叶乙醇提取物清除DPPH自由基作用研究[J]. 林产化学与工业, 2008, 28(2):82-86.
[17] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biol Med, 1999, 26:1231-1237.
[18] BARROS L, BAPTISTA P, FERREIRA I C F R. Effect ofLactarius piperatusfruiting body maturity stage on antioxidant activity measured by several biochemical assays[J]. Food and Chemical Toxicology, 2007,45:1731-1737.
[19] CERVATO C, CARABELLI M, GERVASIO S, et al. Antioxidant properties ofOregano(Origanum vulgare) leaf extracts[J]. J Food Biochem, 2000, 24:453-465.
Antioxidant Activity of Ethanol Extracts from Different Tissues of Banana (MusaAAA Cavendish subgroup cv.Brazil) Inflorescence
SHENG Zhan-wu1,TANG Yan-ping2,CHEN Yu-jie2,ZHANG Wei-min2,MA Wei-hong1,JIN Zhi-qiang1,3,*
(1. Haikou Experimental Station, Chinese Academy of Tropical Agricultural Sciences, Haikou 570102, China;2. College of Food Sciences, Hainan University, Haikou 570228, China;3. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences,Haikou 571107, China)
2010-05-24
海南省自然科学基金项目(309043);农业部“948”项目(2010-Z7);中央级科研院所基本科研业务费重点项目(ITBBKF2008-2);2010年农业部南亚办热作专项
盛占武(1981—),男,助理研究员,硕士,研究方向为天然产物。E-mail:shengzhanwu@yahoo.com.cn
*通信作者:金志强(1962—),男,研究员,博士,研究方向为采后分子生物学。E-mail:zhiqiangjin2001@yahoo.com.cn
