血管性血友病因子裂解蛋白酶的稳定表达及其活性检测
2010-10-16马珍妮董宁征张敬宇苏健汪安友阮长耿
马珍妮,董宁征,张敬宇,苏健,汪安友,阮长耿
苏州大学附属第一医院 江苏省血液研究所 卫生部血栓与止血重点实验室,苏州 215006
血管性血友病因子裂解蛋白酶的稳定表达及其活性检测
马珍妮,董宁征,张敬宇,苏健,汪安友,阮长耿
苏州大学附属第一医院 江苏省血液研究所 卫生部血栓与止血重点实验室,苏州 215006
本研究旨在得到重组的血管性血友病因子裂解蛋白酶(ADAMTS13),进一步研究其在血栓止血中的作用。利用脂质体将编码ADAMTS13全长序列的重组质粒pSecTag-ADAMTS13转染Hela细胞,用潮霉素(Hygromycin-B)筛选得到阳性克隆细胞株,并扩大培养,收集上清。利用 Ni-NTA琼脂糖柱、梯度咪唑淋洗法纯化蛋白,SDS-PAGE和Western blotting鉴定纯化产品纯度和免疫学活性,采用GST-His双抗夹心法测定蛋白剪切活性。结果显示,成功获得一株能恒定分泌重组ADAMTS13蛋白的细胞株ADAMTS2-4,每1 L培养上清可纯化得到5.8 mg重组蛋白。Western blotting结果显示,ADAMTS13多抗能与重组蛋白在190 kDa处显单一条带,并且蛋白具有6.4 U/mL的剪切活性(每毫升正常人混合血浆中ADAMTS13活性为1 U)。重组蛋白具有较好的免疫原活性和酶活性,为进一步研究ADAMTS13作用机理和运用奠定了良好的基础。
血管性血友病因子裂解蛋白酶,真核表达,重组蛋白
Abstract:This study was to acquire recombinant protein of von Willebrand factor cleaving protease(ADAMTS13, a disintegrin and metalloprotease with a thromboSpondin type 1 motifs 13), for further studies on its biological function in thrombosis and hemostasis.We transfected the Hela cells with the plasmid pSecTag-ADAMTS13 by lipofectamine.A positive cell cloning was selected by hygromycin-B.The recombinant protein was purified with Ni-NTA agarose column by gradient imidazole.The purity and immune activity of purified products were identified with SDS-PAGE and Western blotting respectively.We also measured the enzymatic activity of recombinant protein(rADAMTS13)by GST-His two-site ELISA assay.The results showed that we successfully constructed Hela cells ADAMTS2-4 which expressed high level of rADAMTS13.We received about 5.8 mg recombinant protein in culture supernantants per liter purified with Ni-NTA column.The protein formed a main lane at the position of 190 kDa with SDS-PAGE and reacted with polyclonal antibody against ADAMTS13 by Western blotting.The amount of rADAMTS13 activity was 6.4 U/mL, according to the normal plasma defined as 1 U/mL.In conclusion, rADAMTS13 protein had high purity, immune activity and good enzymatic activity, which could establish the experimental foundation for further research on biological function and mechanism of this unique metalloprotease.
Keywords:von Willebrand factor cleaving protease, eukaryotic expression, recombinant protein
血管性血友病因子裂解蛋白酶(a disintegrin-like and metalloprotease with thrombospondin type 1 motif,ADAMTS13,也称VWF-CP)是1996年发现的一种血浆金属蛋白酶,它主要将血浆中大分子量的血管性血友病因子(von Willebrand factor,VWF)多聚体降解成为黏附活性低的小分子片段[1]。VWF是血浆中以多聚体形式存在的糖蛋白,在血管壁发生损伤时,对血小板的黏附与聚集起到至关重要的作用[2]。内皮细胞和巨核细胞内主要合成的是大分子量的VWF多聚体(分子量超过20 000 kDa),分泌进入血液循环。VWF多聚体的黏附活性取决于分子大小,尤其是超大分子 VWF(UL-VWF)在高剪切力的条件下诱发血小板过度聚集。UL-VWF通常能被ADAMTS13切割成更小的片段,以抑制血小板性血栓形成。当ADAMTS13活性缺失或存在抗体时,UL-VWF得以继续残留在血液循环中,从而引发血栓性血小板减少性紫癜(TTP)[3-5]。研究发现,ADAMTS13的基因位于人9号染色体长臂(9q34),由29个外显子组成[6]。cDNA含4597 bp以及一个多聚腺苷酸尾(PolyA tail),开放阅读框为4284 bp(109~4392 nt),编码1427个氨基酸。人ADAMTS13具有 9个结构功能域,依次为信号肽、前导肽、金属蛋白酶域、去整合素域、凝血酶敏感蛋白1(TSP1)域、富半胱氨酸域、间隔区、7个TSP1重复基序和2个CUB域[7]。
本研究拟在人宫颈癌(Hela)细胞株内获得稳定表达高水平的具有较高活性的 rADAMTS13蛋白,并且目的蛋白可以分泌到上清中,在Hela细胞培养上清内能大规模培养、生产和纯化,这为进一步研究 ADAMTS13的生物学功能以及药物的开发奠定了基础。
1 材料与方法
1.1 材料
1.1.1 细胞和质粒
人宫颈癌细胞株 Hela为本室保存。质粒pSecTag-ADAMTS13由美国 Baylor医学院 Dong Jingfei教授惠赠[8],该质粒是由ADAMTS13全长基因(GenBank Accession No.NM_139025.3)引入Hind III 和Xho I两个限制性酶切位点,重组构建入真核表达载体pSecTag2 A(Invitrogen公司),测序结果与目的基因序列完全相同。
1.1.2 主要试剂
质粒中抽试剂盒和Ni-NTA琼脂糖购自Qiagen公司。Lipofectamine 2000为Invitrogen公司产品。潮霉素(Hygromycine B)购自 Calbiochem 公司。ADAMTS13兔抗人多抗购自Abcam公司。GST鼠抗人单抗和辣根过氧化物酶标记的 6×His-Tag单抗(HRP-Anti-His)、羊抗鼠 IgG(HRP-GAM-IgG)、羊抗兔 IgG(HRP-GAR-IgG)购自 Beckman-Coulter公司。硝酸纤维素膜为PALL公司产品。ECL购自上海普飞生物技术有限公司。其他各种试剂和材料均为可获得的最高标准产品。
1.2 方法
1.2.1 真核表达载体pSecTag-ADAMTS13的抽提、鉴定和纯化
将 pSecTag-ADMATS13转化入大肠杆菌Escherchia coli TG1中,涂板,挑取克隆,37℃扩增培养,用质粒中抽试剂盒抽提质粒(按试剂盒说明操作)。质粒经Hind III和Xho I双酶切鉴定。
1.2.2 阳离子脂质体介导的Hela细胞的转染
Hela细胞培养:在六孔板中接种 Hela细胞(2×105/mL)至 40%~60%汇合。转染制备:A液:用无血清1640培养基稀释10 μg 质粒至250 μL;B液:用无血清1640培养基稀释10 μL Lipofectamine 2000至 250 μL;轻轻混合 A、B 液,室温放置 15 min。转染准备:用无血清1640培养基漂洗细胞1次,再加入1640培养基。转染:将待转染混合物缓缓加入带转染细胞中,摇匀,37℃、5% CO2温箱培养6 h,吸除上清,换入完全培养基继续培养18 h。阳性克隆的筛选:将转染的细胞消化后,接种至35 mm的培养皿中(2×103/mL),换入筛选液(含 400 μg/mL Hygromycine B的10%小牛血清的1640培养基),至细胞大部分死亡后换入筛选维持液(含 200 μg/mL Hygromycine B的完全培养基)维持筛选。待阳性克隆长出,再扩大培养,即得到稳定表达rADAMTS13蛋白的细胞株。
1.2.3 转染后的Hela细胞上清的获得和浓缩
用无血清 1640培养基驯化稳定表达重组蛋白的Hela细胞,大量培养,收集上清。将收集的上清经Amicon Ultra-15离心超滤管离心浓缩,以备纯化。
1.2.4 重组蛋白纯化、透析及其鉴定
上清经 Ni-NTA琼脂糖柱,用含不同浓度的咪唑缓冲液(pH 8.0)从低到高梯度淋洗,收集蛋白所在缓冲液,吸入透析袋,用5 mmol/L Tris-HCl,150 mmol/L NaCl(pH 8.0)缓冲液透析过夜。
将纯化的蛋白进行 10% SDS-PAGE电泳,转膜,ADAMTS13多抗作为一抗,HRP标记的羊抗兔IgG为二抗,ECL放射显影,用Western blotting印迹鉴定表达的蛋白。BCA法测定蛋白浓度。
1.2.5 rADAMTS13酶活性检测
ADAMTS13能够特异地切割VWF A2结构域中的Tyr1605-Met1606肽键,调节VWF在血浆中分子的大小。将VWF73(Asp1596-Arg1668)的编码序列插入表达载体pGEX-6P-1(GE Healthcare公司),该载体带有谷胱甘肽S转移酶(Glutathione S-transferase,GST)标签,同时设计引物在目的片段后加6个组氨酸(6×His)的DNA序列,通过大肠杆菌BL21表达体系,表达重组蛋白,通过 Ni-NTA柱得到纯品,浓度为0.56 mg/mL。得到的 GST-VWF73-His蛋白的N端连有GST标签,C端连有6×His标签。
将 50 μL GST 单抗(10 μg/mL)加入 ELISA板,4℃过夜,5% BSA在 37℃下封闭2 h。再将浓度为2 μg/mL 的 GST-VWF73-His重组蛋白(25 mmol/L Tris-HCl,150 mmol/L NaCl,pH 7.4)在包好的板上每孔加50 μL,室温反应1 h。洗板3次后,将纯化后的重组蛋白rADAMTS13以1∶50稀释后,加入反应孔,37℃孵育3 h。将正常人混合血浆倍比稀释加入反应孔,同时孵育,作为标准曲线孔。洗板后,加入HRP标记的His单抗(1∶1000稀释)反应1 h,TMB显色,酶标仪读数[9]。
2 结果
2.1 真核表达载体pSecTag-ADAMTS13的鉴定
将经Hind III和Xho I双酶切后的质粒pSecTag-ADAMTS13进行 1%琼脂糖凝胶电泳,可见约4280 bp的目的基因条带。表明ADAMTS13基因重组质粒构建成功(图1)。
2.2 阳性克隆细胞上清经Western blotting鉴定
经 Hygromycine B筛选,获得一株高表达ADAMTS13蛋白的基因工程细胞株 ADAMTS2-4。阳性克隆细胞上清经SDS-PAGE电泳,转膜,Western blotting结果显示,抗ADAMTS13的多抗能在190 kDa左右处显单一蛋白区带(图2),说明上清中分泌的重组蛋白具有较高的免疫学活性。
2.3 Ni-NTA柱纯化后的蛋白鉴定
基因工程细胞株 ADAMTS2-4经扩大培养后,收集无血清上清经超滤浓缩后,上Ni-NTA柱,每1 L培养上清液中可纯化得到5.8 mg rADAMTS13纯品。经10% SDS-PAGE电泳鉴定,纯化产物主要在190 kDa处显一蛋白条带(图3)。

图1 重组质粒pSecTag-ADAMTS13的酶切鉴定Fig.1 Identification of the recombinant plasmid pSecTag-ADAMTS13 by restriction enzyme digestion.1: pSecTag-ADAMTS13 digested with Hind III and Xho I; 2: DL15 000 DNA marker.

图2 Western blotting鉴定重组蛋白Fig.2 Western blotting analysis of the recombinant protein.1:prestained protein marker; 2: supernatant from untransfected Hela cells; 3: supernatant from transfected Hela cells ADAMTS2-4.
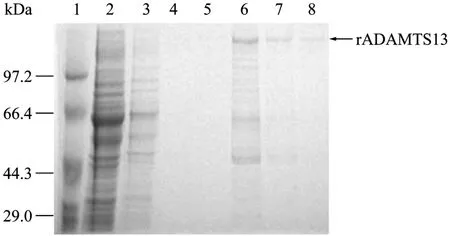
图3 SDS-PAGE电泳检测Ni-NTA柱纯化后的上清蛋白Fig.3 Reducing SDS-PAGE analysis of cell supernatant after flowing through Ni-NTA agarose column.1: low weight protein marker; 2: supernatant flowing through the Ni-NTA agarose column without binding on it; 3–5: wash by wash buffer with iminazole(20 mmol/L); 6: eluate by eluate buffer with iminazole(50 mmol/L); 7,8: eluate by eluate buffer with iminazloe(250 mmol/L).
2.4 rADAMTS13蛋白酶的活性检测
正常人混合血浆经倍比稀释,检测值作标准曲线为 lgy=0.18−0.67lgx(R2=0.9465,x=ADAMTS13活性百分数,y=OD450值),设定正常人混合血浆中ADAMTS13的活性为1 U/mL,代测的rADAMTS13的活性为6.4 U/mL。
3 讨论
血浆中的 ADAMTS13主要来源于肝脏的星状细胞(Hepatic stellate cells,HSC),同时在全身多个组织和脏器中均有微量的表达。ADAMTS13基因广泛存在于哺乳动物和鸟类、鱼类中,其中小鼠的ADAMTS13基因与人的具有很高的同源性。直到1996年,Tsai和 Fulan才在血浆中纯化出ADAMTS13蛋白[10]。直接从血浆中分离天然的ADAMTS13蛋白虽然活性好,难以大量制备,而利用体外基因重组技术可以解决这一问题。
ADAMTS13全长序列编码 1427个氨基酸,预测分子量为154 kDa左右,但由于糖基化和丰富的半胱氨酸,SDS-PAGE电泳显示有190 kDa。在真核细胞中表达,更有利于获得活性较高并更接近与自然合成的ADAMTS13蛋白。利用脂质体,将表达载体 pSecTag-ADAMTS13导入 Hela细胞株,该细胞株自身有内源性的Furin蛋白,能够切割前导肽并释放成熟的蛋白到培养的上清中,成为可溶性蛋白,大量培养后,收集其上清液可进行分离纯化。
本研究结果表明,重组质粒经 lipofectamine 2000转染Hela细胞,经Hygromycine B筛选,获得一株高表达 rADAMTS13蛋白的基因工程细胞株ADAMTS2-4。将细胞株ADAMTS2-4培养无血清上清经超滤浓缩后,利用载体上带的 6×His标签,经Ni-NTA琼脂糖柱不同浓度咪唑梯度淋洗纯化蛋白,使蛋白处于自然状态,保证了酶的活性。经SDS-PAGE电泳和 Western blotting显示,纯化的rADAMTS13大小约为 190 kDa,与预期的大小相符,并且商品化的抗ADAMTS13多抗能与其特异性结合。
有研究表明,VWF73(Asp1596-Arg1668)包含有ADAMTS13切割VWF的酶切位点Tyr1605-Met1606,是 ADAMTS13作用的最小底物[11]。利用基因重组的方法,得到了较纯的N端连有GST标签,C端连有6×His的重组蛋白GST-VWF73-His。利用GST单抗包板,将 GST-VWF73-His蛋白与之结合,再将rADAMTS13与之反应,若酶将VWF73的C末端切掉后,再用 His单抗检测,读数会降低,可以反应出ADAMTS13切割VWF的活性大小。本实验利用以上方法,以正常人混合血浆倍比稀释,作出标准曲线,从而得到纯品活性为6.4 U/mL,可见得到的重组蛋白保持了较好的剪切活性。
总之,基因工程细胞株ADAMTS2-4能稳定高表达重组蛋白 rADAMTS13,纯化的产品具有较高的免疫学活性和生物学酶活性,并且可长期大量获得,为下一阶段研究ADAMTS13生物学功能和作用机理奠定了坚实的基础。
REFERENCES
[1]Dong JF.Structural and functional correlation of ADAMTS13.Curr Opin Hematol, 2007, 14(3): 270–276.
[2]Bergmeier W, Chauhan AK, Wagner DD.Glycoprotein Ibalpha and von Willebrand factor in primary platelet adhesion and thrombus formation: lessons from mutant mice.Thromb Haemost, 2008, 99(2): 264–270.
[3]Tsai HM.Thrombotic thrombocytopenic purpura: a thrombotic disorder caused by ADAMTS13 deficiency.Hematol Oncol Clin North Am, 2007, 21(4): 609–632.
[4]Zheng XL, Sadler JE.Pathogenesis of thrombotic microangiopathies.Annu Rev Pathol, 2008, 3: 249–277.
[5]Desch KC, Motto DG.Thrombotic thrombocytopenic purpura in humans and mice.Arterioscler Thromb Vasc Biol, 2007, 27(9): 1901–1908.
[6]Levy GG, Nichols WC, Lian EC, et al.Mutations in a member of the ADAMTS gene family cause thrombotic thrombocytopenic purpura.Nature, 2001, 413(6855):488–494.
[7]Tsai HM.Current concepts in thrombotic thrombocytopenic purpura.Annu Rev Med, 2006, 57: 419–436.
[8]Tao Z, Peny Y, Nolasco L, et al.Recombinant CUB-1 domain polypeptide inhibits the cleavage of ULVWF strings by ADAMTS13 under flow conditions.Blood,2005, 106(13): 4139–4145.
[9]Zhou W, Tsai HM.An enzyme immunoassay of ADAMTS13 distinguishes patients with thrombotic thrombocytopenic purpura from normal individuals and carriers of ADAMTS13 mutations.Thromb Haemost, 2004,91(4): 806–811.
[10]Tsai HM.Physiologic cleavage of von Willebrand factor by a plasma protease is dependent on its conformation and requires calcium ion.Blood, 1996, 87(10): 4235–4244.
[11]Wu JJ, Fujikawa K, McMullen BA.Characterization of a core binding site for ADAMTS-13 in the A2 domain of von Willebrand factor.Proc Natl Acad Sci USA, 2006,103(49): 18470–18474.
Stable expression and characterization of the von Willebrand factor cleaving protease
Zhenni Ma, Ningzheng Dong, Jingyu Zhang, Jian Su, Anyou Wang, and Changgeng Ruan
Key Laboratory of Thrombosis and Hemostasis, Ministry of Health, Jiangsu Institute of Hematology, the First Affiliated Hospital of Soochow University, Suzhou 215006, China
Received:August 27, 2009;Accepted:December 24, 2009
Supported by:National Natural Science Foundation of China(No.30670904).
Corresponding author:Changgeng Ruan.Tel: +86-512-67780418; Fax: +86-512-65113556; E-mail: changgengruan@hotmail.com国家自然科学基金项目(No.30670904)资助。
