胶原蛋白酶产生菌的筛选及酶的分离纯化
2010-10-16刘丽莉马美湖余秀芳王文涛
刘丽莉,马美湖,余秀芳,王文涛
1 华中农业大学食品科技学院,武汉 430070 2 河南科技大学食品与生物工程学院,洛阳 471003
胶原蛋白酶产生菌的筛选及酶的分离纯化
刘丽莉1,2,马美湖1,余秀芳1,王文涛1
1 华中农业大学食品科技学院,武汉 430070 2 河南科技大学食品与生物工程学院,洛阳 471003
从堆积骨骼的土样中筛选出高产胶原蛋白酶的MBL13菌株,经鉴定为蜡样芽孢杆菌Bacillus cereus。对其所产的胶原蛋白酶BCC进行分离纯化,并进行酶学性质的研究。从菌株的发酵液中纯化出分子量约为38.0 kDa BCC酶。酶反应的最适温度为40℃,最适pH为8.0。在50℃以下稳定,60℃保温1 h酶活仅保留10%;在pH 7.0~8.5活性较稳定;金属离子Ca2+、Zn2+、Mg2+对酶有激活作用,金属离子Cu2+对酶有显著的抑制作用。EDTA和EGTA能抑制该酶,表明BCC酶为一种金属蛋白酶。酶的底物特异性表明该酶为骨胶原蛋白酶,且对Ⅰ型骨胶原蛋白水解能力极显著高于Ⅱ型胶原蛋白和Ⅲ型胶原蛋白。将纯化的BCC酶应用于骨胶原蛋白的水解可以得到不同链长的多肽,其水解能力高于标准品胶原酶Ⅰ型。本研究为工业酶提供了新的菌株和新型胶原蛋白酶,为胶原蛋白酶的开发提供了重要的理论依据。
胶原蛋白酶,筛选,纯化,性质
Abstract:We isolated the strain MBL13 with high collagenase productivity from the soil of piled up animal bones.It was identified as Bacillus cereus.We purified and characterized Bacillus cereus collagenase(BCC).The molecular weight of BCC was 38.0 kDa and the optimum temperature and pH for the enzyme activity were 40°C and 8.0 respectively.The enzyme was stable when the temperature was below 50°C, but only retained 10% activity when kept at 60°C for 1 h.The enzyme activity was stable between pH 7.0–8.5.Some metal ions such as Ca2+, Zn2+, Mg2+enhanced the enzyme activity, and Cu2+brought the obvious inhibition.In addition, EDTA and EGTA could inhibit the enzyme activity.We suggested that the purified enzyme was a member of the metalloproteases.Based on the experiment of substrate specificity, we found that the purified enzyme was bone collagenolytic protease, and had a much stronger capacity of hydrolysis for type I collagen than that for type II collagen and type III collagen.By BCC hydrolyzing bone collagen, we obtained polypeptides with different chain lengths.The comparative test indicated that the hydrolysis capacity of BBC was higher than that of standard type I collagenase.The results introduced a new strain and a novel collagenolytic protease for industrial enzyme.
Keywords:collagenase, screening, purification, property
随着我国养殖业迅猛发展,屠宰所产生的副产物是不可忽视的。骨骼是丰富的蛋白质资源,主要成份是胶原蛋白,骨胶原蛋白是胶原蛋白的一种。现今利用高新技术如酶技术对庞大的骨资源进行深加工,开发新型的功能性骨胶原多肽具有十分重要的经济价值成为研究的热点[1-3]。胶原蛋白酶的研究始于19世纪末。胶原蛋白酶(Collgaenolytci protease)定义为在适当的pH和温度下,只切割活性胶原螺旋区或明胶而不作用于其他蛋白底物的酶类[4-5]。然而,只有为数有限的蛋白酶具有独特的特点可以引起胶原蛋白的降解。胶原蛋白酶按照其来源可分为微生物胶原蛋白酶和动物胶原蛋白酶。细菌胶原酶可分泌到胞外,通过发酵可大量获得,微生物来源的胶原酶在应用方面具有更广的应用范围[6]。胶原蛋白酶在医学上可用于治疗异常增生,如腰椎间盘突出症等疾病,也可在细胞研究中应用于分离胃肠细胞、胰岛素和上皮细胞等,还可应用于胶原结构、生物合成的研究等,具有重要的理论研究意义和应用研究价值[7]。
本实验从堆积骨骼的土样中筛选出骨胶原蛋白的产生菌株,以探讨应用工业化发酵大规模生产该酶的可能,筛选到的一株高产胶原蛋白酶的MBL13菌株。对其所产胶原蛋白酶BCC进行了提纯及性质研究,以期为进一步开发和利用新型的胶原蛋白酶提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 试剂
酸性可溶性Ⅰ型胶原(Acid-soluble typeⅠ collagen from calfbone)和胶原酶Ⅰ型(酶活大于125 U/mg)购自Sigma公司。电泳所需的生化试剂为超纯试剂,分别购自美国 Simga公司和 Flkua公司。DEAECellulose-52、Sephadex G-100为Pharmacia 公司产品。低分子质量标准蛋白购自上海升正生物技术公司。细菌16S rDNA PCR扩增试剂盒(Code NO1310)和切胶试剂盒(Code NO1DV805A)购自TaKaRa公司。骨明胶,食品级。其他试剂均为分析纯。
1.1.2 仪器与设备
ZHWY-2102C型立式双层恒温摇床(上海智诚有限公司);SW-CJ-2D型双人单面净化工作台(苏州净化设备有限公司);YM75(Z)不锈钢立式电热蒸汽消毒器(上海三申医疗器械有限公司);DYCZ-24DN 型双垂直电泳仪(北京六一仪器厂);HD-3000型核酸检测仪、恒流泵、收集器(上海嘉鹏科技有限公司);超速冷冻离心机(Avanti J-E,Beckman coulter, USA)等。
1.1.3 培养基
富集培养基(1000 mL):骨明胶10 g,NaCl 5 g,蛋白胨5 g,pH 7.2~7.5。初筛培养基(1000 mL):骨明胶 20 g,葡萄糖 5 g,NaCl 0.1 g,KH2PO40.5 g,MgSO4·7H2O 0.2 g,pH 7.2~7.5。复筛培养基(1000 mL):葡萄糖 20 g,酵母粉 1.5 g,骨明胶 10 g,NaH2PO4·2H2O 0.5 g,K2HPO4·3H2O 2.5 g,CaC120.05 g,pH 7.0~7.2[8]。固体培养基:在上述液体培养基中加入2.0%琼脂,即成相应固体培养基。
1.2 实验方法
1.2.1 培养方法
斜面及平板培养:37℃恒温培养48 h。复筛发酵培养:复筛培养基10 mL盛于50 mL三角瓶中,接种后在37℃,摇床180 r/min培养48 h。产酶发酵培养:复筛培养基30 mL盛于250 mL三角瓶中,接种后37℃,摇床180 r/min培养48 h。
1.2.2 BCC产生菌的筛选
采集的土样先经富集培养48 h;稀释涂布于初筛培养基的平板上形成单菌落,滴加酸性汞试剂在菌落周围,选择透明圈直径与菌落之比较大的进行复筛,并测定发酵液中胶原蛋白酶活力(酸性汞试剂:HgCl215 g,浓 HCl 20 mL,加蒸馏水至 100 mL)。
1.2.3 BCC酶的分离纯化
将发酵液离心,取上清液得粗酶液,以硫酸铵分段盐析得沉淀为 A酶样,将其溶解后并采用pH 7.5、20 mmol/L Tris-HCl缓冲液透析,然后过以同样缓冲液平衡的DEAE-Cellulose-52柱并洗涤,然后以 0.1~0.5 mol/L NaCl和 0.1 mol/L Tris-HCl缓冲液进行线形梯度洗脱,收集活性部分得酶样 B,浓缩后在Sephadex G-100柱上凝胶过滤,收集活性峰,冷冻干燥得纯化的酶C制品。该纯化BCC酶在分离胶浓度为15%,SDS-PAGE电泳进行纯度分析,考马斯亮蓝法显迹[9-10]。
1.2.4 纯化BCC的酶学性质研究
最适反应温度和热稳定性:在不同温度下按照标准方法测定酶活力,以酶活力最高者为 100%。酶液在 10℃、20℃、30℃、37℃、50℃、60℃、70℃下分别保温1 h,迅速冷却至室温,按上述方法测残余酶活力,以未保温的酶液的酶活力为 100%[11]。酶的最适反应pH和pH稳定性:将酶液分别加在不同pH(pH 3.0~11.0)的缓冲液中,按标准方法测酶活力,以酶活力最高者为 100%。将酶液用不同pH(pH 3.0~11.0)的缓冲液稀释,37℃保温1 h后,测残余酶活力,以未保温的酶液的酶活力为100%[12]。金属离子对纯化酶活力的影响:在酶反应体系内加入不同的金属离子,各种金属离子的终浓度分别为2 mmol/L,在37℃下保温30 min,测剩余酶活,以不含金属离子的反应液为对照[13]。抑制剂对纯酶活性的影响:采用2 mmol/L和5 mmol/L的不同抑制剂(EDTA、EGTA、PMSF、Leupeptin、N-ethylmaleimide)的缓冲液,以未加的酶活力为100%,测定相对酶活的变化。酶的底物特异性:分别以骨明胶、可溶性Ⅰ型胶原蛋白、Ⅱ型胶原蛋白、Ⅲ型胶原蛋白、牛血清白蛋白(BSA)为作用底物,以骨明胶测定的酶活为100%计,测定相对酶活。
1.2.5 BCC酶解骨胶原蛋白的产物的SDS-PAGE分析及其对比实验
自制骨胶原蛋白[14-15]5 g,加入100 mL 蒸馏水中,90℃热处理20 min。冷却后加入纯化BCC酶液和胶原酶Ⅰ型标准品酶液,37℃下酶解反应,于不同酶解时间取样,酶解液在SDS-PAGE上电泳分析,分离胶浓度为15%,浓缩胶浓度为5%。
1.3 测定指标与方法
1.3.1 BCC酶活性的测定方法
采用茚三酮显色法[16]。取0.01 mL酶液,加入20 mmol/ L Tris-HCl(pH 7.5)缓冲液溶液溶解的 1 mg/mL可溶性 I型胶原 0.3 mL,37℃反应30 min,然后加入0.6 mL 10%三氯乙酸(TCA)终止反应,以先加终止液的相同反应物为对照,反应物10 000 ×g离心10 min,取上清液0.2 mL加入0.5 mL,茚三酮显色溶液,充分混合后,盖住试管口,在100℃水浴中加热15 min,冰水冷却5 min后,加入2.5 mL 60%丙醇稀释。充分混匀后,570 nm处比色。
酶活力单位定义为:在37℃、pH 7.5条件下,每分钟水解胶原产生相当于1 µmol亮氨酸的酶量为1个酶活力单位(U)。
1.3.2 蛋白质含量的测定方法
采用Bradford法[17]测定,以牛血清白蛋白为标准。
1.3.3 分子量的测定方法
按Laemmli等[18]的SDS-PAGE方法进行。分离胶浓度为15%,浓缩胶浓度为5%。
2 结果与分析
2.1 产BCC菌株的筛选结果
从湖南和河南骨骼加工厂堆积骨骼处采集到50份土样先经液体富集培养48 h,稀释涂布于LB培养基上形成单菌落。再点接于初筛培养基中进行初筛,选择细菌水解透明圈直径与菌径之比较大的进行摇床发酵复筛,发酵液测定胶原蛋白酶活力。实验结果表明骨胶原蛋白水解所形成的透明圈的大小与细菌产胶原蛋白酶的能力具有相关性。经富集培养通过初筛、复筛,分离出的60株细菌能分泌胶原蛋白酶。其中有3株产酶能力均在30 U/mL以上。有一株编号为 MBL13的细菌每毫升发酵液含胶原蛋白酶的活力达36.80 U/mL,经单株分离且连续传代产酶能力无明显下降。经形态学观察、生理生化特性、16S rDNA 序列分析和傅里叶红外测定细胞结构,鉴定该菌株为蜡样芽孢杆菌 Bacillus cereus(另文发表)。
2.2 BCC酶的分离纯化
通过硫酸铵沉淀、DEAE-Cellulose-52离子交换层析及Sephadex G-100凝胶过滤对MBL13 发酵液中的酶进行分离纯化,结果见表1。

表1 MBL13菌产BCC酶的纯化Table 1 Purification of the BCC collagenase from MBL13
经过纯化后的BCC酶活达到2443 U/mg,提纯倍数为 20.4,得率为 25.2%。各步提取的酶样品用SDS-PAGE检测(图1),结果表明硫酸铵沉淀样品A中杂带较多,样品B中蛋白酶已占主要部分,样品C中已是单一条带,表明蛋白酶已达到电泳纯。最终纯化的胶原蛋白的分子量约为38 kDa。接近于一般细菌所产蛋白酶18~35 kDa的分子量[19]。
2.3 BCC酶反应最适温度和热稳定性
纯酶液与可溶性Ⅰ型胶原蛋白溶液等体积混和,在 10℃~70℃的温度下反应 30 min,测得酶的最适作用温度为40℃。
将酶液在不同的温度下分别保温 1 h后立即在0℃冰浴中冷却,然后在37℃下测酶活,以剩余的酶活性作为评价酶的热稳定性的指标。结果显示,纯化酶在10℃~40℃保温1 h保留75%以上的酶活力;50℃保温1 h 后,剩余的酶活为60%左右,在60℃保温1 h仅剩10%酶活,表明纯化酶不能耐受高温,热稳定性一般(图2)。

图1 各步分离纯化蛋白的SDS-PAGE电泳图Fig.1 SDS-PAGE analysis of the protein bands from the various purification steps.1: protein marker; 2: DEAE-Cellulose-52 column chromatography; 3: ammounium sulfate precipitation; 4:purified collagenase.Protein was stained with Commassie Brilliant Blue R 250 staining.
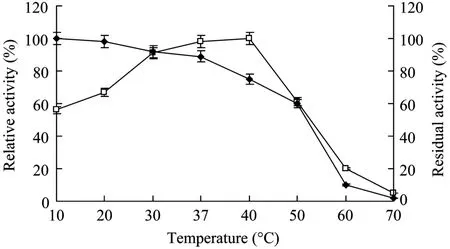
图2 温度对BCC酶活的影响Fig.2 Effect of temperature on the enzyme activity of BCC collagenase.The optimal temperature for the enzyme activity(□)was determined at different temperatures(10°C–70°C).The enzyme was preincubated at 10°C–70°C for 1 h to determine the stability(◆)of the enzyme activity.
2.4 BCC酶最适反应pH和pH 稳定性
取纯酶液0.5 mL,加入9.5 mL不同pH的缓冲液(pH 3.0~11.0),与可溶性Ⅰ型胶原蛋白等体积混合,在37℃保温30 min测定酶活的变化。
如图3所示,在 pH 7.0~8.0之间酶活力都较高,酶的最适pH为8.0。将适量酶液与不同pH 缓冲液在37℃预处理1 h 后,测定剩余酶活力。pH 7.0~8.5之间剩余酶活仍能保持在 80%以上。在 pH 3.0~7.0之间,随着pH的降低,剩余酶活力显著下降;pH 8.5~10.0之间,随着pH的增大,酶活从80%急剧下降为2%。
2.5 不同金属离子对BCC酶活的影响
在酶与底物的反应体系中,加入不同的金属离子,使其终浓度为2 mmol/L,以不加金属离子的酶活为100%,测定其酶活(图4)。多种金属阳离子对该酶的活性都有较大的影响,其中Ca2+、Zn2+、Mg2+对酶有激活作用,Ca2+能提高纯化酶的活性;金属离子 Cu2+对酶有显著的抑制作用;其他金属离子也对酶活有一定的影响作用,但作用不明显。
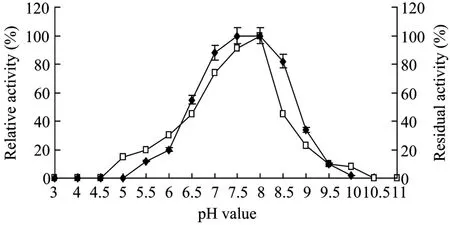
图3 pH值对BCC酶活的影响Fig.3 Effect of pH on the enzyme activity of BCC collagenase.The optimal pH for the activity(□)and pH stability(◆)of the enzyme were determined at various pHs(pH 3.0–11.0), with the reactions preincubated at the given pHs for 1 h.The buffers used were 50 mmol/L sodium citrate(pH 3.0–6.6), 50 mmol/L Tris-HCl(pH 7.0–9.0), and 50 mmol/L Na2CO3-NaHCO3(pH 9.16–10.83).To determine the stability, the enzyme was preincubated at 37°C for 1 h in each of the specified buffer.

图4 金属离子对BCC酶活的影响Fig.4 Effect of metal ions on the enzyme activity of BCC collagenase.
2.6 抑制剂对BCC酶活的影响
以未加抑制剂的样品为对照,测定含有抑制剂的样品的胶原蛋白酶活性,从而计算出抑制剂的作用效率,以胶原蛋白酶的相对剩余酶活来表示,结果见表2。EDTA和EGTA可以强烈抑制纯化的胶原蛋白酶活性,N-ethylmaleimide、PMSF和Leupeptin对纯化酶的活性影响较小,可以保留近80%的相对酶活;由于金属蛋白酶在反应中心需要二价金属离子,而且通常能抑制二价金属离子作用的EDTA和EGTA被称为金属蛋白酶的抑制剂[20]。因此,该纯化酶表明是一种金属蛋白酶。
2.7 BCC酶的底物特异性
分别以骨明胶、可溶性Ⅰ型胶原蛋白、Ⅱ型胶原蛋白、Ⅲ型胶原蛋白、牛血清白蛋白(BSA)为底物,测定适当稀释后纯化酶液的酶活性高低,以明胶为底物作为对照,测定相对酶活的变化,结果见图5。纯化酶对底物的作用顺序为:骨明胶>Ⅰ型胶原蛋白>Ⅲ型胶原蛋白>Ⅱ型胶原蛋白,对BSA没有作用。经方差分析,不同底物对相对酶活的影响存在极显著(P<0.01)。即底物为Ⅰ型胶原蛋白时,相对酶活显著高于Ⅲ型胶原蛋白和Ⅱ型胶原蛋白。由于骨骼中Ⅰ型胶原蛋白占总蛋白的85%~90%。,因此,实验结果表明该菌所产酶对Ⅰ型骨胶原蛋白具有特异性,纯化BCC酶属于骨胶原蛋白酶。
2.8 胶原蛋白酶的酶解产物分析及其对比实验
为了进一步了解纯化的BCC酶的酶解能力,将其应用于骨胶原蛋白的水解,并针对相同酶活的纯化BCC酶和胶原酶Ⅰ型标准品(美国)进行对比实验。酶解产物进行SDS-PAGE分析结果见图6、7。

表2 抑制剂对BCC酶活的影响Table 2 Effect of inhibitors on the enzyme activity of BCC collagenase
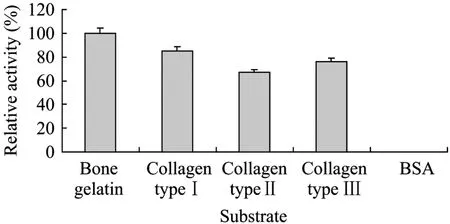
图5 纯化酶对底物的特异性Fig.5 Substrate specificity of BCC collagenase.
将纯化的BCC酶应用于骨胶原蛋白的水解,该酶水解骨胶原蛋白得到的最终产物为低分子量的多肽,随着酶解时间的增加,肽的分子量随之变小。而且水解后产生的多肽并不是连续的,说明该酶对骨胶原蛋白的水解是特异的,具有特定的酶切位点。这也进一步说明该酶为胶原蛋白酶,通过控制酶解时间,可以得到不同链长的多肽。即该酶可以用于骨胶原蛋白的水解生产骨多肽,可有望用于骨骼的深加工生产(图6)。

图6 纯化酶酶解骨胶原蛋白的SDS-PAGE电泳图Fig.6 SDS-PAGE analysis of bone collagen digested with the purified enzyme.1: enzymolysis time 60 min; 2: enzymolysis time 120 min.

图7 酶解骨胶原蛋白的SDS-PAGE对比分析Fig.7 SDS-PAGE analysis of bone collagen digested with BCC collagenase and collagenase I.1: the collagen polypeptides by BCC collagenase hydrolyzing bone collagen at 90 min; 2:the collagen polypeptides by collagenase I(standard sample,USA, Sigma)hydrolyzing bone collagen at 90 min; 3: protein marker.
由图7可知,在相同的酶解条件下,纯化的BCC酶的酶解液中大部分多肽条带的分子量低于胶原酶Ⅰ型标准品。即表明在统一的酶解条件下,BCC酶能产生更多低分子量的骨胶原多肽。因此,结果表明MBL13所产的BCC酶酶解骨胶原蛋白的能力强于标准品胶原酶Ⅰ型。
3 讨论
胶原蛋白酶是一种经济价值较高的蛋白酶种,国外胶原蛋白酶的产生菌都是通过以胶原或重组胶原(Reconstitude collagen)为底物筛选模型获得的,但这种方法涉及胶原的提取,操作复杂,胶原极易变性,成本较高。本研究利用骨明胶为唯一氮源的选择培养基,从堆积骨骼处分离得到一批产胶原蛋白酶活性的菌株,筛选出一株MBL13,经鉴定为蜡样芽孢杆菌Bacillus cereus,其不但产酶量高,而且酶的活性强,具有重要的研究开发价值。在胶原蛋白酶的纯化过程中,经硫酸铵沉淀、DEAECellulose-52离子交换层析及Sephadex G-100凝胶过滤纯化后,得到分子量为38 kDa的BCC酶,该酶的比活力达到 2443 U/mg,提纯倍数为 20.4,得率为25.2%。酶学性质研究表明,BCC酶最适作用温度为 40℃,最适作用 pH为 8.0。pH稳定范围为7.0~8.5,其热稳定性一般,酶活最佳保持在60℃以下。因此,有待进一步提高酶活热稳定性的研究,使之更广泛应用于工业生产中。除了金属离子 Cu2+明显抑制酶的活性外,其他离子对酶活性的影响不大,这些生理特性赋予了BCC酶在工业中有极大的应用优势。抑制剂实验表明该纯化酶是一种金属蛋白酶,该酶的底物特异性表明酶对Ⅰ型胶原蛋白有极显著的特异性,为一种骨胶原蛋白酶。对比实验表明纯化的 BCC酶水解能力强于标准品胶原酶Ⅰ型,因此具有极大的开发潜力。
针对骨骼的酶解研究,相关报道很多,但我国却没有骨专用的胶原蛋白产品,而且目前我国有关胶原蛋白酶的生产成本高,产量有限,限制了该酶的应用。本实验从骨骼堆积处的土样中筛选到的降解骨胶原蛋白的菌株MBL13,为开发骨骼深加工提供了新的思路,为解决工业化生产胶原蛋白酶提供了新型的专用生产出发菌。
REFERENCES
[1]Olsen D, Yang C, Bodo M, et al.Recombinant collagen and gelatin for drug delivery.Adv Drug Deliv Rev, 2003,55(12): 1547–1567.
[2]Gelse K, Pöschl K, Aigner T.Collagens—structure,function, and biosynthesis.Adv Drug Deliv Rev, 2003,55(12): 1531–1546.
[3]Horn MM, Martins VCA, de Guzzi Plepis AM.Interaction of anionic collagen with chitosan: effect on thermal and morphological characteristics.Carbohydr Polym, 2009,77(2): 239–243.
[4]Watanabe K.Collagenolytic proteases from bacteria.Appl Microbiol Biotechnol, 2004, 63: 520–526.
[5]Park PJ, Lee SH, Byun GH, et al.Purification and characterization of a collagenase mackerel, Scomber japonicus.J Biochem Mol Biol, 2002, 35(6): 5765–5782.
[6]Kumar CG, Takagi H.Microbial alkaline proteases: from a bioindustrial viewpoint.Biotechnol Adv, 1999, 17(7):561–594.
[7]Kanth SV, Venba R, Madhan B, et al.Studies on the influence of bacterial collagenase in leather dyeing.Dyes Pigm, 2008, 76(2): 338–347.
[8]Yang GY, Xie J, Xu N, et al.Isolation and characterization of collagenolytic enzyme2 producing strain from rotten hides and primary analysis of the enzyme property.Microbiol China, 2004, 31(5): 43–48.杨光垚, 谢君, 徐宁, 等.具胶原蛋白活性铜绿假单胞菌的筛选.微生物学通报, 2004, 31(5): 43–47.
[9]Kang S, Jang YB, Choi YJ, et al.Purification and properties of a collagenolytic protease produced by marine bacterium Vibrio vulnificus CYK279H.Biotechnol Bioproc Eng, 2005, 10: 593–598.
[10]Chen Z, Yang XQ, Zhao MM.Purification and immobilization of the proteinase from mung bean burgeon inactivating soybean trypsin inhibitor.Chin J Biotech,2001, 17(2): 211–214.陈中, 杨晓泉, 赵谋明.萌发绿豆中水解大豆胰蛋白酶抑制子蛋白酶的纯化及固定.生物工程学报, 2001,17(2): 211–214.
[11]Uesugi Y, Arima J, Usuki H, et al.Two bacterial collagenolytic serine proteases have different topological specificities.Biochim Biophys Acta(BBA)-Proteins &Proteom, 2008, 1784(4): 716–726.
[12]Manni L, Jellouli K, Agrebi R, et al.Biochemical and molecular characterization of a novel calcium-dependent metalloprotease from Bacillus cereus SV1.Proc Biochem,2008, 43(5): 522–530.
[13]Lima CA, Rodrigues PMB, Porto TS, et al.Production of a collagenase from Candida albicans URM3622.Biochem Eng J, 2009, 43(3): 315–320.
[14]Prigodich RV, Vesely MR.Characterization of the complex between bovine osteocalcin and type I collagen.Archiv Biochem Biophys, 1997, 345(2): 339–341.
[15]Nagai T, Suzuki N.Isolation of collagen from fish waste material-skin, bone, and fish.Food Chem, 2000, 68:277–281.
[16]Sung-II Kang S, Jang YB, Choi YJ, et al.Purification and properties of a collagenolytic protease produced by marine bacterium Vibrio vulnificus CYK279H.Biotechnol Bioprocess Eng, 2005, 10: 5935–5998.
[17]Bradford MM.A rapid and sensitive method for the quantization of microgram quantities of protein using the principle of protein-dye binding.Anal Biochem, 1976, 72:248–254.
[18]Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4.Nature, 1970,227: 680–685.
[19]Gallop PM, Seifter S, Mellman E.Studies on collagen(I):the partial purification, assay, and mode of activation of bacterial collagenase.Biol Chem, 1957, 227(2): 891–906.
[20]Sousa F, Jus S, Erbel A, et al.A novel metalloprotease from Bacillus cereus for protein fiber processing.Enzym Microb Technol, 2007, 40(7): 1772–1781.
Screening of collagenase-producing strain and purification of Bacillus cereus collagenase
Lili Liu1,2, Meihu Ma1, Xiufang Yu1, and Wentao Wang1
1 College of Food Science & Technology, Huazhong Agricultural University, Wuhan 430070, China 2 School of Food & Bioengineering, Henan University of Science and Technology, Luoyang 471003, China
Received:August 17, 2009;Accepted:November 19, 2009
Supported by:Key Projects in the National Science & Technology Pillar Program during the Eleventh Five-year Plan Period(No.2006BAD05A17).
Corresponding author:Meihu Ma.Tel: +86-27-87283177; Fax: +86-27-87283177; E-mail: mameihuhn@yahoo.com.cn“十一五”国家科技支撑计划(No.2006BAD05A17)资助。
