重庆市规模猪场猪病流行状况调查*
2010-09-26米自由熊仲良杨泽林
曾 政,米自由,熊仲良,杨泽林,王 健
(1.重庆市动物疫病预防控制中心,重庆 401120;2.重庆市农业委员会,重庆 401121)
猪圆环病毒病和高致病性猪繁殖与呼吸道综合征是近年影响我国养猪业发展的两种主要猪病,这两种病都能损害猪的免疫系统,导致猪体质下降,引起其他病原体的继发感染,造成很高的死亡率和淘汰率[1-3]。2009年5月以来,重庆市部分区县发生了不明原因的猪病疫情,大部分病猪表现为体温升高,皮肤苍白,背、臀部皮肤破溃,耳尖坏死,黄疸,便秘或腹泻,消瘦等临床症状。发病率在25%~100%之间,病死率不等,部分养殖场生猪全部发病死亡,由此造成了巨大的经济损失。重庆市动物疫病预防控制中心从37个发病猪场采集了组织样61份,全血19份,血清360份分别进行了猪圆环病毒2型(PCV-2)、高致病性猪繁殖与呼吸综合征病毒(HPPRRSV)、猪繁殖与呼吸道综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪细小病毒(PPV)的检测,对猪伪狂犬病毒(PRV)抗体、猪流感(SIV)H1N1抗体、猪传染性胸膜肺炎放线杆菌(App)抗体、猪传染性胃肠炎病毒(TGEV)抗体、弓形虫(TOX)IgG抗体进行检测,希望能准确掌握此次引起重庆市猪场生猪发病的病原情况,为有效防控疫情提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品 从长寿区、万州区、合川区等12个区县的37个猪场的濒死病猪,无菌采集组织样品(肺、脾及淋巴结)61份,血清360份,编号后-20℃保存,另采集抗凝血19份(来自5个猪场)。所有猪场均注射了CSFV和口蹄疫病毒(FMDV)疫苗,部分猪场注射了HP-PRRSV疫苗。
1.1.2 主要试剂 HP-PRRSV荧光 RT-PCR K it(批号:20090408),PRRSV荧光 RT-PCR K it(批号:20090512),PPV荧光PCR Kit(批号:20090221)和CSFV荧光RT-PCR K it(批号:20090409)均购自深圳太太基因生物有限公司。SIV H 1N1抗体ELISA K it(批号:07731-JB425),App抗体 ELISA Kit(批号:07733-JB416),PRV ELISA K it(09836-EC601)均购自美国IDEXX公司;TGEV ELISA Kit(批号:P04872)购自瑞士Svanova生物技术公司;Tox IgG抗体Kit(批号:20090506)购自珠海海泰生物制药有限公司;PCR试剂,DL 2 000 Marker购自宝生物工程(大连)有限公司。病毒/液体样品DNA/RNA抽提试剂盒购自上海华舜生物技术有限公司。其他试剂均为分析纯。
1.1.3 引物 PCV-2 PCR检测引物根据Genebank发表的序列(gi:42794975),采用ORF2特异性保守序列设计,PCV-1:TTTTAAGGGTTAAGTGGGG,PCV-2:ATGACGTATCCAAGGAG,预期扩增片段长度为700 bp。
1.2 方法
1.2.1 DNA/RNA提取 DNA/RNA抽提均按照病毒/液体样品DNA/RNA抽提试剂盒操作说明进行。
1.2.2 病毒检测
1.2.2.1 PCV-2目的基因的扩增 以提取的PCV-2 DNA为模板进行PCR反应,反应条件为94℃变性5min后,94℃45 s,55℃45 s,72℃45 s,循环30次,72℃延伸10min结束,PCR产物经10 g/L琼脂糖凝胶电泳后在凝胶成像系统上观察结果。
1.2.2.2 HP-PRRSV、PRRSV、CSFV分别用荧光(RT)PCR试剂盒进行检测,同时设定阴、阳性对照,结果按照试剂盒说明书判定。
1.2.3 血清抗体检测 血清样品抗体检测均采用ELISA法,具体操作和结果判定按照试剂盒说明书进行。
1.2.4 细菌分离 按照常规细菌分离方法进行细菌分离。
1.2.5 附红细胞体检查 将抗凝血用生理盐水稀释1倍,滴加约 20μL于载玻片上,姬姆萨染色,相差显微镜100倍镜下观察。如果红细胞形态完整,边缘整齐,则为阴性;如果血浆中有圆形、短杆状折光性较强的虫体,不停翻转,移动,呈淡红或淡紫红色,红细胞形态不规则,变为五角形或多边形,则判为阳性。
2 结果
2.1 病毒检测结果
对61份组织进行病原学检测,从51份样品中检出了PCV-2(样品阳性率83.61%),阳性猪场数为35个,猪场阳性率为94.59%;从32份样品中检测出HP-PRRSV(样品阳性率52.46%),阳性猪场数为22个,猪场阳性率为59.46%;从2份样品中检测到PRRSV(样品阳性率1.63%),阳性猪场数为2个,猪场阳性率为5.41%;所有样品均未检测到CSFV(表1)。
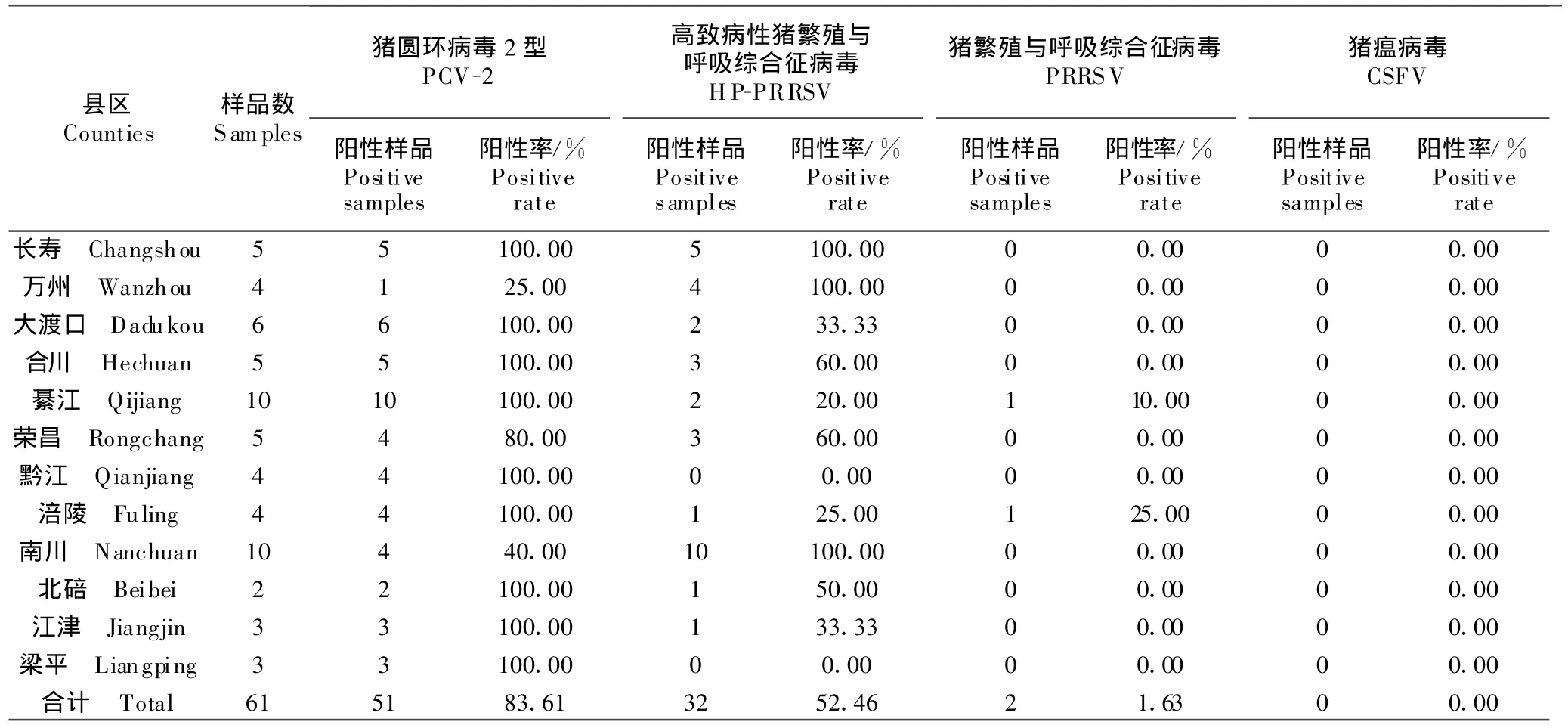
表1 样品病原学检测结果Table1 The results of pathogenic detection of samples collected from different pig farm s
2.2 血清检测结果
通过ELISA检测360份血清,显示PRV阳性血清41份,阳性猪场12个;TOX阳性血清68份,阳性猪场22个;App阳性血清113份,阳性猪场25个;SIV(H1N1)阳性血清 29份,阳性猪场 9个;TGEV阳性血清13份,阳性猪场3个(表2)。
2.3 细菌分离结果
从7份样品中分离出大肠埃希菌。
2.4 附红细胞体检查结果
镜检表明来自5个猪场的19份全血样品中有18份为猪附红细胞体阳性,样品阳性率达94.73%,猪场阳性率为100%。
3 混合感染情况分析
对所有样品的病原学和血清学检测结果表明,两种或两种以上疫病感染的猪场有35个,占检测猪场数的94.59%;以PCV-2+App,PCV-2+HP-PRRSV,PCV-2+TOX混合感染的猪场数最多,分别占检测猪场数的56.75%、51.35%和48.65%,统计结果见表3。
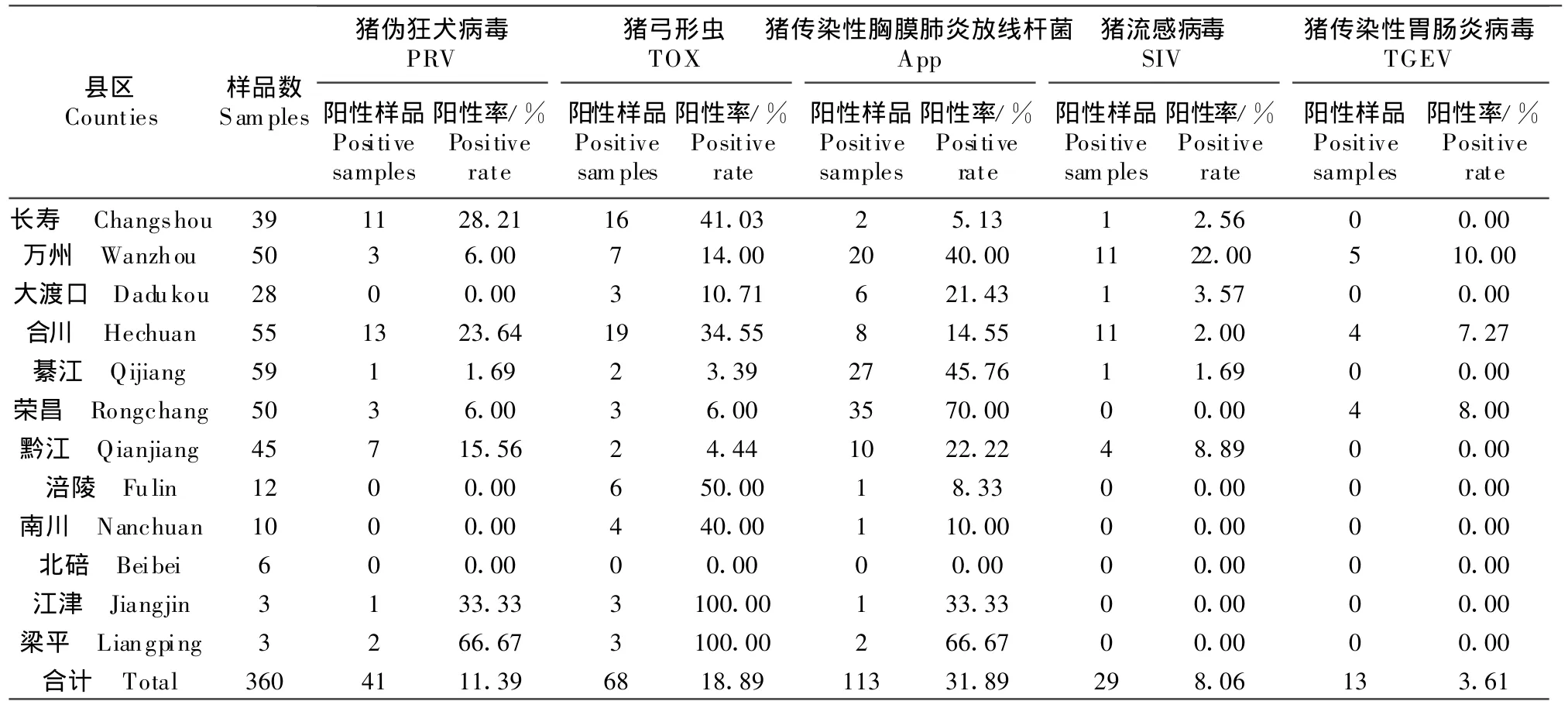
表2 不同区县样品血清学检测结果Table2 Results of serologicaldiagnosisof serum sam ples collected from differen t pig farms
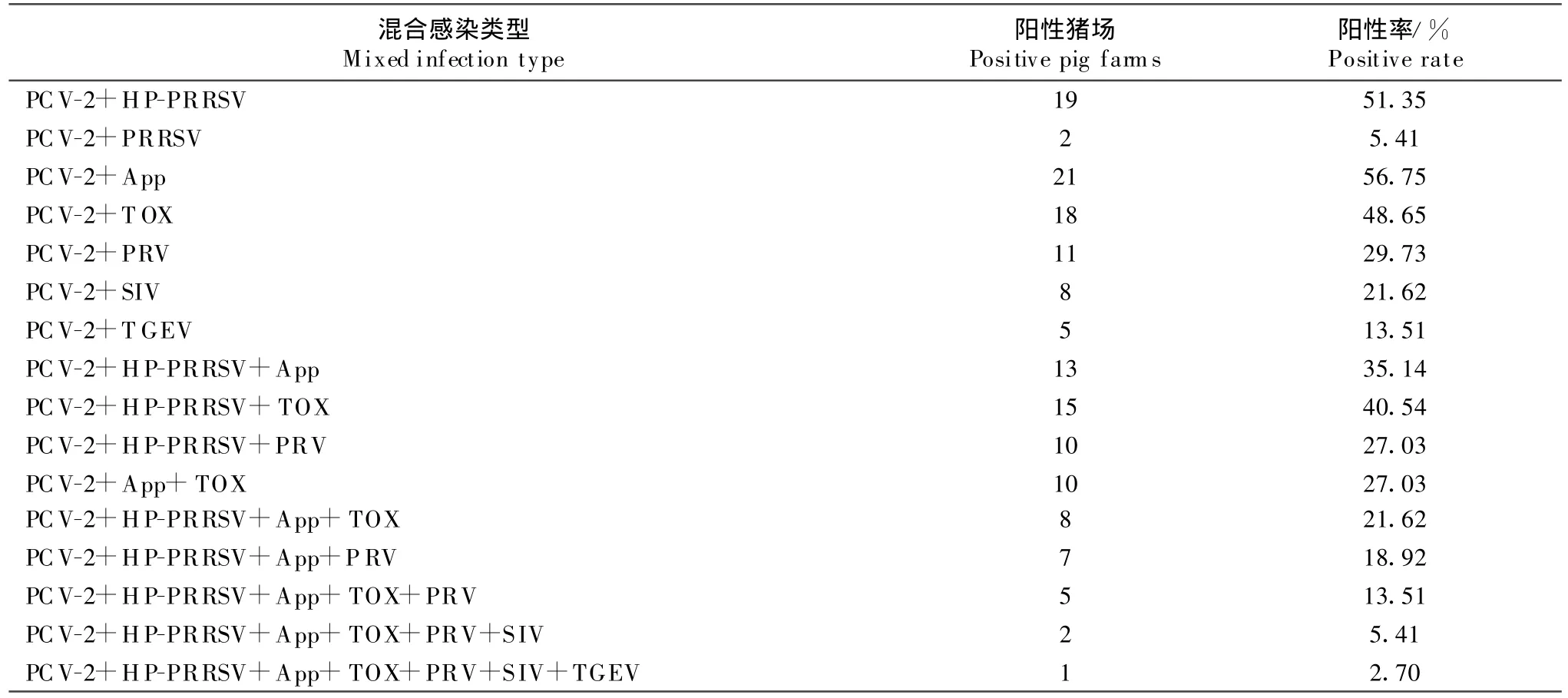
表3 猪场混合感染情况Table3 Them ixed infection situation in the pig farm s
4 讨论
PCV-2是引起断奶仔猪多系统衰竭综合征(PMWS)的主要病原,它还与许多猪相关疾病的发生有重要关联,如猪皮炎与肾炎综合征(PDNS)、增生性坏死性肺炎P(NP)、猪呼吸综合征(PRDC)、繁殖障碍、先天性颤抖、肠炎等疾病。PCV-2及其相关的疾病已在全世界范围内发生与流行,发病率最高可达60%,死亡率5%~20%不等,暴发时病死淘汰率在40%以上[4],现已被世界各国的兽医与养猪业者公认为是继猪繁殖与呼吸综合征之后最重要的猪传染病。研究表明,我国猪群中广泛存在PCV-2感染。郎洪武等[5]用ELISA检测来自北京、河北、山东等7省(市)22个猪群中共559份血清,检出的总阳性率为42.9%。王忠田等[6]用PCR对我国北京、天津、河北等省(市)的12个规模化猪场发病猪群进行PCV-2感染的流行病学调查,发现阳性检出率为96%。
用于检测PCV-2的PCR技术已经完全成熟,成为早期快速检测 PCV-2的重要手段[7-8]。由于ORF2作为PCV-2的主要结构蛋白,其编码基因与PCV-1的 ORF2核苷酸同源性仅有 67%,所以在PCV-2的ORF2基因序列的保守区域内设计引物,能够准确检测出病毒。
本次调查是在结合流行病学、临床及解剖症状的基础上,从12个区县发病猪场采集了病料。发病猪场均为中小型猪场,存栏数在15头~350头之间,发病猪主要集中在20日龄~70日龄(87%),与2007年发生的HP-PRRS不同的是,许多病猪临床上并无皮肤红紫、耳朵发绀等症状,而是出现了生长不良、贫血和黄疸、皮肤病灶、神经症状、跛行等症状,诊断结果也表明94.59%的猪场均为PCV-2阳性。显示PCV-2已在重庆市的猪场里广泛存在,并且其危害性也大为增加。实验室诊断结果表明,HP-PRRS依然是重庆养猪业的巨大威胁,59.46%的猪场为阳性,51.35%的猪场为 PCV-2和 HPPRRSV双重感染,也发现国外PCV-2和PRRSV共同感染的比例很高[9],在美国高达 20%~60%,Ohlinger V E等对432个断奶仔猪多系统衰竭综合征(PMWS)样品的检查结果表明,PCV-2与PRRSV共同感染率高达75.9%。同时,研究发现,PCV-2与PRRSV共同感染促进了PCV-2的增殖,并且猪的病死率明显超过PCV-2或PRRSV单独感染[10]。此次发病猪场如果是PCV-2单独或者和其他病原混合感染,病猪死亡率保持在较低的水平(0%~43%),但是,一旦PCV-2和HP-PRRSV混合感染,则病死率明显上升(35%~100%),有3个猪场甚至全群发病,全群死亡。
对5个猪场的19份抗凝血进行附红细胞体检测,样品阳性率为94.73%,有2个猪场的全血样品几乎找不到完整的红细胞,相应的发病猪的高热、贫血和黄疸等临床症状也特别严重。近几年来国内越来越多关于各种动物附红细胞体感染率快速增加的报道,而人的附红细胞体病例也逐渐增多,严重影响了人类生命健康[11]。附红细胞体除了阻碍畜牧业的发展,还成为公共卫生安全的威胁。附红细胞体病目前有合适的治疗药物,因此猪场应合理用药,控制其发生和传播。
此次调查显示,发病猪场并无严重的细菌感染,而以PCV-2、HP-PRRSV、App和 TOX 4种猪病感染最为普遍,其中94.59%的被检猪场都是混合感染,89.19%的猪场都是3种以上疫病混合感染。究其原因,一方面由于近段时间,生猪价格居高不下,导致许多非业内人士转向养殖业,盲目大规模的引进猪种,但又缺乏相应的检疫、养殖和管理技术;另一方面,初夏雨季气候炎热潮湿,也是疫病发生和传播的重要诱因。由于PCV-2和HP-PRRSV都没有有效治疗措施,并且都能损害免疫系统引起并发和继发感染,甚至会导致免疫失败。所以,必须重视这两种疫病的防控工作,加强饲养管理和日常监测,重视消毒工作,谨慎引种,对病猪及时隔离,防止继发感染。
[1]郎洪武,王 力,张广川,等.猪圆环病毒分离鉴定及猪断奶多系统衰弱综合征的诊断[J].中国兽医科技,2001,31(3):3-5.
[2]Tian K G,Yu X L,Zhao T Z,et al.Emergence of fatalPRRSV variants:unparalleled outbreak sof atypical PRRS in China and m olecu lar dissection of the unique hallmark[J].PLoS one,2007,13(2):e526.
[3]Tong G Z,Zhou Y J,Hao X F,et al.High ly pathogenic porcine reproductive and respirato ry synd rom e[J].Em erg Infect Dis,2007,9(13):1434-1436.
[4]Harm s P A.Post-w eaning multisy stem ic w asting synd romecase studies[D].In:Proceedings of the Seventh Annual Iowa Swine Disease Conference on Sw ine Practitioners,1999:43-47.
[5]郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30(3):3-5.
[6]王忠田,杨汉春,郭 鑫.规模化猪场PCV 2感染的流行病学调查[J].中国兽医杂志,2002,38(10):3-6.
[7]吕艳丽,杨汉春,郭 鑫.用PCR检测猪圆环病毒II型[J].中国兽医学报,2002,22(6):552-554.
[8]芦银华,陈德胜,戴亚斌,等.用复合 PCR检测猪圆环病毒[J].中国兽医科技,2001,31(9):8-9.
[9]A llan G M,M cNeilly F,Ellis J,et al.Experimental infection of colostrum deprived piglets w ith porcine circovirus 2(PCV 2)and porcine rep rodu ctive and respiratory syndrome virus(PRRSV)poten tiates PCV 2 replication[J].A rch V irol,2000,145(11):2421-2429.
[10]Harms P A,Sorden SD,H albur PG,et al.Experimental rep roduction of severe disease in CD/CD pigs concurrently infected w ith type 2 porcine circovirusand porcine reproductive and respiratory syndrome virus[J].Vet Pathol,2001,38,528–539.
[11]李 妍,孙成栋.儿童附红细胞体病 1例[J].实用儿科临床杂志,2002,17(3):273.
