甘肃省猪日本脑炎血清学调查*
2010-09-26冯若飞马忠仁乔自林李明生冯玉萍林学仕
冯若飞,马忠仁,乔自林,李明生,李 佳,冯玉萍,龙 玲,林学仕
(1.西北民族大学生物工程与技术国家民委重点实验室,甘肃兰州 730030;2.甘肃省永靖县畜牧兽医工作站,甘肃临夏 731600)
日本脑炎(Japanese encephalitis,JE)又称流行性乙型脑炎(Epidemic encephalitis B),简称乙脑,是一种人与动物共患的蚊媒病毒性疾病,该病由黄病毒科黄病毒属B组虫媒病毒中日本脑炎病毒(Japanese encephalitis virus,JEV)引起的。该病最早发现于日本,主要在夏秋季节流行,曾称为“夏季脑炎”,目前主要发生及流行于远东及东南亚国家和地区,对人类危害巨大。在中国、日本和其他西太平洋国家中,JE是人类中枢神经系统(CNS)的最常见的虫媒病之一[1]。
JE对养猪业及人类健康造成巨大危害。我国动物感染JEV的区域和范围亦较广,很多种动物如猪、马、牛、山羊、绵羊、猴和家禽很易感染日本脑炎,其他如兔、大鼠、鸽、犬、鸭、野禽和爬行类也易感,小鼠和某些蜥蝎能被试验感染。1924年夏,日本和朝鲜暴发大规模的日本脑炎,病死率达 80%左右;1958年,越南发生日本脑炎流行[2]。我国是日本脑炎发病人数最多的国家之一,占世界总数的80%以上[3],全国各地区都有发生[4-6]。本病主要是危害学龄儿童,引起致死性脑炎。而近年来有向成人发展的趋势,尤其是老人,以脑病、循环衰竭为主要特征,病死率高达66%左右;怀孕妇女感染JEV能导致流产。约有30%的患者愈后残留有不同程度的后遗症,主要表现是意识障碍、痴呆、失语及肢体瘫痪。猪在JE流行环节中是主要传染来源,是主要的扩散宿主,在散播病毒方面起着非常重要的作用,蚊虫可以通过叮咬来传播JEV[7]。猪感染JEV后潜伏期3 d~4 d,患病幼畜高热稽留,精神沉郁,步行踉跄,最后身躯麻痹而死;育肥猪持续高热;妊娠母猪主要表现为流产、产死胎、畸形胎、木乃伊胎及弱仔;公猪的睾丸肿大,局部发热,最后萎缩变硬[1]。
因此,JE的流行病学调查、诊断和防控对规模化养猪业的健康发展具有重大的意义,也具有重大的公共卫生学意义。目前,甘肃省对人及猪感染此病的调查较少,仅天水市2003年对人患JE进行了调查。甘肃省兽医总站2000年曾应用红细胞凝集抑制试验对甘肃省14个地区规模化养猪场JE的血清学进行了检测。为了进一步掌握甘肃省猪群中感染发展变化情况,进行了如下调查研究。
1 材料与方法
1.1 材料
1.1.1 血清样品 2008年6月~10月期间收集甘肃省部分地区3月龄以下猪血清样本422份,标记PA组,3月龄以上猪血清样本836份,标记PB组,所有样品均保存在-70℃备用。
1.1.2 抗原及阴阳性对照血清 抗原SA 14-14-2减毒活疫苗购自兰州生物制品研究所;阴性、阳性血清为西北民族大学生物工程与技术国家民委重点实验室保存提供。
1.1.3 试剂与耗材 包被缓冲液(0.05 moL/L,pH 9.56,500 mL),洗液(20×),酶稀释液,A+B底物显色液,HRP-兔抗猪IgG为北京拜尔迪公司产品,封闭液,M EM细胞培养液和2.5 g/L胰蛋白酶(Gibco),96孔酶标板等。
1.1.4 仪器设备 MK 3酶标定量测定仪为美国Thermo公司产品,ZMX-988B全自动酶标洗板机为北京天石公司产品。
1.1.5 细胞 BHK-21细胞为甘肃省动物细胞工程技术研究中心提供。
1.2 方法
1.2.1 抗原的制备 将JEV减毒活疫苗用MEM复溶并稀释,接种于BHK-21细胞中,37℃转瓶培养4 d~5 d后开始观察,待病变达75%以上收毒,反复冻融3次,3 500 r/min离心10 min,收取上清并过滤除菌,置-70℃保存备用。
1.2.2 包被、封闭 上述病毒液进行浓缩纯化,测定病毒滴度,稀释后37℃包被;包被完成后分别加入含有牛血清白蛋白(BSA)的封闭缓冲液,4℃过夜。
1.2.3 检测 用生理盐水(1∶40)稀释待检血清,每样2孔,设立阳性对照、阴性对照各3孔,空白对照2孔,每孔100μL。空白对照加生理盐水。将加好样的板放在37℃温箱卵育1 h,酶标洗板5次,浸泡时间为60 s;每孔加入100μL HRP-兔抗猪酶标二抗(1∶1 000),37℃温箱卵育1 h,酶标洗板5次,浸泡 60 s;每孔加入 A、B底物显色液各 1滴(50μL),室温避光显色15min,每孔再加入50μL终止液终止反应,使用酶标定量测定仪采用450 nm/630 nm双波长读数并分析。
2 结果
2.1 甘肃省不同地区猪JE抗体检测结果
对甘肃省内10个地区1 258份猪血清进行检测,结果阳性922份,总阳性率为73.3%,结果见表1。其中,陇南和天水为最高,抗体阳性率分别为81.2%、81.8%,高于平均阳性率的地区还有兰州和白银地区;甘南、酒泉最低,分别为50%、52.6%,其他地区均接近平均阳性率。这些差异可能源于地区气候差异,陇南、天水夏季湿润高温,适宜蚊蝇孳生,这也符合JE的流行特点。3月龄以下猪JE抗体总阳性率为63.7%,3月龄以上猪血清中JE抗体总阳性率为78.1%,通过t检验,二者差异极显著。
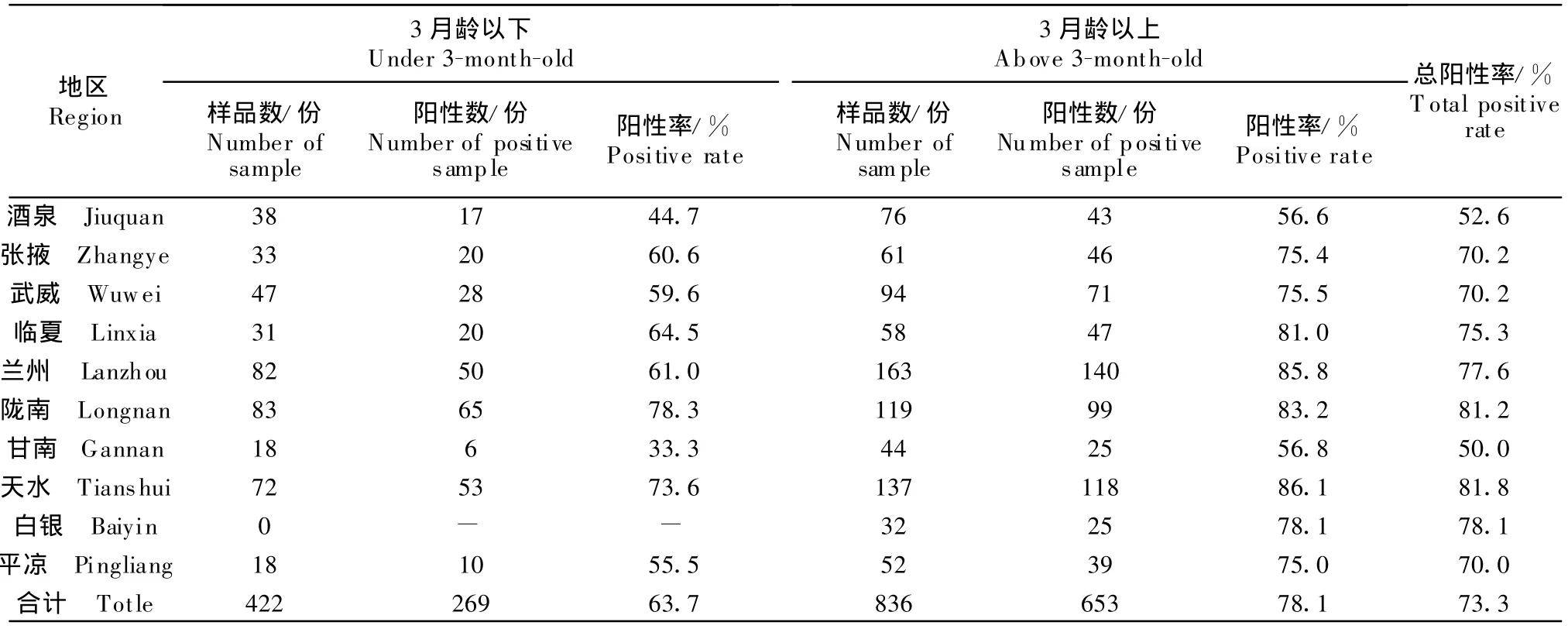
表1 甘肃省不同地区猪血清JEV抗体检测结果Table1 Detecing resu lts of an ti-JEV antibody among pigs in different regions of Gansu province
2.2 甘肃省不同地区猪JE抗体阳性强度比较
通过比对各地区感染强度,结果见表2。发现3月龄以下猪JEV抗体水平强度较低,S/CO值基本都小于5,而3月龄以上强度有所加强,均高于3月龄以下猪群。总体上,所有地区抗体强度S/CO≤5比率较高。
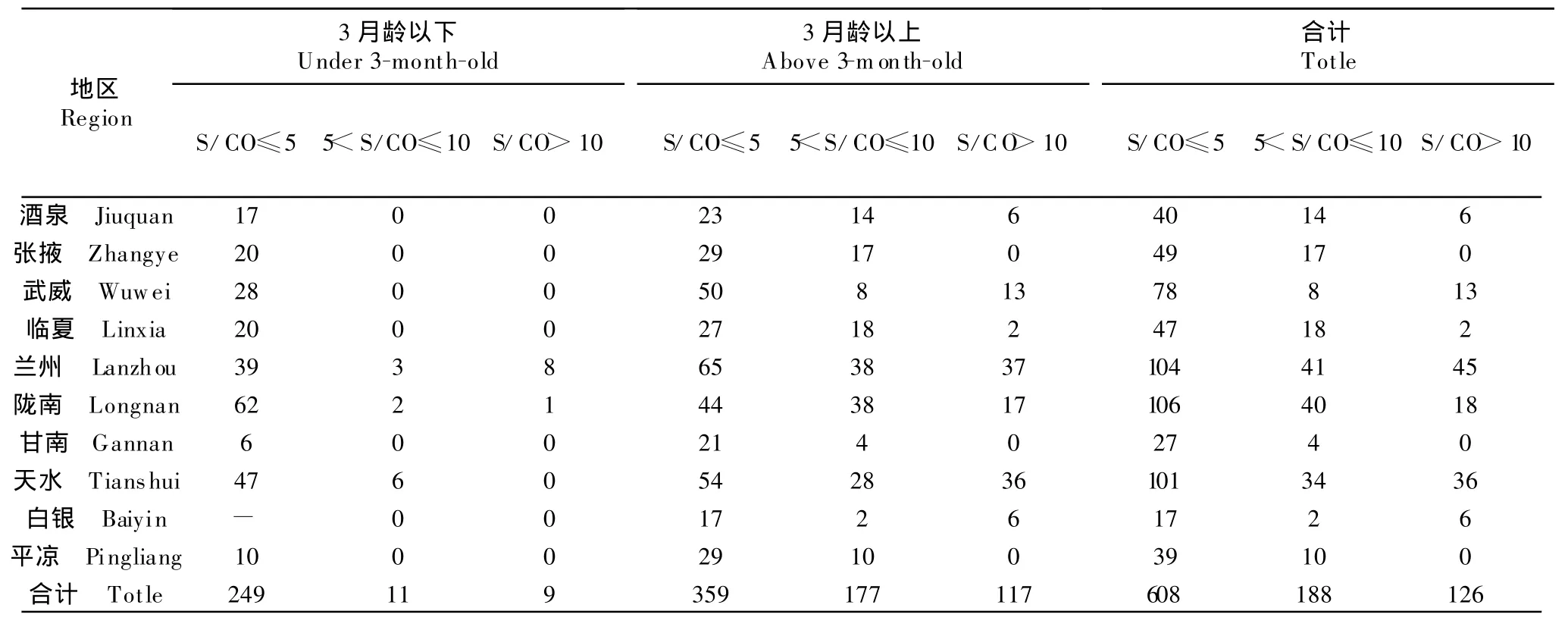
表2 甘肃省不同地区猪JEV阳性抗体强度比较(S/CO值=OD/cutoff值)Table2 Comparison of anti-JEV antibody density among pigs in different regions of Gansu province
3 讨论
经统计甘肃省猪群JEV感染率为73.3%,这一感染率比北京[8]、珠海[9]、河北、山西[10]要高,略低于丽水市[11]、上海市[12]等。2000年甘肃省规模化养猪场JE的血清学调查结果表明,JE总阳性率为15.56%[13],差异较大,可能存在近几年甘肃省猪JE感染率大幅度上升,亦或检测方法灵敏度不同造成,具体尚需试验证明。
仔猪的抗体主要来源于母乳,而自身免疫系统不健全,自己尚不能分泌,待满月后,母源抗体水平逐渐下降。待自身也有能力分泌抗体时,一旦接触到JEV就会受到感染或免疫接种,才会产生较高水平的抗体,但具体感染期、抗体水平维持时间尚不清楚,需进一步试验研究。
通过本次血清学调查,说明甘肃省猪群存在较高的JEV感染,且潜在的危害不可忽视,应积极采取措施加强防治,尤其是阳性率较高的地区要加强防蚊,灭蚊和免疫接种等工作。本次调查主要检测血清中JE抗体,只能说明该猪正在感染或曾经感染过,但不能绝对代表猪群发病,属间接调查了猪感染的情况。尚可以进一步对血清采用 RT-PCR法扩增,对阳性扩增产物进行克隆和测序,并对序列进行分析,确定其基因型,可以更好的了解和研究猪感染JEV的规律和病毒突变、进化等,并且可以早期诊断,对于开展日本脑炎的预防工作具有重要意义。
[1]殷 震,刘景华.动物病毒学[M].北京:科学出版社,1997:631-640.
[2]孙圣福.日本乙型脑炎实验室诊断方法的研究和应用[D].湖北武汉:华中农业大学,2004.
[3]余福勋,吴振溢,曾贵金,等.流行乙型脑炎患者 IgG抗体对乙脑病毒蛋白的识别[J].中国人兽共患病杂志,1998,14(1):27-29.
[4]王晓军,张彦平,张荣珍,等.中国1998-2002年流行性乙型脑炎流行趋势分析[J].中国计划免疫,2004,10(4):215-217.
[5]陈园生,梁晓峰,王晓军,等.中国2000-2004年流行性乙型脑炎流行病学特征分析[J].中国计划免疫,2006,12(3):196-198.
[6]李艺星,尹遵栋,李军宏,等.中国2004-2006年流行性乙型脑炎流行病学特征分析[J].中国计划免疫,2007,13(6):528-532.
[7]崔奕杰.猪乙型脑炎病毒检测方法的建立[D].河北保定:河北农业大学,2006.
[8]靳兴军,韩 磊,纪蔚红,等.北京市猪乙型脑炎血清流行病学调查[J].中国兽医杂志,2008,44(8):51.
[9]孙 虹,俞守义,马洪波,等.珠海地区猪乙脑病毒血清抗体调查和传播媒介监测[J].中国人兽共患病学报,2007,23(1):94.
[10]杨慧芳,南国兴,李贞华,等.猪乙脑IgG抗体检测[J].中国卫生检验杂志,2008,18(3):568.
[11]赵伯荣.丽水地区猪乙型脑炎的调查[J].浙江畜牧兽医,1988(1):18.
[12]邓 永,徐高原.猪乙型脑炎研究进展[J].养殖与饲料,2007,(6):43-46.
[13]韩庆彦,魏润生,陈轶霞,等.甘肃省规模化养猪场乙型脑炎的血清学调查[J].动物医学进展,2001,22(1):91-92.
