O型口蹄疫病毒VP1基因在毕赤酵母中的表达及免疫原性分析
2010-09-26龚劲峰何校澎黄辉荣刘德辉张春红黄毓茂
焦 颖,龚劲峰,何校澎,黄辉荣,刘德辉,张春红,吴 锋,黄毓茂
(华南农业大学兽医学院,广东广州 510642)
口蹄疫病毒(Foot-and-mouth disease virus,FMDV)属小RNA病毒科口蹄疫病毒属,病毒粒子呈球形,非严格的正 20面体。完整的病毒衣壳由VP1、VP2、VP3和VP4等 4种结构蛋白各60个分子组成[1]。O型FMDV至少有5个抗原表位,其中有3个存在于VP1上,分别为 B细胞抗原表位(141 aa~160 aa)、T细胞抗原表位(200 aa~213 aa)以及位于VP1蛋白的pB-C环上的抗原表位(40 aa~60 aa),均能诱导机体产生中和抗体[2-3]。由于VP1基因为FMDV主要的免疫原性基因,常被用于FMDV基因工程亚单位疫苗的靶基因。然而,国内对O型FMDV VP1基因的研究报道多以该基因的克隆表达和该基因的几个抗原表位的表达、免疫原性研究为主,而对VP1全基因进行真核表达并作免疫原性研究的报道较少[4]。因此,O型FMDV VP1全基因疫苗的研究对于预防口蹄疫仍具有重要的应用价值。
目前,我国控制该病的流行主要通过疫苗预防接种的方法,然而至今尚未有成熟的口蹄疫基因工程疫苗产品代替传统疫苗。因此,开发免疫原性更好、价格更为低廉的新型疫苗依然有其紧迫性。毕赤酵母(Pichia pastoris)作为一种较为成熟的表达系统,具有原核生物生长快、易工业化的特点,并具备高效的表达量、良好的发酵与分泌性能,同时具有真核细胞表达系统的修饰功能,表达产物生物学活性好等优点[5]。鉴于此,本研究将FMDV VP1基因插入到pPICZα-C表达载体上,通过电激转化整合到X-33菌的基因组中,筛选出高效表达的工程菌,并研究其免疫学活性,为研制FMDV酵母基因工程疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性Balb/c小鼠,6周龄~8周龄,购自南方医科大学实验动物中心。
1.1.2 菌株和质粒 毕赤酵母受体菌X-33(H is-/Mut+)、表达载体pPICZα-C购于Invitrogen公司;大肠埃希菌(Escherichia coli)DH 5α为华南农业大学兽医学院实验室保存。含有O型FMDV VP1基因表达盒的重组质粒pMD-L-2A,由华南农业大学兽医学院龚劲峰构建并保存。
1.1.3 主要试剂 Ex Taq DNA聚合酶、T DNA Ligase、限制性内切酶XhoⅠ、XbaⅠ、SacⅠ以及预染蛋白质低分子标准购自宝生物工程(大连)有限公司;胶回收试剂盒购自Omega公司;Zeocin购自Invitrogen公司;H RP标记的兔抗猪IgG抗体购于晶美生物技术有限公司;弗氏完全佐剂与弗氏不完全佐剂购自Sigm a公司,O型口蹄疫ELISA检测试剂盒为PRIONICS公司产品,FMDV抗体标准阳性的免疫猪血清为O型FMD正向间接血凝抗原试剂盒购于中国农业科学院兰州兽医研究所,其他试剂均为进口或国产分析纯产品。
1.2 方法
1.2.1 引物 参照GenBank上注册的O型FMDV基因组序列(HKN/2002),使用Primer Premier 5.0设计了1对引物 P1、P2,在 5′端设计了 Xho Ⅰ酶切位点并引入Kex2、Ste13蛋白酶裂解位点,以确保信号肽的完整切割,获得目的蛋白。3′端设计了XbaⅠ酶切位点,序列全长为677 bp。
P1:5′–CCCTCGAGAAGAGAGAGGCTGAAGCTACCACCTCTGCGGGTGAGTCT-3′;
P2:5′-GCTCTAGATCACTGTTTTGCGGGTGCCA-3′。
1.2.2 重组酵母表达载体的构建 以质粒pMDL-2A为模板,用P1和P2引物进行PCR扩增,将获得的VP1基因片段用XhoⅠ和XbaⅠ酶切,琼脂糖凝胶电泳回收后,将FMDV VP1基因片段克隆入表达载体pPICZα-C的XhoⅠ和XbaⅠ位点,转化DH 5α感受态细胞。经筛选鉴定为阳性的克隆,进行基因序列的分析鉴定。
1.2.3 携带目的基因的重组酵母的构建 采用电穿孔转化法,将SacⅠ线性化后的质粒pPICZαCVP1与感受态Pichia pastoris X-33(His-/M ut+)混合,转移至预冷的 0.2 cm电转杯中,置冰上5min,1.5 kV电击 5 m s。电转化后立即加入1mL预冷的1 mol/L的山梨醇,轻轻混匀后将转化物移入5mL的培养管。30℃静置培养0.5 h,然后加入1mL YPD液体,30℃,200 r/min振荡培养0.5 h。离心收集菌体,用含有100 mg/L ZeocinTMYPD平板进行筛选,于30℃温箱中培养至单菌落出现(需要3 d~5 d)。
1.2.4 重组毕赤酵母菌的诱导表达 将筛选到的具有Zeocin抗性的单菌落接种到30mL的BMGY液体培养基中进行激活培养,于30℃以200 r/min振荡过夜,至OD600=2~6,此时细胞处于对数生长期。3 000 r/min离心5min收集沉淀,重悬于3mL的BMMY中,继续振荡培养。期间每隔24 h加入纯甲醇至终浓度为10 mL/L,进行诱导培养。96 h后,3 000 r/min离心5min,收集培养液上清,进行表达产物的SDS-PAGE分析,用考马斯亮蓝R-250染色及凝胶成像系统拍照。
1.2.5 SDS-PAGE和Western blot检测 取重组酵母菌发酵上清,经SDS-PAGE分离蛋白质后,电转移至硝酸纤维素膜上。滴加50 g/L脱脂奶粉溶液于室温封闭90 min。洗膜后,加入一抗为O型FMD标准阳性血清(1∶200稀释于10 g/L脱脂奶粉溶液/TBS溶液),室温缓慢振摇过夜。洗膜后,加入按1∶1 000稀释的HRP标记羊抗猪酶标二抗,室温缓慢振摇作用至少2 h。最后加DAB作用5 min显色后,用蒸馏水洗涤终止反应,观察结果。
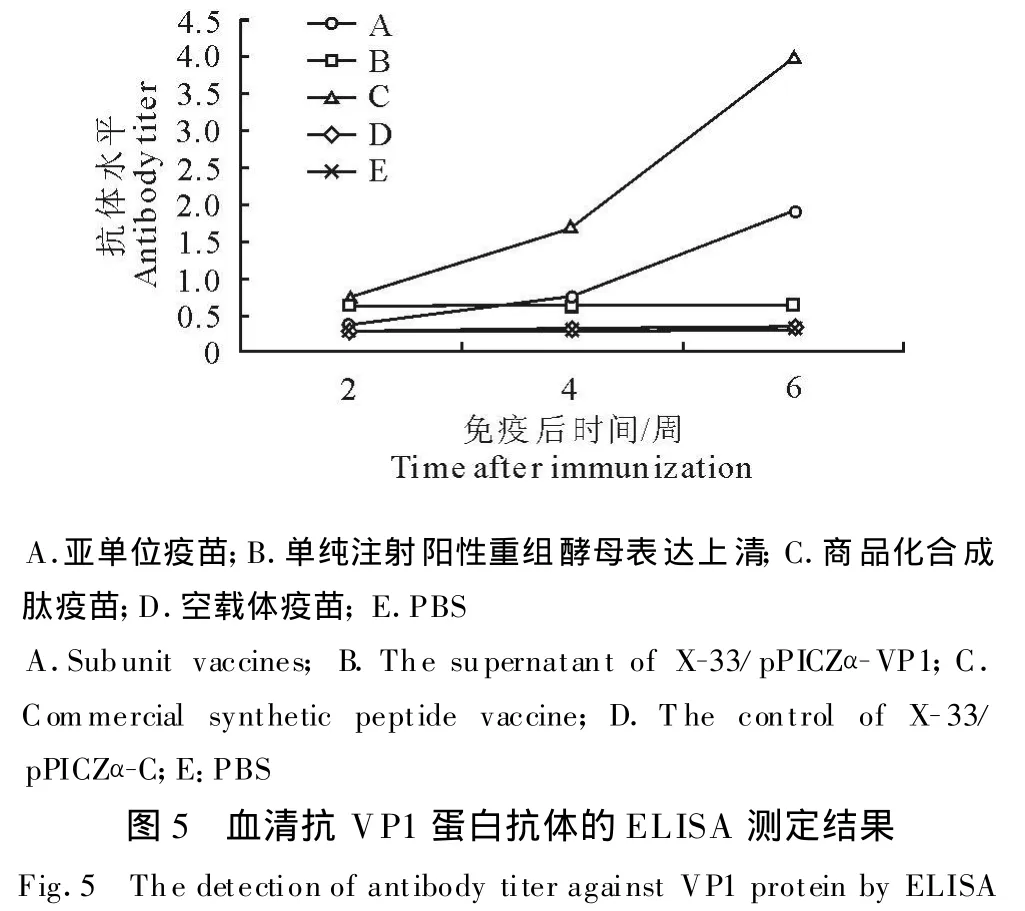
1.2.6 动物免疫试验 选用 Balb/c小鼠30只,随机分为5组,每组6只。分组如下:A组为亚单位疫苗,将重组酵母表达上清分别与弗氏完全(不完全)佐剂疫苗混合、乳化,使VP1蛋白其浓度为1μL,100μg/只;B组为单纯注射重组酵母表达上清,注射剂量为100μg/只;C组为商品口蹄疫合成肽疫苗,按照商品说明动物重量计算注射剂量为20μL/只;D组-酵母空载体苗,用弗氏佐剂与酵母空载体表达上清混合制成乳剂,100μg/只;E组为PBS空白对照组,注射剂量100μL/只。以上各组疫苗多点注射于小鼠背部皮下。
1.2.7 免疫小鼠体液免疫应答的检测 于免疫接种后第2、4、6周,各组小鼠均经断尾采血,离心分离血清,用ELISA试剂盒检测血清抗FMDV VP1蛋白抗体的滴度。将试剂盒中的二抗换为1∶1 000 HRP标记的山羊抗小鼠IgG。最后用酶标检测仪进行测定,数据用SAS生物统计软件进行分析。
2 结果
2.1 重组酵母表达载体的构建
利用特异性的引物 P1、P2进行PCR扩增,于8 g/L的琼脂糖中电泳检测,得到一条特异的DNA带,大小约为677 bp(图1),与预期的结果相符。回收的VP1基因经定向插入酵母表达载体pPICZα-C,用XhoⅠ、XbaⅠ双酶切,SacⅠ单酶切琼脂糖中电泳检测,出现约677 bp的条带(图2),与预期结果相符,最后送检测序,结果证明为阳性重组质粒,命名为pPICZαC-VP1。
图1 VP1基因PCR的扩增产物Fig.1 PCR productsof VP1 gene
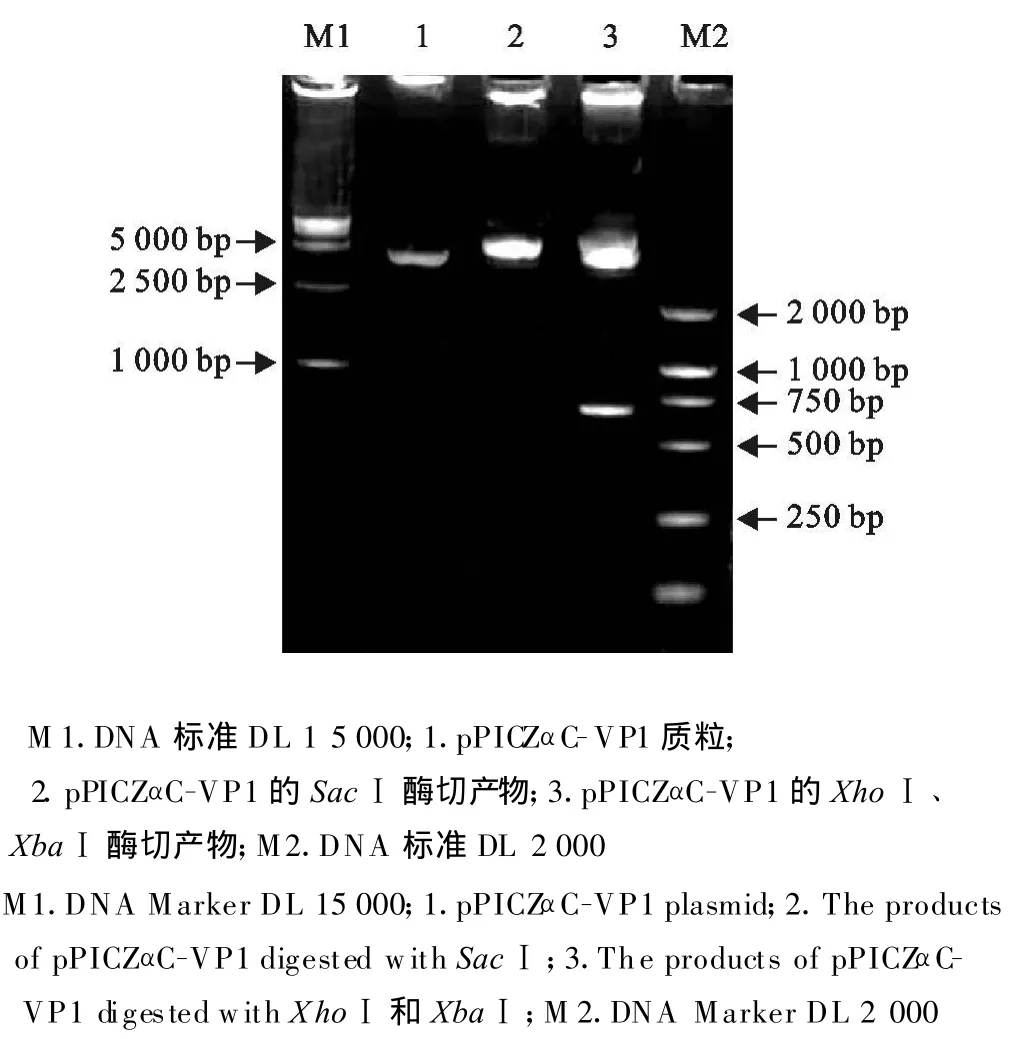
图2 重组质粒pPICZαC-VP1的酶切鉴定Fig.2 Restriction enzyme digestion analysis of the recombinant plasmid pPICZαC-VP1
2.2 重组酵母诱导表达VP1基因的鉴定
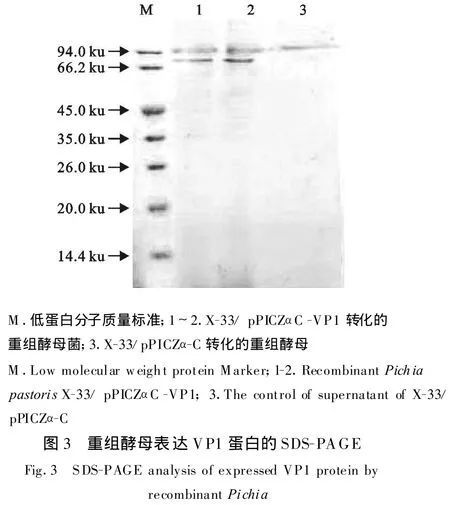
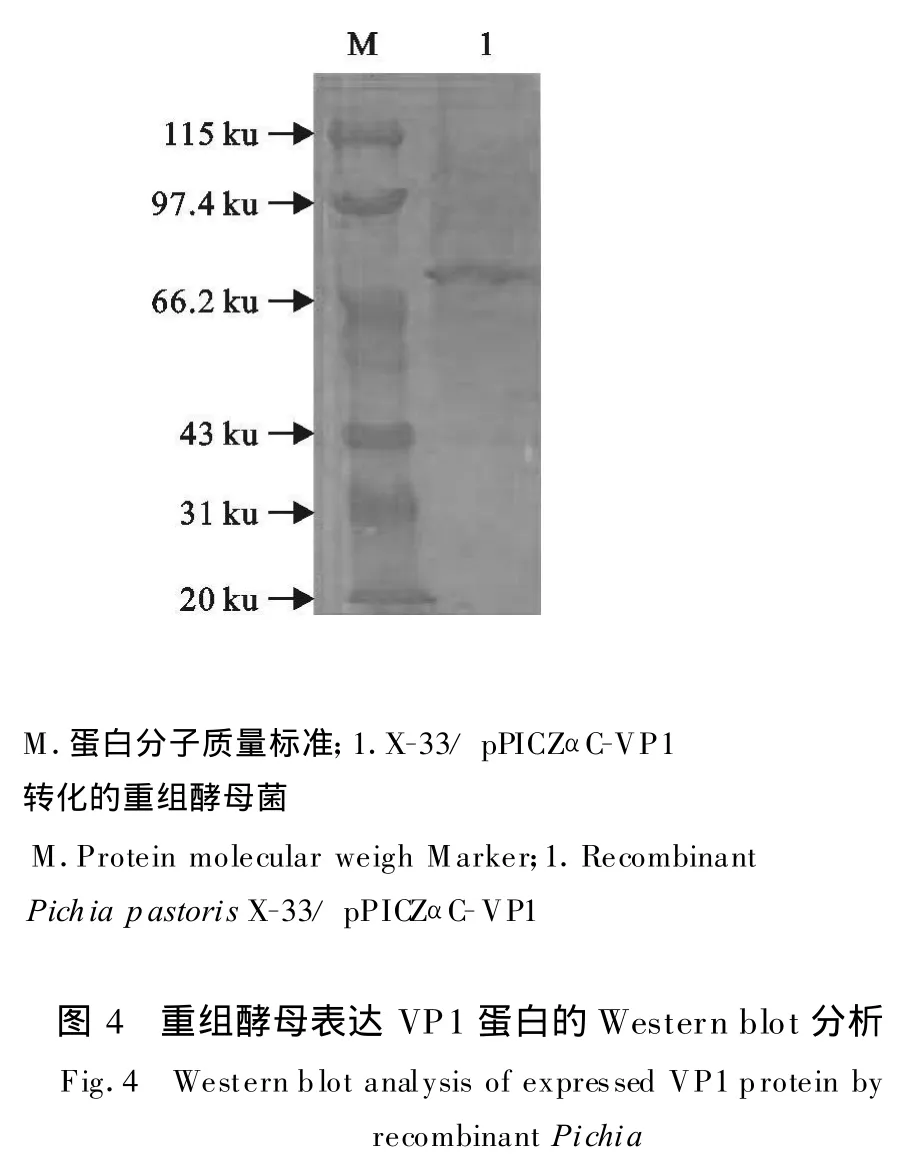
将含pPICZαC-VP1质粒的阳性重组酵母进行诱导表达,取表达上清经 SDS-PAGE进行检测分析,与诱导的pPICZα-C空载体转化重组酵母菌表达上清比较,在70.0 ku附近可见一条特异的蛋白质条带,与预期蛋白的大小一致(图3),薄层扫描系统分析,计算得到目的蛋白表达量最高为25.2 mg/L。Western blot印迹表明,该蛋白能与O型FMDV阳性血清发生特异反应,具有抗原性(图4)。
2.3 免疫小鼠体液免疫应答水平检测
从图5可见,接种自制VP1亚单位疫苗(A)的小鼠二免后与对照组(D、E)相比,小鼠血清中产生FMDV特异性抗体,但明显低于商品化合成肽疫苗组,而单纯注射阳性重组酵母表达上清的小鼠仅产生微弱的抗体。酵母空载体和PBS组抗体水平接近,证明载体对小鼠机体无非特异抗原刺激。
3 讨论
毕赤酵母(Pichia pastoris)基因工程的表达系统是近年来发展很快的一个真核表达系统,其应用越来越广泛。目前已有HBsAg、TNF基因工程抗体等400多种外源基因在该系统中表达,不乏每升克级以上的表达[6]。有研究表明,毕赤酵母高密度发酵培养表达量是摇瓶培养的10倍以上[7]。酵母表达载体有多种,本试验选用的pPICZαC分泌型表达载体,可通过整合型载体将外源基因整合到酵母染色体上,获得遗传性稳定重组子。外源基因在酵母中的表达一般是采用酵母基因的启动子,而且能通过前导信号肽引导外源蛋白的分泌表达,并能识别及有效地切割这些信号肽[8-9]。由于毕赤酵母自身分泌的蛋白(背景蛋白)非常少[10],本研究在构建重组载体时,未加上纯化用的标签,这主要是担心标签可能会影响蛋白质折叠,从而影响目的蛋白的生物活性[11]。研究结果表明,在多步筛选后,得到的阳性菌株十分理想,分泌表达的目的蛋白量高,杂蛋白质少。
在大容量、高密度培养过程中,为提高酵母的表达量,需要将细胞扩增与表达阶段分开。在生物量扩增阶段,只加少量甘油就能满足细胞快速生长,抑制AOX的表达;在表达阶段加入甲醇,目的蛋白就能得到诱导表达,这时酵母生长极其缓慢[12]。由于毕赤酵母的高密度培养和长时间的诱导表达会导致蛋白水解酶升高,后者会引起表达产物降解、变性失活[13],最终获得目的蛋白产量低于预期。本研究采用低温浓缩诱导表达的方式,通过降低诱导期间的温度使酵母细胞比在30℃条件下诱导的死亡数量下降,从而减少蛋白酶的释放,降低发酵液中蛋白酶的活性,减轻对目的蛋白的降解,间接提高了表达量[14-15]。
本研究成功构建了重组表达质粒 pPICZαCVP1,实现了VP1基因在毕赤酵母中的高水平分泌表达,经SDS-PAGE和Western blot检测表明表达的蛋白能与抗FMD阳性标准血清发生特异性反应。在动物试验中,由于未纯化蛋白,为排除酵母自体蛋白的影响,特别设立酵母空载体对照组。动物免疫试验表明,利用重组酵母表达的目的蛋白作为免疫原,能刺激小鼠产生特异性体液免疫应答。酵母空载体和PBS组抗体水平接近,证明载体对小鼠机体无非特异抗原刺激。以上研究成果,为解决口蹄疫疫苗规模化生产,降低生成成本,并将其应用到临床等提供了试验基础。
[1]毕英佐.口蹄疫[M].广东广州:广东科技出版社,2005.
[2]Grubman M J,Baxt B.Foot-and-mouth disease[J].C lin M icrobiol Rev,2004,17:465-493.
[3]M ason PW,G rubman M J,Baxt B.Molecular basis of pathogenesis of FMDV[J].Virus Res,2003,91:9-32.
[4]周国辉,于 力.A sia1型和O型口蹄疫病毒中和性单克隆抗体的免疫保护性[J].中国预防兽医学报2009,31(4):300-304.
[5]Cereghino G P,Cereghino J L,Ilgen C,et al.Production of recom binant proteins in ferm en ter cultu res of the yeast Pichia pastoris[J].Cu rr Opin Biotechnol,2002,13(4):329-332.
[6]H ou J,Yan R,Yang L,et al.High-level expression of fusion p rotein containing 10 tandem repeated GLP-1 analogs in yeast Pich ia pastoris and its biologicalactivity in a diabetic ratmodel[J].Biosci Biotechnol Biochem,2007,71(6):1462-1469.
[7]X iongA S,Yao Q H,Peng RH,etal.H igh levelexpression of a synthetic gene encoding Peniophora lycii phytase in m ethylotrophic yeast Pichia pastor is[J].Appl M icrobiol Biotechnol,2006,72(5):1039-1047.
[8]Yin J,L iG,Ren X,et al.Select w hat you need:a comparative evaluation of the advantages and lim itations of frequen tly used expression sy stems for fo reign genes[J].J Biotechnol,2007,127(3):335-347.
[9]Daly R,Hearn M T.Expression of heterologous proteins in Pich ia pastoris:a useful experimental tool in protein engineering and p rodu ction[J].JM ol Recognit,2005,18(2):119-138.
[10]Blanchard V,Gadkari R A,George A V,et al.High-level expression of biologically active glycoprotein hormones in Pichia pastor is strains selection of strain GS115,and notX-33,for the production of biologically active N-glycosy lated(15)N-labeled phCG[J].C lycoconj J,2008,25(3):245-257.
[11]申艳敏,魏建超,尚书文,等.人源抗菌肽LL-37在毕赤酵母中的高效表达及其活性检测[J].微生物学通报,2008,35(4):539-544.
[12]W ei C,Zhou X S,Zhang Y X.Improving intracellular production of recombinant protein in Pichia pastoris using an optim ized preindu ction g lycerol-feeding scheme[J].Appl M icrobiol Biotechnol,2008,78(2):257-264.
[13]Bahram i A,Shojaosadati S A,Khalilzadeh R,et al.Tw o-stage gly cerol feeding for enhancement of recombinant hG-CSF p roduction in a fed-batch cultu re of Pich ia pastor is[J].Biotechnol Letters,2008,30(6):1081-1085.
[14]方曙光,储 炬,黄 立,等.重组毕赤酵母表达reteplase发酵过程中的降解现象[J].华东理工大学学报,2006,32(12):1413-1417.
[15]W ang Y,Wang Z H,Du G C,et al.Enhancement of alkaline polygalacturonate lyase production in recombinant Pichia pastoris according to the ratio of methanol to cell concentration[J].Bioresource Technol,2009,100(3):1343-1349.
