4种动物虫媒病病毒多重RT-PCR检测方法的建立
2010-09-26阮周曦花群义杨俊兴曾少灵曹琛福秦智锋吕建强林庆燕周晓黎
阮周曦,花群义*,杨俊兴,曾少灵,曹琛福,秦智锋,吕建强,林庆燕,周晓黎
(1.深圳出入境检验检疫局,广东深圳 518100;2.云南出入境检验检疫局,云南昆明 650228)
随着全球气候的变化和生态环境的改变,蓝舌病(Bluetongue,BLU)、鹿流行性出血热病(Epizootic hemorrhagic disease of deer,EHD)、水疱性口炎(Vesicu lar stom atitis,VS)和赤羽病(Akabane,AKA)等4种动物虫媒病在全球范围内大范围流行和传播,严重威胁着动物健康和畜牧业发展[1-4]。这4种疫病症状相似,需要进行实验室鉴别诊断,而直接检测病原的快速诊断方法在疫病防控中尤其能发挥重要作用。其常规的病原学诊断方法是病毒分离鉴定、免疫荧光标记抗体检测和病毒核酸检测等。但这些方法中,病毒分离鉴定方法操作费时费力且存在生物安全隐患,免疫荧光抗体方法存在敏感性低、特异性差,而目前的病毒核酸检测方法只能进行单一疫病的检测等局限性[5-6]。因此,建立一种针对BLU、VS、EHD和 AKA,在同一个反应管内可同时对4种病毒进行快速鉴别检测的多重RT-PCR方法,在临床鉴别诊断和出入境动物检疫中具有实用价值。多重RT-PCR技术是近年来发展起来的一种可用于多种病原体检测的技术,其克服了单一RT-PCR在应对大量标本不同检测对象时的费时费力的问题,不仅具有特异性强、敏感性高的特点,而且能在较短时间内同时完成多种病毒的检测,尤其适合于临床上一些容易混淆又常常混合感染的疾病的鉴别诊断,是快速检测和鉴别类似病原或者混合病原感染的有力工具。本研究建立了一种可用于上述4种动物虫媒病病毒的多重RT-PCR检测方法,为快速鉴别4种病毒提供重要检测手段。
1 材料与方法
1.1 材料
1.1.1 病毒株 蓝舌病病毒(BTV)、鹿流行性出血热病病毒(EHDV)、水疱性口炎病毒(VSV)和赤羽病病毒(AKV)4种无感染性病毒核酸(RNA)由深圳出入境检验检疫局动检实验室课题组保存;猪水泡病病毒RNA和参考样品由英国动物卫生研究所Pirbright实验室引进。FMDV O疫苗株从云南保山疫苗厂引进,由深圳出入境检验检疫局动检实验室保存。
1.1.2 试剂 Total RNA提取试剂盒、Trizol Reagent购于美国Invitrogen公司;三氯甲烷、异丙醇、10 mm oL/L dNTP M ixture、25 mmoL/L M gCl2、AMV逆转录酶、Taq DNA聚合酶、40 U/μL RNase Inhibitor(RNA 酶抑制剂)、5×RT bu ffer、10 ×PCR buffer、150 bp DNA Ladder M arker、100 bp DNA Ladder Marker、RNA PCR K it(AMV)Ver3.0试剂盒等均购自宝生物工程(大连)有限公司。
1.1.3 引物设计及合成 根据基因库提供的BTV、EHDV、VSV和AKV各基因的序列,通过Blast分析软件分别对基因的序列进行分析,选择了高度保守和特异性强的区段,应用Primer软件设计多对引物,将合成的多对引物进行最佳配对筛选试验,并经过大量的反应条件优选、对比试验和验证试验,获得了分别位于BTV VP7基因、EHDVVP7基因、VSV N基因及AKV N基因的4对引物。扩增长度 BTV 为 351 bp、EHDV 为 537 bp、VSV 为301 bp、AKV为250 bp。引物由宝生物工程(大连)有限公司合成(表1)。
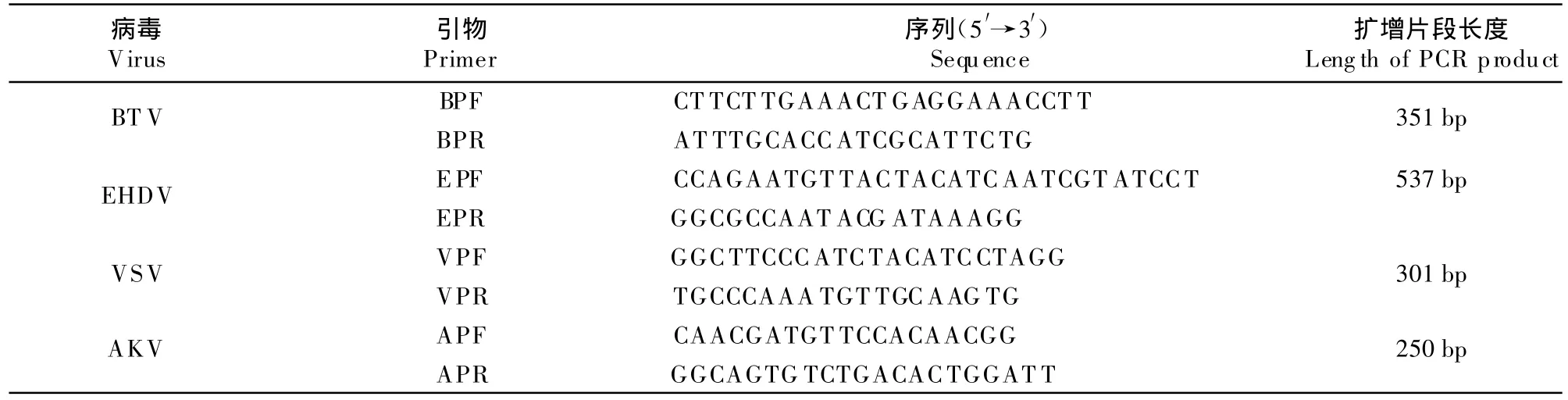
表1 多重 RT-PCR引物设计结果Table1 Resultsof primers designed for multiplex RT-PCR
1.2 方法
1.2.1 病毒RNA的提取 参照文献[5]的方法进行病毒RNA的提取。用核酸蛋白分析仪检测RNA的纯度和浓度,直接用于反转录或于-70℃保存备用。
1.2.2 cDNA的反转录 取200μL PCR反应管,反应总体积为20μL,RT 5×buffer 4μL,40 U/μL的RNA酶抑制剂1μL,10 mmoL/L dNTPs5μL,20μm ol/L的BTV、EHDV、VSV和AKV 下游引物各1μL,AM V(5 U/μL)逆转录酶1μL,模板 RNA 4μL,灭菌双蒸水补足至 20μL。置室温10min,42℃水浴60min,最后94℃5min灭活AMV逆转录酶,cDNA产物置冰盒冷却备用。
1.2.3 多重RT-PCR体系的建立 PCR反应在带热盖的Gene Amp PCR System 9700型中进行。分别将上述BTV、EHDV、VSV和AKV的cDNA产物作为模板,在管内分别加入相对应的4对引物进行PCR扩增。反应体系为50μL:10×buffer 5μL,10 mmoL/L dNTP 4μL,25 mmoL/L M gCl2 3 μL,5 U Taq酶1μL,20μmol/L 的BTV 、EHDV、VSV和AKV上下游引物各1μL,4种病毒模板cDNA 5μL,加水补足50μL。PCR反应循环参数为:94℃预变性5 min;94℃45 s,55℃45 s,72℃1 min,30个循环。72℃延伸10 min,取10μL PCR产物在20 g/L琼脂糖凝胶电泳检测,以Goldview染料替代EB,凝胶成像分析系统观察结果。
1.2.4 多重RT-PCR最佳反应条件的优化 参加PCR反应的5种重要成份即引物、酶、dNTP、模板和Mg2+,建立一个良好的PCR反应体系必须进行引物、dNTP和Mg2+浓度的优化。本试验中,在初步的反应体系、反应条件和循环参数检测出扩增条带后,分别利用4种病毒各自的引物进行单项 RTPCR方法最佳引物浓度、最佳dNTPs浓度及最佳Mg2+浓度的测定。之后,以4种病毒混合液分别提取RNA,以最佳引物浓度、最佳dNTPs浓度及最佳Mg2+浓度,利用梯度PCR仪进行多重PCR方法最佳退火温度的测定,确定最佳退火温度后,以确定的最佳条件进行多重PCR方法最佳循环次数的测定,以筛选出多重 RT-PCR反应体系中最佳的反应模式。
1.2.5 多重RT-PCR的特异性试验
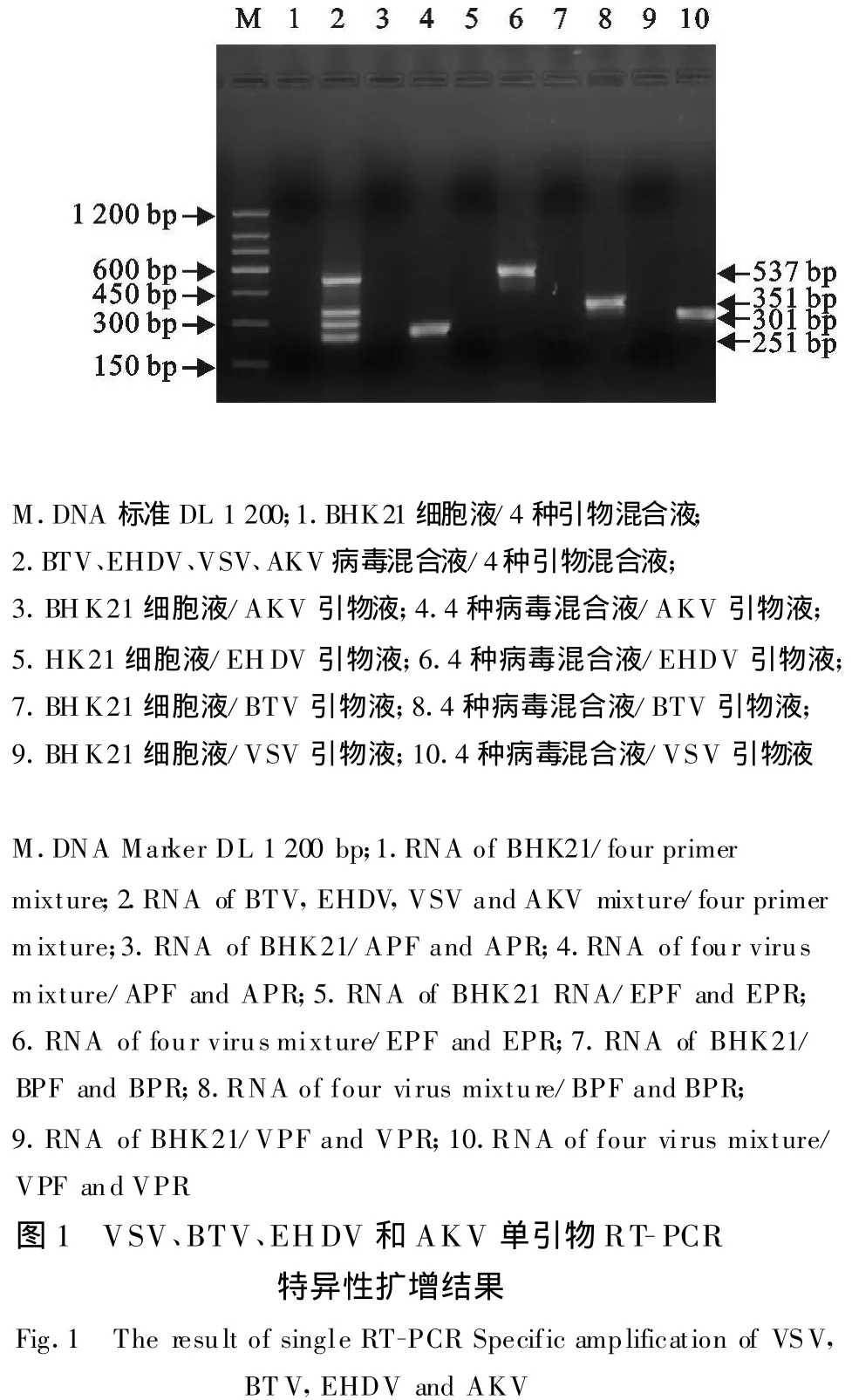
1.2.5.1 单引物对4种病毒混合液扩增的特异性 为了验证单引物的特异性,利用所选定的最佳反应条件,设计以下病毒样品和单引物组合来进行单引物特异性试验。采用4种病毒混合液总RNA与VPF/VPR引物液,4种病毒混合液总 RNA与BPF/BPR引物液,4种病毒混合液总RNA与EPF/EPR引物液,4种病毒混合液总RNA与APF/APR引物液,BHK 21细胞液总RNA与4种病毒各自的引物,分别进行RT-PCR,以检测各自引物的特异性。
1.2.5.2 4对引物对单一病毒扩增的特异性 为了验证利用4对引物进行多重RT-PCR时,相对应引物对各自病毒的特异性,用优化的最佳反应条件,设计以下病毒样品和多引物组合来进行多引物特异性试验:BTV病毒液或BTV模板与4种引物混合液,EHDV病毒液与4种引物混合液,VSV病毒液与4种引物混合液,AKV病毒液与4种引物混合液,BHK-21细胞液总RNA与4种引物混合液,分别进行多重RT-PCR,以检测多引物混合的特异性。
1.2.5.3 4对引物对4种病毒混合液扩增的特异性用优化的最佳反应条件,以BTV、EHDV、VSV、AKV 4种病毒混合液与4对引物混合液,BHK-21细胞液总RNA与4种引物混合液,分别进行多重RT-PCR,以检测4对引物对4种病毒混合液扩增的特异性。
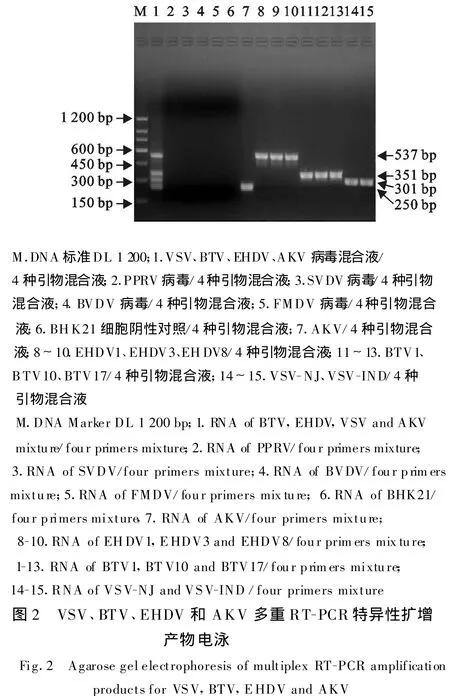
1.2.5.4 4对引物对相关或相似病毒扩增的特异性采用优化后的多重 RT-PCR最佳反应条件,用BTV 1、BTV 2、BTV 3、BTV 4、BTV 12、BTV 15、BTV 15 、EHDV 1 、EHDV 3 、EHDV 8 、VSV-NJ 、VSVIND 、AKV 、FMDV 、BVDV 、PPRV 、SVDV 的 RNA和BHK 21细胞总RNA为模板,用4种引物混合液进行多重PCR,以验证多重RT-PCR的特异性。
1.2.6 多重 RT-PCR的敏感性试验 将BTV、EHDV、VSV、AKV 4种病毒的总RNA混合液进行10倍系列稀释,采用多重RT-PCR最佳反应条件进行扩增,以评估多重RT-PCR同时检测4种病毒的敏感性。
1.2.7 PCR产物分析和测序 取10μL PCR产物在20 g/L的琼脂糖凝胶电泳检测,以Goldview染料或用含0.5μg/mL溴化乙锭染色。配胶及电泳缓冲液均为 1×TAE(0.04 moL/L,Tris-乙酸,0.001m oL/L EDTA,pH 8.8),120 V电泳40min,在紫外凝胶成像系统中观察PCR产物在凝胶中的位置 ,用 150 bp DNA Ladder M arker、100 bp DNA Ladder M arker为参照判定结果。单引物RT-PCR产物回收纯化后经过与pMD18-T载体的连接反应(16℃连接30 min),然后将连接反应液热转化至E.coli JM 109感受态细胞,在含有 IPTG、X-Gal的L-Amp平板培养基上培养。挑取白色菌落进行小量培养,碱裂解法提取质粒,送宝生物工程(大连)有限公司测序。所得的产物序列输入 GenBank,用Blast进行同源性比对。
1.2.8 临床样品的检测 将深圳出入境检验检疫局动检实验室保存的BTV、EHDV、VSV、AKV临床样品共97份(其中 BTV样品35份、EHDV样品21份、VSV样品9份、AKV样品32份),分别进行 RNA提取、反转录、多重RT-PCR,并与相关国家标准或行业标准方法(GB/T18089-2008)、GB/T22916-2008、SN/T1128-2007)等检测结果进行比较。
2 结果
2.1 最佳反应条件的优化
经过对 BTV、EHDV、VSV、AKV 共4对引物的最佳浓度、dNTP的最佳浓度、最佳退火温度和最佳循环次数的测定,结果表明,在50μL反应体系中,以BTV的引物(BPF/BPR)最终浓度各为 25 pmol、EHDV的引物(EPF/EPR)最终浓度各为40 pmol、VSV的引物(VPF/VPR)最终浓度各为 20 pmol、AKV的引物(APF/APR)最终浓度各为25 pmol,dNTP浓度为400μmol/L,Mg2+浓度为250μmo l/L,最佳退火温度为56℃,循环次数30次。在此反应条件下,PCR扩增效率高,产物量大,4种病毒的目的基因扩增条带最清晰,无非特异性条带出现。PCR反应循环参数为:94℃5min;94℃45 s,56℃45 s,72℃1min,30个循环。
2.2 单引物特异性扩增结果
4种病毒对应的特异性引物只能从病毒混合液中扩增出相应的病毒核酸。如BTV(351 bp),EHDV(537 bp),VSV(301 bp)and AKV(250 bp),而用4种引物混合液和各自的引物对BHK 21细胞液总RNA的扩增均为阴性,说明单引物扩增的特异性强。从图1可见,4种病毒扩增的各个片段与预期设计的片段大小相符。对PCR扩增产物的克隆测序获得的序列,经DNA Star软件分析,这些序列分别与参考序列一致。
2.3 多重RT-PCR特异性扩增结果
将4对特异性引物加入同一反应管内,以分别在每管加入VSV、BTV、EHDV和AKV的RNA模板,均只扩增出相应病毒目的基因的单一条带,而在其中一管加入了4种病毒RNA,经多重PCR可同时扩增出了 VSV(301 bp)、BTV(351 bp)、EHDV(537 bp)和AKV(250 bp)4条特异性片段,与预期大小一致。但对 FMDV、BVDV、PPRV、SVDV 的RNA和BHK 21的扩增结果均为阴性,没有出现任何非特异性条带,该多重RT-PCR方法的特异性好,结果见图2。4种病毒对应4种引物出现了大小不同的4条目的条带,单一引物对4种病毒混合模板的检测结果只能检测出引物相应的病毒目的基因,而对其他3种病毒的目的基因未能扩增,交叉使用引物或模板没有目的条带,4对引物之间没有交叉反应。表明所建立的多重RT-PCR方法无论针对混合病毒模板还是单一病毒模板均可有效检测特定病毒核酸,同时也说明所设计的引物特异性强。
2.4 多重RT-PCR敏感性试验结果
以BTV、EHDV、VSV、AKV 共 4种病毒的BHK 21细胞培养物为检测对象,各取250μL混合,提取总 RNA 后,系列稀释成 100、10-1、10-2、10-3、10-4、10-5、10-6、10-7,以 4 种病毒的 4 对引物混合液对其进行多重PCR扩增检测,每个稀释度同时做3个重复试验。结果4种病毒均可检测到稀释成10-7的样品,结果如图3。
2.5 多重RT-PCR对各血清型病毒的检测结果
为确定4种特异性引物对相应病毒各型或病毒株的检测特异性和通用性,分别以BTV 1型~BTV 24型、EHDV 1型 ~EHDV 8型、VSV-N J型、VSV-IND型、3株AKV病毒的 RNA为模板,用4种引物混合液分别进行多重 RT-PCR扩增,表明BTV、EHDV、VSV和AKV的特异性引物分别对相应的 BTV 1型 ~BTV 24型病毒、EHDV 1型 ~EHDV 8型病毒、VSV-NJ型和VSV-IND型病毒以及AKV病毒的检测均获得阳性结果。如图4为VSV和AKV RT-PCR扩增产物电泳结果,图5为EHDV扩增产物电泳结果。
2.6 对样品的检测与评估
应用多重RT-PCR对深圳出入境检验检疫局动检实验室保存的 97份 BTV、EHDV、VSV、AKV 4种病毒细胞和组织样品进行检测,结果BTV样品16份、EHDV 样品 13份、VSV 样品 4份 、AKV 样品5份检出阳性,与相关国家标准或行业标准方法(GB/T18089-2008)、GB/T22916-2008、SN/T1128-2007)等检测结果一致。
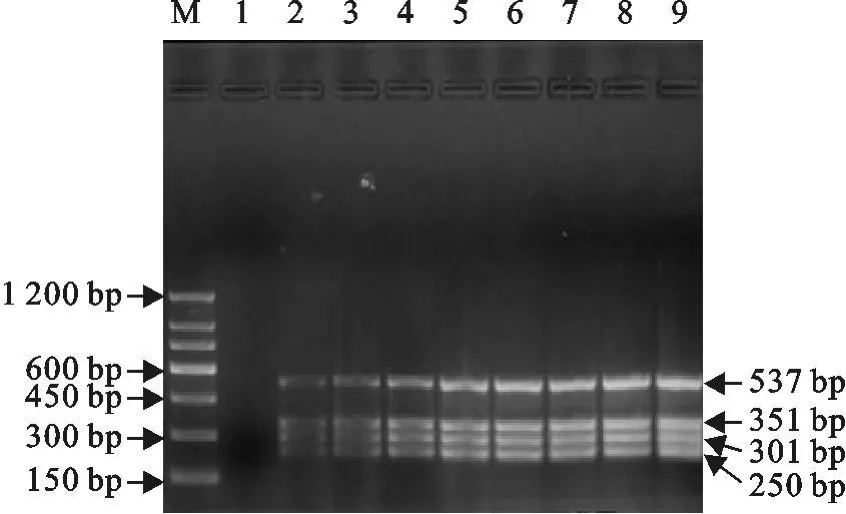
图3 VSV、BTV、EHDV和 AKV多重RT-PCR敏感性Fig.3 Sensitivity ofmultiplex RT-PCR for the detection of four genusarboviruses
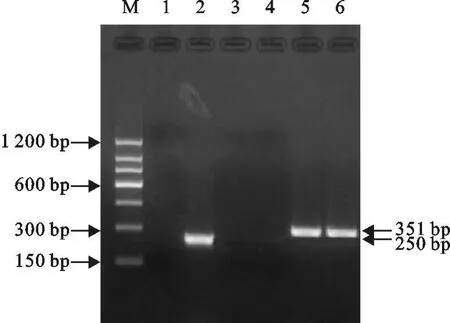
图4 VSV和 AKV RT-PCR扩增产物电泳 Fig.4 Agarose gel electrophoresis of RT-PCR am plification products for VSV and AKV
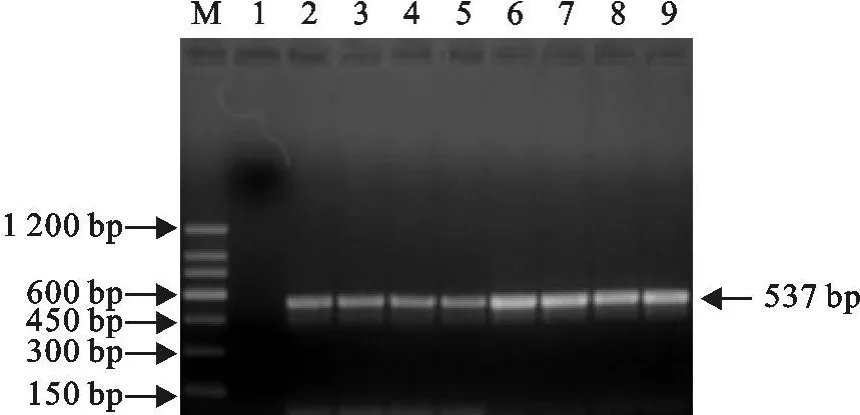
图5 EHDV 1-8型RT-PCR扩增产物电泳Fig.5 Agarose gel electrophoresis of RT-PCR amplification products for EHDV 1-8
3 讨论
蓝舌病、水疱性口炎、鹿流行性出血热病和赤羽病是4种重要的动物虫媒病,是出入境动物检验检疫中重要的检疫对象,近年来在一些国家和地区流行和传播,造成重大经济损失[7]。由于这4种病毒的自然宿主和传播媒介相同或者类似,临床症状也大致相同,因此,建立同时可检测这4种病毒的快速检测方法可显著提高检测效率,对于出入境口岸动物检疫具有重要的应用价值。
多重RT-PCR是在同一反应体系中加入多对引物对不同病毒核酸的目的片段进行特异性扩增,影响其扩增效果的因素比只有一对引物的扩增体系要多,反应体系中各物质的浓度及扩增条件直接影响试验效果[8-9]。因此,本试验中对反应体系和条件分别进行了优化,以确保在最少的成本和时间下,4种病毒目的基因扩增的效率均最高。在多重RT-PCR体系的优化过程中,在初步的反应体系、反应条件和循环参数检测出扩增条带后,先后对引物浓度、dNTPs浓度和Mg2+浓度进行了反复摸索,获得的反应体系可对BTV、EHDV、VSV和AKV不同血清型和毒株能特异性扩增,具有广泛的适用性,而对FMDV、BVDV、PPRV 、SVDV 的 RNA 和 BHK 21细胞总RNA的扩增结果均为阴性,没有出现任何条带。由于4种病毒各自引物的最佳反应温度有差异,使得在最初采用单一退火温度进行多重RTPCR时,得到的扩增结果从亮度及扩增结果的稳定性方面都不是很理想。因此,在对扩增条件的优化中,主要针对退火温度进行。在4种病毒单一 RTPCR条件的基础上,采用梯度PCR仪,退火温度确定为56℃,扩增条件以94℃5min;94℃45 s,56℃45 s,72℃1min,30个循环;然后72℃延伸5min,经电泳检测,4种病毒目的基因扩增均获得了均一、稳定的预期特异性扩增产物。
考虑到理论上多重RT-PCR的敏感性和特异性较单一RT-PCR法会有所下降[10-11]。为了尽量克服这一缺点,在引物设计时首先对4种病毒相关的病毒属成员的基因组序列进行同源性比较,选择BTV、EHDV、VSV和AKV高度保守且特异性强的区段来设计多套多重RT-PCR引物,并进一步经过Blast同源性分析,以保证引物扩增的特异性。将合成的多对引物进行最佳配对筛选试验,并经过大量的反应条件优选和验证试验,获得了分别位于BTV VP7基因、EHDV VP7基因、VSV N 基因及AKV N基因的4对引物,其对4种病毒检测的扩增效率高和特异性好,且每对引物扩增的片段长度之间相差超过50 bp,使多重RT-PCR扩增产物的电泳检测时更简便直观,对4种病毒的鉴别检测或混合感染疑似病例的诊断更加方便快速。
利用4种病毒各自的引物分别检测四种病毒的混合液样品,结果单一引物对4种病毒混合模板的检测时,只能检测出引物相应的病毒目的基因,而对其他3种病毒的目的基因未能扩增。在单对引物扩增条件的基础上,采用经过优化的多重RT-PCR反应条件,将4对特异性引物加入同一反应管内,以分别在每管加入VSV、BTV、EHDV和AKV的RNA模板,均只扩增出相应病毒目的基因的单一条带,而在其中一管加入了4种病毒RNA,经多重RT-PCR可同时扩增出了相应的大小不同的4条目的条带,且与预期大小一致,说明在同一体系内同时检测4种病毒是可行的。但对 FMDV、BVDV、PPRV、SVDV的RNA和BHK-21细胞总 RNA的扩增结果均为阴性,没有出现任何条带,4对引物之间没有交叉反应,该多重RT-PCR方法的特异性好。这表明所建立的多重RT-PCR法无论针对混合病毒模板还是单一病毒模板均可有效检测特定病毒核酸。将4种病毒混合液提取RNA后作10倍系列稀释后,进行检测,BTV、EHDV、VSV和AKV引物的灵敏度均可达到了10-7,显示了较高的灵敏度。在多重RT-PCR对4种病毒的各血清型或病毒株的检测试验表明,4种特异性引物对相应病毒各型的检测具有特异性和通用性。因此,该研究建立的多重 RTPCR方法在4种疫病的鉴别诊断和动物检疫方面具有广阔的应用前景。
[1]M ertens P P,M aan N S,Prasad G,et al.Design of p rim ers and use of RT-PCR assay s for typing Eu ropean bluetongue virus isolates:differentiation of field and vaccine strains[J].J Gen V irol,2007,88(10):2811-2823.
[2]A radaib I E,Sm ith W L,Osburn B I,et al.A mu ltiplex PCR for sim ultaneous detection and differentiation of North American seroty pes of bluetongue and epizootic hemorrhagic disease viruses[J].Comp Immunol M icrobiol Infect Dis,2003,26(2):77-87.
[3]Akashi H,Onuma S,Nagano H,et al.Detection and differentiation of A ino and Akabane Sim bu serogroup bunyaviruses by nested polymerase chain reaction[J].A rch Virol,1999,144(11):2101-2109.
[4]Rodriguez L L,Lecthw orth G J,Nichol S T.Rapid detection of vesicular stomatitis virus New Jersey serotype in clinical sam ples by using polymerase chain reaction[J].JClin m icrobial,1993,31:2016-2020.
[5]钟金栋,花群义,肖荣海,等.多重PCR同时检测口蹄疫病毒、猪水疱病病毒和水疱性口炎病毒[J].动物医学进展,2006,27(7):55-58.
[6]Johnson D J,W ilson W C,Paul P S,et al.Validation of a reverse transcriptasemultiplex PCR test for the serotypedetermination of U.S.isolates of b luetongue virus[J].Vet M icrobiol,2000,76(2):105-115.
[7]An t hony S,Jones H,Darpel K E,et al.A duplex RT-PCR assay for detection of genome segment 7(VP7 gene)from 24 BTV serotypes[J].JV irol Meth,2007,141(2):188-219.
[8]A radaib IE,Mohamed E H,Abdalla TM,et al.Serogrouping of United States and some A frican serotypes of bluetongue virususing RT-PCR[J].Vet M icrobiol,2005,111(324):1452-1500.
[9]黄良宗,冼琼珍,顾万军,等.多重PCR检测猪伪狂犬病病毒、猪繁殖与呼吸综合征病毒和猪流感病毒[J].动物医学进展,2006,27(7):62-65.
[10]余丽芸,刘建柱,侯喜林,等.多重PCR检测猪瘟病毒、猪细小病毒和猪伪狂犬病病毒的研究——猪瘟病毒、猪细小病毒和猪伪狂犬病病毒多重PCR引物设计[J].动物医学进展,2004,25(6):75-77.
[11]郭 巍,戴伶俐,李雪峰,等.马流感病毒多重 RT-PCR检测方法的建立[J].动物医学进展,2008,29(11):28-31.
