HIF-1α和VEGF在胃癌中的表达及临床意义
2010-09-20李国元赵久达王成赵海燕赵君慧耿排力窦拉加
李国元 赵久达 王成 赵海燕 赵君慧 耿排力 窦拉加
青海大学附属医院肿瘤内科,青海 西宁 810001
胃癌是常见的恶性肿瘤,据统计占我国消化道恶性肿瘤的第一位,其浸润和转移是影响预后的主要因素[1]。大多数研究表明胃癌的浸润转移是多基因及其蛋白表达产物协调作用的结果[2]。本研究通过检测胃癌组织缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)和血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白表达情况,并研究其与临床病理特征的关系,分析两种蛋白在胃癌浸润和转移过程中的作用,为判断预后及指导临床治疗提供依据。
1 资料和方法
1.1 一般资料 收集青海大学附属医院肿瘤外科2007年7月—2009年5月手术全切除或次全切除的胃癌标本及其配对的距癌灶5 cm以上的癌旁组织标本各85例,标本均经组织病理确诊;患者术前均未接受过放化疗。其中男性49例,女性36例,年龄35~76岁,中位年龄56岁。胃癌患者临床分期按2003年国际抗癌联盟(UICC)颁布的胃癌TNM分期标准:Ⅰ期10例,Ⅱ期12例,Ⅲ期47例,Ⅳ期16例。胃癌分化程度:高分化腺癌11例,中分化腺癌18例,低分化腺癌39例,未分化癌 17例。胃癌浸润深度:浸润达浆膜层者62例,浸润未达浆膜层者23例。胃周淋巴结转移情况:发生淋巴结转移者68例,未发生淋巴结转移者17例。
1.2 主要试剂 鼠抗人HIF-1α、VEGF单克隆抗体及其他相关试剂购于福州迈新公司。
1.3 检测方法 采用免疫组织化学SP法。石蜡包埋的组织4 μm连续切片;二甲苯脱蜡,乙醇梯度水化;3%过氧化物消除内源性过氧化物酶;EDTA修复;正常羊血清室温下封闭;加入即用型一抗(鼠抗人HIF-1α单抗,鼠抗人VEGF单抗)4 ℃冰箱过夜;PBS清洗,加入二抗,温育0.5 h,冲洗后DAB显色,苏木精对比染色,中性树胶封片。
1.4 结果判断 由病理科专科医生独立阅片,对照HE染色确定肿瘤细胞区域,于显微镜下观察,每例观察2张切片,每张切片任意观察5个视野,每个视野计数100个细胞。HIF-1α的结果判断按照肿瘤细胞的染色比例分级。以伴或不伴胞质染色的细胞核染色为阳性计数标准[3],(-):没有染色或<1%的细胞核染色;(+):1%~10%的细胞核染色,和(或)较弱的胞质染色;(++):10%~<50%的细胞核染色,和(或)明显的胞质染色;(+++):≥50%的细胞核染色,和(或)较强的胞质染色。(-)为阴性;(+)~(+++)为阳性。VEGF的结果判断[4]按照肿瘤细胞的染色比例分级,胞质染色情况为阳性计数标准,我们认为<10%的胞质染色为阴性表达;≥10%为阳性表达。
1.5 统计处理 采用SPSS 11.0统计软件进行χ2检验和相关性分析。
2 结 果
2.1 癌组织与癌旁组织中HIF-1α和VEGF的表达及比较 在所测85例胃癌组织中,HIF-1α阳性表达主要在细胞核,部分胞质中也可见阳性表达,胃癌坏死区和胃癌浸润边缘的细胞核表达最明显(图1)。VEGF主要表达在胃癌细胞的胞质中(图2)。检测出HIF-1α和VEGF的表达阳性率分别为76.47%(65/85)和60.00%(51/85);所测85例癌旁组织中HIF-1α和VEGF全部为阴性表达(0/85),两者比较,差异有统计学意义(P<0.05)。
2.2 胃癌组织中HIF-1α和VEGF蛋白表达与临床病理特征的关系 85例胃癌中HIF-1α和VEGF蛋白的阳性表达在不同组织学分型中差异无统计学意义(P>0.05),但不同临床分期、浸润程度和有无淋巴结转移的胃癌标本中差异有统计学意义(表1)(P<0.05)。

图1 免疫组化SP法检测HIF-1α在胃癌中的表达Fig.1 The expression of HIF-1 in gastric cancer by immunohistochemical SP method(×400)

图2 免疫组化SP法检测VEGF在胃癌中的表达Fig.2 The expression of VEGF in gastric cancer by immunohistochemical SP method(×400)
2.3 胃癌组织中HIF-1与VEGF蛋白表达之间的关系 由表2可见,85例胃癌中,HIF-1α与VEGF同为阳性者45例,同为阴性者14例,两者之间呈显著相关(r=0.367,P<0.05)。
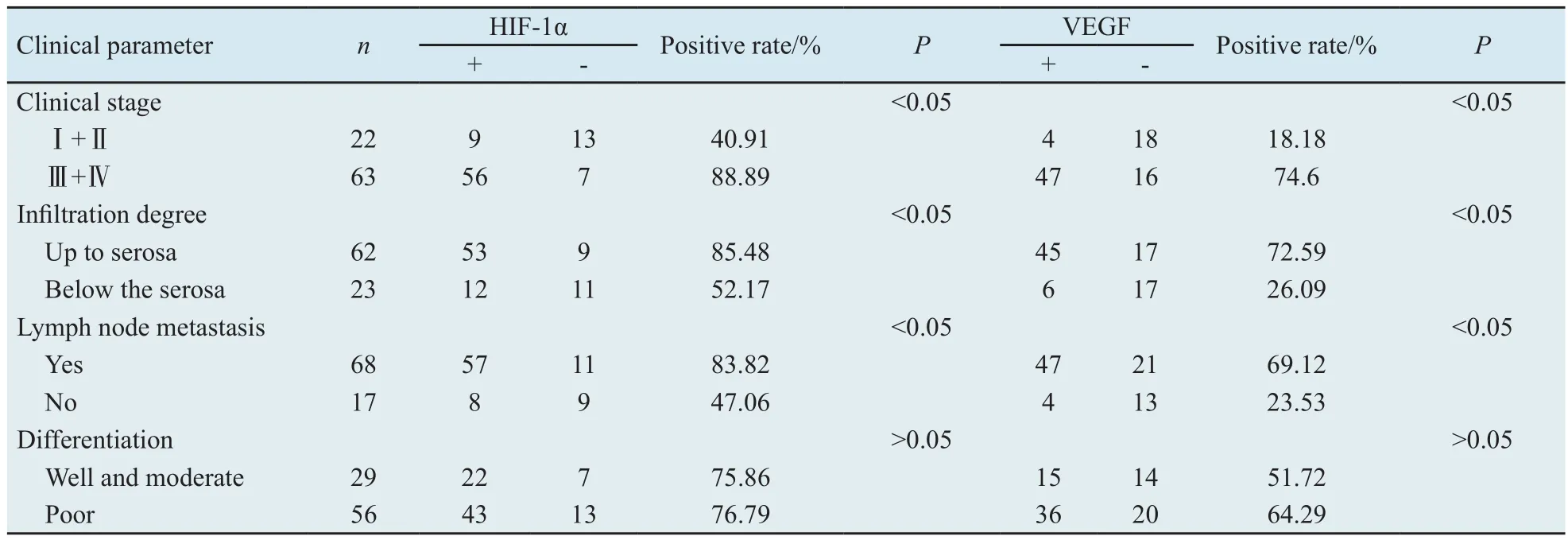
表1 HIF-1α和VEGF蛋白表达与胃癌临床病理特征的关系Tab.1 Relationship between expressions of HIF-1α, VEGF and clinical parameters of gastric carcinoma

表2 HIF-1α与VEGF蛋白在胃癌组织中表达的相关性分析Tab.2 The correlation between HIF-1α and VEGF in gastric carcinoma
3 讨 论
低氧是恶性肿瘤快速生长和转移的普遍现象,目前被证实的低氧诱导基因的数量愈来愈多。HIF-1是缺氧条件下广泛存在于哺乳动物和人体内产生的一种异源二聚体转录因子,在缺氧诱导的基因表达中起着关键作用。HIF-1主要由HIF-1α和HIF-1β两个亚单位组成,其中HIF-1α是唯一的氧调节亚单位,它决定HIF-1的活性[5],其靶基因涉及肿瘤细胞能量代谢、血管生成和肿瘤转移等,VEGF即是其中的靶基因之一。许多恶性肿瘤的局部生长和转移依赖于血管新生,这需要血管生成因子如VEGF、FGF、PDGF和IL-8的产生和分泌。VEGF能以自分泌及旁分泌形式刺激肿瘤细胞的有丝分裂,是诱导肿瘤血管形成作用最强、特异性最高的血管生长因子,也是一组促进血管内皮细胞分化的多功能细胞因子,HIF-1α与VEGF在肿瘤研究中的作用和地位日益受到重视。
Ryan等[6]通过免疫组化研究发现,在良性肿瘤组织中,HIF-1α表达处于正常水平;在许多原发性恶性肿瘤中HIF-1α表达升高,而在转移性肿瘤中 HIF-1α表达升高更加显著。Zhong等[3]分析了179例不同类型肿瘤标本中HIF-1α的表达,发现在包括前列腺癌、乳腺癌和胃癌等13种肿瘤中可见HIF-1α呈不同程度的表达,而在相应的良性肿瘤中没有检测到HIF-1α,其中2例胃癌均有表达HIF-1α。本实验结果表明,在用免疫组化方法检测85例胃癌组织中HIF-1α的表达水平时,65例为阳性表达,20例为阴性表达,表达阳性率为76.47%,与癌旁组织全部阴性表达相比,差异有显著统计学意义(P<0.05)。这说明HIF-1α的在胃癌中的过度表达对胃癌的发生、发展可能有一定的意义。
关于HIF-1α在肿瘤中的表达与肿瘤临床病理因素的关系,各家的研究结果不尽相同,主要集中在HIF-1α的表达与肿瘤分化程度的关系上。本实验结果显示HIF-1α在胃癌TNM Ⅰ/Ⅱ 和Ⅲ/Ⅳ期的阳性表达率分别为40.91%和88.89%,组间比较差异有统计学意义(P<0.05);随着胃癌浸润深度的加深,HIF-1α表达阳性率也明显增加(52.17%vs 85.48%),组间比较差异有统计学意义(P<0.05);淋巴结转移组的HIF-1α表达阳性率为83.82%,显著高于淋巴结未转移组的47.06%(P<0.05),但HIF-1α的表达与胃癌的分化程度无明显关系(P>0.05)。Kurokawa等[7]利用单克隆抗体采用免疫组化方法检测130例食管鳞癌手术切除标本发现,其中40例HIF-1α高表达,且与肿瘤TNM分级、肿瘤浸润深度、淋巴结转移以及远处转移正相关,但与肿瘤分化程度无关,这与本实验结果一致。这表明HIF-1α过度表达可反映胃癌的生物学行为,可能成为判断胃癌浸润和转移的有价值指标。
VEGF免疫组化检测结果显示:VEGF的表达在胃癌分化程度间差异无统计学意义(P>0.05),VEGF在胃癌组织中的总阳性率为60.00%(51/85),表明 VEGF的过度表达与胃癌的发生、发展有关;胃癌浸润深度不同,VEGF的表达明显不同,浸润深度为未达浆膜者的阳性率(26.09%)明显低于达浆膜者(72.58%);有淋巴结转移者,其VEGF表达阳性率为69.12%明显高于无淋巴结转移者的23.53%;随着临床TNM分期增加,VEGF在胃癌中的阳性表达率亦明显增加,Ⅲ/Ⅳ期的阳性率为74.16%,而Ⅰ/Ⅱ期的阳性率仅为18.18%;在Ⅰ/Ⅱ期与Ⅲ/Ⅳ期之间比较,差异有统计学意义(P<0.05)。Onogawa等[8]研究发现,VEGF表达与胃癌浆膜浸润、淋巴转移和TNM分期有关,这与本实验结果一致。但王天宝等[9]的研究提示VEGF-C的表达与胃癌分化、分期及转移密切相关。本实验结果提示:随着胃癌逐渐发展,VEGF表达逐渐增强,且与胃癌TNM分级、胃癌浸润深度、淋巴结转移相关,说明检测胃癌VEGF的表达水平可以作为判断胃癌生物学行为的参考指标。
Cabuk等[10]的研究报道显示,HIF-1α和VEGF在胃癌中的表达阳性率分别为71%和65%,HIF-1α和VEGF表达阳性率有明显相关性,患者5年总生存率为45%,但HIF-1α、VEGF表达及其他病理特征对患者生存率没有影响。本研究资料显示,85例胃癌组织中HIF-1α蛋白和VEGF蛋白表达共同阳性者为45例,HIF-1α阳性而VEGF阴性者为20例,VEGF阳性而HIF-1α阴性者为6例,共同阴性者为14例,经相关性分析发现,两者具有正相关性。这提示HIF-1α与VEGF存在着调控关系,HIF-1α/VEGF通路在调节胃癌新生血管生成过程中具有十分重要的作用,两者在胃癌的侵袭、转移过程中可能具有协同作用。另有研究证实,HIF-1α不仅可促进VEGF的转录,而且可增加VEGF mRNA的稳定性,促进肿瘤新生血管生成,而VEGF mRNA稳定性增加对VEGF蛋白表达的上调也有促进作用[11]。Kim等[12]的研究发现,胃癌组织中HIF-1α mRNA的表达与肿瘤淋巴结转移、远处转移、临床分期及3年内的复发有明显相关,而VEGF mRNA只与淋巴结转移及远处转移有显著相关性,HIF-1α和VEGF mRNA表达水平之间有明显的相关性。
综上所述,HIF-1α和VEGF在胃癌组织中高表达,并与胃癌的临床TNM分期、浸润深度和淋巴结转移有关,HIF-1α的表达与VEGF的表达呈正相关。由此我们认为HIF-1α和VEGF共同参与了胃癌的发生、发展,HIF-1α可能通过上调VEGF的蛋白表达促进胃癌血管生成进而促进胃癌的转移,它们在胃癌血管生成和生长侵袭转移过程中具有相互叠加或协同作用。针对HIF-1α和VEGF靶点治疗胃癌可能是将来的一种方向,但有关HIF-1α和VEGF对肿瘤患者生存方面的影响应行进一步研究。
致谢:感谢罗翠松硕士对本课题所作的工作。
[1] 徐光炜.胃癌治疗的现状及问题[J].外科理论与实践,2003, 8(1): 3-6.
[2] Parkin DM, Bray F, Ferlay J, et al.Global cancer statistics,2002[J].CA Cancer J Clin, 2005, 55(2): 74-108.
[3] Zhong H, De Marzo AM, Laughner E, et al.Overexpression of hypoxia-inducible factor 1 alpha in common human cancers and their metastases[J].Cancer Res, 1999, 59(22): 5830-5835.
[4] Cascinu S, Staccioli MP, Gasparini G, et al.Expression of vascular endothelial growth factor can predict event-free survival in stage Ⅱ colon cancer [J].Clin Cancer Res,2000, 6(7): 2803-2807.
[5] Song IS, Wang AG, Yoon SY, et a1.Regulation of glucose metabolism-related genes and VEGF by HIF-1 alpha and HIF-1 beta, but not HIF-2 alpha, in gastric cancer[J].Exp Mol Med, 2009, 41(1): 51-58.
[6] Ryan HE, Poloni M, McNulty W, et al.Hypoxia -inducible factor-1 alpha is a positive factor in solid tumor growth [J].Cancer Res, 2000, 60(15): 4010.
[7] Kurokawa T, Miyamoto M, Kato K, et al.Overexpression of hypoxia- inducible-factor 1 alpha (HIF-1alpha) in oesophageal squamous cell carcinoma correlates with lymph node metastasis and pathologic stage [J].Br J Cancer,2003, 89(6): 1042-1047.
[8] Onogawa S, Kitadai Y, Amioka T, et al.Expression of vascular endothelial growth factor (VEGF)-C and VEGF-D in early gastric carcinoma: correlation with clinicopathological parameters[J].Cancer Lett, 2005, 226(1): 85-90.
[9] 王天宝, 董文广, 李兆亭.血管内皮生长因子-C在胃癌中表达的意义[J].中国普通外科杂志, 2004, 13(9): 701-704.
[10] Cabuk D, Basaran G, Celikel C, et al.Vascular endothelial growth factor, hypoxia-inducible factor 1 alpha and CD34 expressions in early-stage gastric tumors: relationship with pathological factors and prognostic impact on survival[J].Oncology, 2007, 72(1-2): 111-117.
[11] Zhong H, Chiles K, Feldser D, et al.Modulation of hypoxiainducible factor 1 alpha expression by the epidermal growth factor/phosphatidylinositol 3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells: implications for tumor angiogenesis and therapeutics[J].Cancer Res, 2000, 60(6):1541-1545.
[12] Kim SE, Shim KN, Jung SA, et al.The clinicopathological significance of tissue levels of hypoxia-inducible factor-1 alpha and vascular endothelial growth factor in gastric cancer[J].Gut Liver, 2009, 3(2): 88-94.
