结直肠息肉内镜下特点及治疗
2010-09-20张文明沈俊张召珍贺益萍
张文明 沈俊 张召珍 贺益萍
复旦大学附属肿瘤医院内镜科,复旦大学上海医学院肿瘤学系,上海 200032
结直肠癌是常见的恶性肿瘤,发病率呈上升趋势[1-4]。大多数结直肠癌起源于非恶性病变,如由腺瘤性息肉发展而来的腺癌[1]。本研究回顾性总结2009年我科结肠镜下结直肠息肉的检出情况,分析其内镜特点和内镜下治疗情况。
1 资料和方法
1.1 研究对象 2009年1月—2010年1月间,复旦大学附属肿瘤医院内镜科行结肠镜检查的患者5 152例,均为结直肠癌术后患者和其他门诊患者,年龄12~86岁。其男女比为1.57∶1。其中结直肠癌术后占72.39%。按年龄段分为:中青年组(<60岁)和老年组(≥60岁)。其中中青年组3 601例(69.90%),老年组1 551例(30.10%)。
1.2 研究方法 检查前做好充分的饮食和肠道清洁准备(检查前1~2 d少渣半流和流质,检查前1 d晚7点开始用聚乙二醇电解质散剂13.7 g×18袋,泡水服用,反复冲服直至排泄物呈清水样便,肠道准备要充分)。采用OLYMPUS CF260/260AL型电子结肠镜,进镜至回盲部,然后缓慢退镜,同时进行全结肠观察。对息肉应明确部位和数量,测量大小和对基底和表面特征描述。息肉常规进行活检和病理检查。待病理结果出来后,根据息肉的大小和形态特征等,选取不同方法进行治疗。对小息肉(直径<0.5 cm)可在结肠镜直视下用微波或活检钳灼除;对>0.6 cm的有蒂息肉采用高频电予圈套切除;对较大的广基息肉可用APC(氩离子凝固术)灼除;≥2.0 cm的广基息肉可分次APC或EMR/ESD(内镜下黏膜切除术/内镜下黏膜剥离术)切除;>2.5 cm及基底宽粗的或病理情况不宜内镜下治疗的,予住院手术切除。
1.3 统计处理 应用STATA 8.0软件进行数据和统计处理,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1年龄分组的息肉检出与癌变情况全组资料共检测出结直肠息肉1 297例,占25.17%,其中男性804例,女性493例,男女比为1.63∶1。结直肠息肉患者的年龄为12~86岁,平均年龄:(54.3 ± 4.2)岁。中青年组为713例,占19.80%(713/3 601);老年组584例,37.65%(584/1 551)。其中息肉癌变145例(11.18%),中青年组53例(7.43%),老年组92例(15.75%)。两组息肉检出率和癌变率比较,差异均有统计学意义(P=0.000)。
2.2 两组息肉病理类型比较结果 全组共检出息肉1 730枚,腺瘤827枚,癌变145枚,占17.53%。中青年组腺瘤占36.99%(354/957),老年组占61.19%(473/773)(表1)。管状腺瘤(27.9%,39.3%)明显多于绒毛状腺瘤(9.09%,21.86%),两组腺瘤及其分类情况间比较,差异均有统计学意义(P=0.000,P=0.001);两组绒毛状腺瘤恶变率明显高于管状腺瘤(26.44%,30.18%;11.24%,13.49%),差异有统计学意义(P=0.001)。

表1 两组息肉病理情况比较Tab.1 Comparison the pathological characteristics of polyps in the two groups[n(%)]
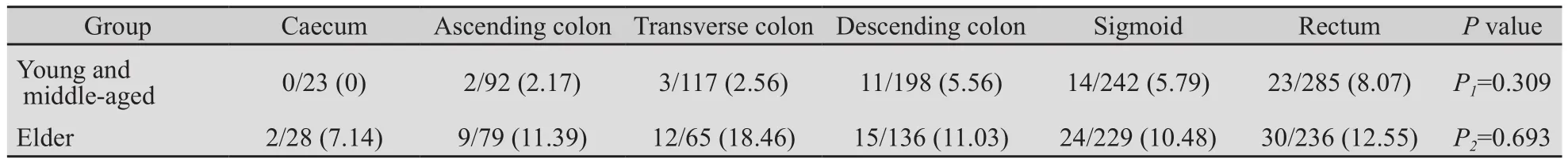
表2 两组息肉在各肠段的癌变情况Tab.2 The cancerization of two groups polyps in the location of the colon[n(%)]
2.3 息肉的肠道解剖位置分布情况与癌变关系比较 两组的息肉分布均以左半结肠为多(直肠、乙状结肠和降结肠:29.78%、25.29%和20.69%;30.53、29.62%和17.59%),明显高于横结肠和升结肠、回盲部(12.23%、9.61%和2.4%;8.41%、10.22%和3.62%),两者相比差异有统计学意义(P=0.02)。各肠道息肉恶变中,中青年组中以直肠比例稍多(8.07%),老年组中以横结肠和直肠息肉癌变占多(18.46%,12.55%),但组间比较(P1)和解剖部位间(P2)比较差异均无统计学意义(P>0.05,表2)。
2.4 分组比较息肉大小、形态、数目等以及与癌变的关系 从息肉数目来看,中青年组以单发为主(70.95%),而老年组则多发的比例更高(50.32%),组间比较差异有统计学意义(P=0.000);两组息肉均以<1 cm的占多(56.22%,44.50%),但老年组中2 cm以上明显增多(14.42%,24.97%),两者相比差异有显著的统计学意义(P=0.000)。息肉表面形态多以光滑为多(87.98%,64.04%),老年组的分叶比例比中青年组高(35.96%,12.02%),两者相比差异有显著的统计学意义(P=0.000)。而两组息肉基底情况比较,有蒂和广基所占比例相近(16.82%,83.18%;17.72%,82.28%),广基明显多于有蒂息肉,但组间比较差异无统计学意义(P=0.662)。比较分类组别息肉的恶变(表3):多发息肉易恶变(19.06%,22.88%),单发的较少恶变,但两组间差异无统计学意义(P=0.184);而广基息肉更易癌变(6.66%,14.31%),但组间比较差异也无统计学意义(P=0.446)。息肉大小与癌变关系密切,特别是2 cm以上的息肉癌变比例更高(36.23%,29.53%),息肉大小间比较差异有统计学意义(P=0.035);尽管息肉表面光滑的占比例高,但分叶状的更易恶变(37.39%,20.5%),两两比较差异有统计学意义(P=0.016)。
2.5 内镜下治疗情况 老年组584例773枚息肉中,472例(80.8%)予氩气刀和高频电切,其中APC灼除494枚,高频电圈套电切69枚;92例和19例因息肉癌变和蒂粗巨大息肉外科手术治疗,1例行EMR切除。中青年组713例957枚息肉中,除53例息肉恶变和9例巨大息肉手术治疗外,894枚息肉中APC灼除838枚,圈套电切56枚。内镜治疗后,青年组有1例并发出血,为术后12 h出现鲜血便伴腹痛等症状(系患者息肉基底较粗,术后未按医嘱注意休息和饮食)。经急诊肠镜检查,发现息肉创面渗血,经局部APC烧灼和基底部钛夹止血后停止渗血。术后随访未再发生出血或其他并发症。
3 讨 论
结直肠癌是常见肿瘤,我国发病率呈上升趋势[1-4]。大多数结直肠癌起源于腺瘤,该进程需8~10年。腺瘤的发现并切除,能中断腺瘤到癌变的过程,从而预防结直肠癌的发生,降低结其发病率,因而腺瘤经早期诊治,可以预防结直肠癌的发生。
结直肠息肉是肠道常见病、多发病,临床多无症状。我们共检测出结直肠息肉1 297例,占25.17%。有文献报道肠镜息肉检出率为20%~40%不等,国内为14.8%~17.8%,而日本高达40%[5]。随年龄增加,息肉发病率有增加趋势。本组资料与之基本相符。
息肉按病理分为新生物性息肉(腺瘤)和非新生物性息肉(增生性息肉、炎性息肉等)[6]。而腺瘤性息肉有明确的恶变可能。欧美报道腺瘤性息肉占37.5%[7],亚洲报道结直肠腺瘤11.7%[8]。大多数息肉为管状腺瘤(占65%)和绒毛状腺瘤(10%)。而本组资料显示腺瘤性息肉比例达36.99%,与欧美报道类似,老年组高达61%,这可能与我院来诊患者特点有关。文献显示管状腺瘤癌变率较低,绒毛状腺瘤高[10]。国外管状、绒毛状腺瘤癌变率4.4%,9.7%,国内为7.1%,27.5%。本组资料示老年组管状、绒毛状腺瘤的癌变率分别为13.49%和30.18%;中青年组则为11.24%和26.44%,均示绒毛状腺瘤恶变率更高。两者比较,差异有统计学意义。结果高于国外的研究,与国内的比例相近。

表3 两组息肉分类的癌变情况比较Tab.3 Comparison on the size and sharp of polyps between two groups[n(%)]
结直肠癌和息肉与肠道的解剖部位有一定关联,欧美研究显示从左到右侧渐增的趋势[11-13],亚洲的研究报道则显示结肠息肉多发于左半结肠,本资料也显示该特点[5,14-16]。而中青年组中以直肠癌比例稍多,老年组中以横结肠和直肠息肉癌变占多。因而要重视老年患者的全结肠检查,以便癌变息肉的及时发现和治疗。
文献报道息肉大小也是结直肠腺瘤恶变预测因子之一[9-10]。腺瘤大小(<1 cm、1~2 cm和>2 cm)的癌变率,国外报道为1.7%~2.6%、6.5%~24.3%和12%~25%;国内为1.8%,11.7%和26.7%。本组资料显示,两组息肉均以<1 cm的占多数,但老年组中>2 cm者明显增多。而<1 cm、1~2 cm和>2 cm者癌变率两组分别为0%、2.14%和34.06%;1.74%、8.47%和34.20%。趋势与国内外研究一致,表明随着息肉的增大,癌变风险成倍增加,中青年人同样如此,也更提示结肠镜对结直肠息肉诊治的重要性。
腺瘤的基底、表面形态和数目等也是息肉癌变的相关因素。息肉体积大、基底粗宽、分叶和多发等易发生癌变。文献显示国外有蒂腺瘤恶变率为2.7%,无蒂为6.7%;国内资料为1.7%、14.2%[10]。本组资料示,老年组广基息肉癌变率达14.31%,中青年人群中也同样有此规律。
文献总结,腺瘤性息肉高危因素包括多发息肉(≥3枚)、息肉大小>1 cm(尤其是>2 cm)、绒毛状腺瘤、高级别瘤变和息肉位置是进展型腺瘤或结直肠癌的预测因素[10]。
结肠镜下息肉摘除术是结直肠息肉的首选治疗,安全且并发症少[17-18]。息肉切除后要定期随访。文献推荐:≥3枚的腺瘤、高级别瘤变、绒毛状腺瘤或息肉>1 cm的患者,息肉摘除术后推荐3年内随访肠镜;1~2枚小管状腺瘤(<1 cm)、非高级别瘤变的,5~10年随访1次肠镜;而有增生性息肉的患者仅如常人10年随访1次,随访中发现息肉要及时摘除[19]。息肉摘除后12~24个月内,应每3个月肠镜随访1次,定期全结肠检查降低结直肠癌发病率有临床意义。
[1] Viner JL, Umar A, Hawk ET.Chemoprevention of colorectal cancer: problems, progress, and prospects [J].Gastroenterol Clin North Am, 2002, 31(4): 971-999.
[2] Citarda F, Tomaselli G, Capocaccia R, et al.Efficacy in standard clinical practice of colonoscopic polypetomy in reducing colorectal cancer incidence [J].Gut, 2001, 48(6):812-815.
[3] Jemal A, Siegel R, Ward E, et al.Cancer Statistics, 2007[J].CA Cancer J Clin,2007, 57(1):43-66.
[4] Vijan S, Inadomi J, Hayward RA, et al.Projections of demand and capacity for colonoscopy related to increasing rates of colorectal cancer screening in the United States [J].Aliment Pharmacol Ther, 2004, 20(5): 507-515.
[5] 凌奇荷.结直肠息肉诊断与治疗新进展[J].中国医师杂志, 2000, 2(3): 133-136.
[6] Huang CS, O’Brien MJ, Yang S, et al.Hyperplastic polyps,serrated adenomas, and the serrated polyp neoplasia pathway[J].Am J Gastroenterol, 2004, 99(11): 2242-2255.
[7] Lieberman DA, Weiss DG, Bond JH, et al.Use of colonoscopy to screen asymptomatic adults for colorectal cancer.Veterans Affairs Cooperative Study Group 380 [J].N Engl J Med,2000, 343(3): 162-168.
[8] Bafandeh Y, Khoshbaten M, Eftekhar Sadat AT, et al.Clinical predictors of colorectal polyps and carcinoma in a low prevalence region: results of a colonoscopy based study [J].World J Gastroenterol, 2008, 14(10): 1534-1538.
[9] Khatibzadeh N, Ziaee SA, Rahbar N, et al.The indirect role of site distribution in high-grade dysplasia in adenomatous colorectal polyps [J].J Cancer Res Ther, 2005, 1(4): 204-207.
[10] 万德森.结直肠癌[M].北京: 北京大学医学出版社,2008: 81-91.
[11] Mostafa G, Matthews BD, Norton HJ, et al.Influence of demographics on colorectal cancer [J].Am Surg, 2004,70(3): 259-264.
[12] Scheiden R, Sand J, Pandin M, et al.Colorectal highgrade adenomas: incidence, localization and adenomaadenocarcinoma ratio in a retrospective and comparative population-based study of 255 consective cases between 1988 and 1996 [J].Int J Colorectal Dis, 2000, 15(1): 29-34.
[13] Cucino C, Buchner Am, Sonnenberg A.Continued rightward shift of colorectal cancer [J].Dis Colon Rectum, 2002,45(8): 1035-1040.
[14] Bafandeh Y, Daghestani D, Esmaili H, et al.Distribution of cancer and adenomatous polyps in the colorectum: study in an Iranian population [J].Asian Pac J Cancer Prev, 2006,7(1): 65-68.
[15] Bafandeh Y, Khoshbaten M, Eftekhar Sadat AT, et al.Clinical predictors of colorectal polyps and carcinoma in a low prevalence region: results of a colonoscopy based study [J].World J Gastroenterol, 2008, 14(10): 1534-1538.
[16] Bond JH.Colon polyps and cancer [J].Endoscopy, 2005,37(3) 208-212.
[17] Consolo P, Luigiano C, Strangio G, et al.Efficacy, risk factors and complications of endoscopic polypectomy: ten year experience at a single center [J].World J Gastroenterol,2008, 14(15): 2364-2369.
[18] Repici A, Tricerri R.Endoscopic polypectomy: techniques,complications and follow-up [J].Tech Coloprotol, 2004,8(Suppl 2): s283-s290.
[19] Winawer SJ, Zauber AG, Fletcher RH, et al.Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society [J].CA Cancer J Clin, 2006, 56(3): 143-159.
