miR-21对骨肉瘤细胞增殖的影响
2010-09-20吴子晏刘小云杨述华
吴子晏 刘小云 杨述华
华中科技大学同济医学院附属协和医院骨科,湖北 武汉 430022
微小RNA(microRNA,miRNA)是一类内源性的非编码小分子RNA,广泛存在于植物和动物细胞内,最近研究发现miRNA在肿瘤细胞的发生、发展中发挥着重要作用,包括调控细胞增殖、分化和凋亡[1-2]。其中miR-21是唯一一个在9种人类肿瘤细胞中高表达的小RNA分子[3-7],其在肿瘤细胞的作用机制逐渐被阐明。但是miR-21在骨肉瘤细胞中的促癌作用鲜有报道,在本实验中我们采用反义寡核酸技术(antisense oligonucleotide,ASO)抑制miR-21在骨肉瘤细胞中的表达,分析miR-21对骨肉瘤细胞增殖的影响。
1 资料和方法
1.1 材料
1.1.1 临床资料 收集华中科技大学同济医学院附属协和医院骨科2009年手术切除的8例骨肉瘤组织和4例正常骨组织。所有患者术前均未行放化疗。
1.1.2 细胞株和主要试剂 MG-63细胞由本实验室保存;DMEM培养基购自GIBCO公司,miR-21 ASO(5’-UCAACAUCAGUCUGAUAAG CUA-3’)和对照ASO(5’-UAGCUUAUCAGA CUGAUGUUGA-3’)购自上海GenePharma公司,转染试剂LipofectamineTM2000和OPTI MEMI购自美国Invitrogen公司,鼠抗人Bcl-2单克隆抗体购自美国Cell Signaling公司,TaqMan miRNA Isolation Kit,TaqMan microRNA Assay 和the TaqMan Universal PCR Master Mix均购于加拿大Applied Biosystems公司,SYBR Green Real time PCR Master Mix购自 Toyobo公司。
1.2 方法
1.2.1 细胞培养和反义寡核苷酸转染 用含
10%FBS的DMEM培养基培养MG-63细胞。反义寡核苷酸转染依试剂说明操作。采用不含血清的OPTI MEMI培养基分别稀释miR-21 ASO和对照组ASO,然后取脂质体LipofectamineTM2000稀释到OPTI MEMI培养基中,轻轻混匀后在室温下温育5 min,再将稀释的LipofectamineTM2000分别与稀释的miR-21 ASO和对照组ASO混合,轻轻混匀后在室温下温育20 min,以形成复合物。将复合物加入到含细胞的培养板中混合,置于37 ℃、CO2体积分数为5%的培养箱内,5 h后更换含10%胎牛血清的培养基继续培养48 h,进行后续试验。
1.2.2 miR-21的检测 体外培养的MG-63细胞,分别转染miR-21 ASO 和对照ASO,以TaqMan miRNA分离试剂盒提取小RNA,采用TaqMan microRNA Assay和TaqMan Universal PCR Master Mix来检测成熟miR-21的表达,以U6作为内参基因。
1.2.3 克隆形成实验检测MG-63细胞的增殖MG-63细胞转染后,取对数生长期的单层培养细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,接种于平底6孔培养板中,500个细胞/孔,置37 ℃、CO2体积分数为5%,饱和湿度的环境下,静置培养2~3周。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加纯甲醇5 mL,固定15 min。然后去固定液,加适量Giemsa应用染色液染10~30 min,然后用流水缓慢洗去染色液,空气干燥。显微镜下计数大于50个细胞的克隆数,克隆形成率=克隆数/接种细胞数×100%。
1.2.4 MTT法观察MG-63细胞增殖抑制情况 收集转染后的MG-63细胞分别接种于96孔板中,在37 ℃、CO2体积分数为5%的条件下培养72 h后,每孔加50 μL MTT溶液(5 mg/mL),置入孵箱温育4 h,吸出上清液,每孔加150 μL DMSO,用平板床摇匀。用酶标仪在490 nm波长测定各孔的吸光度值(A)。抑制率=(1-A实验组/A对照组)×100%。
1.2.5 在体检测miR-21 ASO对MG-63细胞增殖的影响 18只4~5周龄大小的裸鼠购于上海斯莱克公司,饲养于华中科技大学同济医学院动物中心。在MG-63细胞转染miR-21 ASO或对照ASO后,收集对数生长期的MG-63细胞,制成200 μL(5×106个)单细胞悬液,注射于小鼠右侧腋下。肿瘤形成后每日用游标卡尺测量肿瘤的直径,根据参考文献[8]中的方法来计算肿瘤的体积(V=D×d2×π/6)(D,d分别代表肿瘤的最大直径和最小直径),并绘制肿瘤的生长曲线。6周后裸鼠处死取瘤称重。4%甲醛固定肿瘤组织,石蜡包埋,HE染色,光镜下观察肿瘤组织的病理学改变。
1.2.6 离体检测miR-21 ASO对MG-63细胞凋亡的影响 采用Annexin V法,分别收集miR-21 ASO或对照ASO转染的MG-63细胞,以PBS重悬细胞。按照试剂盒说明进行操作,流式细胞仪检测。
1.2.7 各组细胞Bcl-2蛋白表达水平的检测采用Western blot方法,在miR-21 ASO或对照ASO转染的MG-63细胞培养至80%铺底时,收集待检测细胞,提取总蛋白,10%SDS-PAGE电泳后转膜,将膜放在含5%脱脂奶粉的TBST缓冲液中37 ℃封闭2 h,加入用TBST1∶1 000稀释的鼠抗人Bcl-2单克隆抗体4 ℃温育过夜,TBST缓冲液洗膜3次,每次10 min,加入辣根过氧化物酶标记的兔抗鼠IgG(1∶1 000稀释),37 ℃温育2 h,TBST缓冲液洗膜3次,每次10 min,ECL化学发光法检测条带。以β-actin作为内参。
1.2.8 各组细胞Bcl-2 mRNA表达水平的检测 各组细胞通过加入TRIzol裂解液提取总RNA,反转录cDNA,利用SYBR Green Real Time PCR Master Mix通过realtime PCR来检测Bcl-2,其序列[9]:Bcl-2,5’-AACTGGGG GAGGATTGTGGC-3’和5’-GATCCAGGTGTGCAGGTGCC-3’。反应条件:94 ℃变性1 min,58 ℃扩增45 s,72 ℃延伸10 s,40个循环。β-actin作为一个内参照。PCR反应在ABI7300反应平台上进行。
1.3 统计处理 所有数据统计均在SPSS 13.0软件上进行,结果以±s 表示,两组间均数的比较采用Student’s t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-21在骨肉瘤和正常骨组织中的表达通过qRT-PCR方法发现miR-21在8例骨肉瘤和4例正常骨组织中都有表达,且在骨肉瘤中的表达明显高于正常骨组织,两者差异具有统计学意义(P=0.017,图1)。
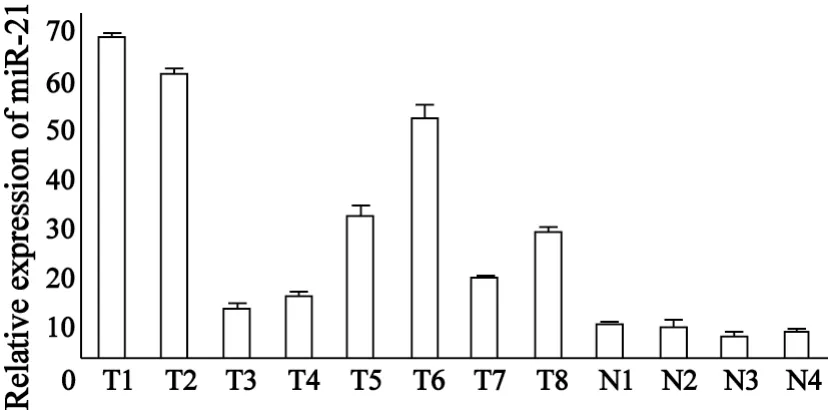
图1 8例骨肉瘤和4例正常骨组织中miR-21的相对表达Fig.1 Relative expression of miR-21 in 8 osteosarcoma tissues and 4 normal bone tissues
2.2 miR-21 ASO对MG-63细胞miR-21表达和对细胞存活率的影响 转染miR-21 ASO后,通过qRT-PCR方法检测发现miR-21的表达较对照显著降低(P=0.003)。MTT实验结果显示转染miR-21 ASO后,MG-63细胞存活数明显低于对照组,两者差异有统计学意义(P=0.023)。
2.3 miR-21 ASO对离体MG-63细胞增殖的影响 克隆形成实验结果显示:miR-21 ASO转染的MG-63细胞克隆形成率较对照明显降低(P=0.012)。
2.4 miR-21 ASO对在体MG-63细胞增殖的影响 在本实验中,所有的裸鼠肿瘤成瘤率为100%,但是miR-21 ASO转染的MG-63细胞所形成的肿瘤生长较对照明显要慢,且无论是在质量(P=0.013)还是体积(P=0.028,图2)上都和对照的差异有统计学意义。经病理组织切片染色证实所有肿瘤均为骨肉瘤组织(图3)。
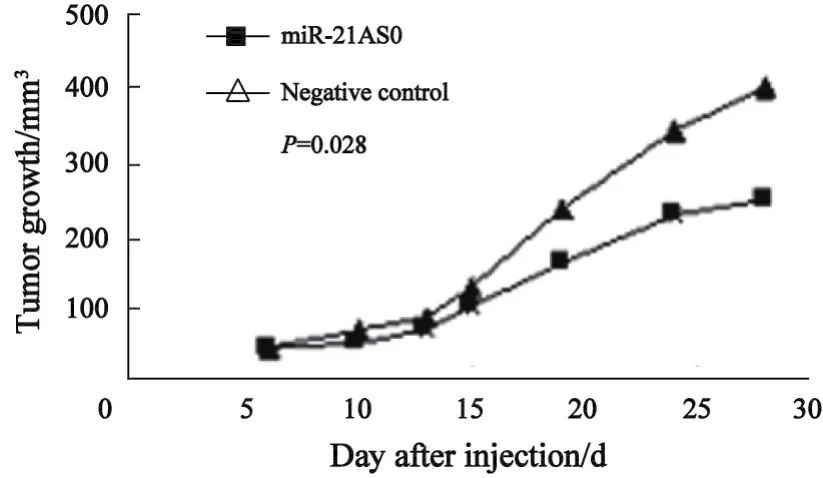
图2 在体miR-21 ASO转染的MG-63细胞所形成肿瘤的体积变化Fig.2 Tumor growth curves after transfection of miR-21 ASO

图3 肿瘤组织HE染色Fig.3 HE staining of tumor tissues(×200)
2.5 miR-21 ASO对MG-63细胞凋亡的影响 流式细胞仪检测细胞凋亡的结果显示,MG-63细胞在转染miR-21 ASO后,凋亡增加明显,而对照ASO转染后凋亡无明显变化(P=0.022,图4)。
2.6 各组细胞Bcl-2 mRNA和Bcl-2蛋白的表达水平 根据检测结果,miR-21 ASO转染的MG-63细胞中Bcl-2蛋白表达水平明显低于对照ASO转染的细胞,两者差异有统计学意义(P=0.019,图5)。但是两组之间的Bcl-2 mRNA水平差异无统计学意义(P>0.05)。
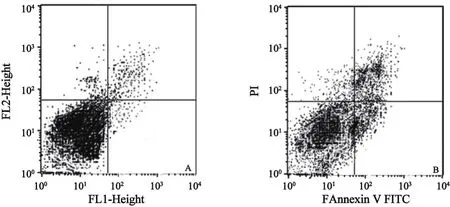
图4 流式细胞仪检测miR-21 ASO转染后的MG-63细胞凋亡情况Fig.4 Apoptosis in MG-63 cells after transfection of miR-21 ASO

图5 Bcl-2蛋白在MG-63细胞中的表达情况Fig.5 Bcl-2 protein level in MG-63 cells after transfection of miR-21 ASO detected by Western blot
3 讨 论
miRNA是新近证明的一类长约20~25 nt的内源性非编码的小分子RNA,在多个物种中广泛存在,包括动物、植物和病毒。目前,被证实的小RNA就有500多种,而计算机预测可能会超过1 000个,且约1/3的人类基因被小RNA调控。miRNA主要通过与目标mRNA分子的3’端非编码区域特异结合来抑制mRNA转录后的翻译。大量研究表明,miRNA在肿瘤细胞中的表达水平异常,是影响肿瘤发生、发展的一个重要因素,故成为当前研究热点之一。
在本实验中,通过qRT-PCR方法检测了临床上收集的骨肉瘤标本和正常骨组织,结果显示miR-21在肿瘤组织中呈明显高表达,两者差异具有统计学意义。这与以前的一些研究结果相似[3-7],表明了miR-21在骨肉瘤的发生、发展中也起了促癌作用。
目前,有研究利用针对目的miRNA的ASO来研究各种miRNA在细胞中的生物学功能[10-11]。为了验证miR-21对骨肉瘤细胞增殖能力的影响,在本研究中我们通过转染miR-21 ASO来降低miR-21在MG-63细胞中的表达,同时我们用MTT实验检测转染miR-21 ASO后MG-63细胞存活率的变化情况,结果显示转染miR-21 ASO的MG-63细胞存活率明显降低。进一步在克隆形成实验中我们也发现转染miR-21 ASO后,MG-63细胞克隆形成率比对照显著减少。而且在体实验也观察到转染miR-21 ASO后,MG-63细胞皮下形成肿瘤的体积和数目也减小,相对于对照来看两者差异有统计学意义。这些说明了miR-21在骨肉瘤细胞的增殖中发挥着重要作用,miR-21 ASO抑制肿瘤细胞增殖是有效的。Si等[12]在乳腺癌MCF-7细胞中转染miR-21 ASO后,通过在体和离体实验也都证实肿瘤细胞增殖能力明显被抑制。
为研究miR-21 ASO对骨肉瘤细胞凋亡的影响,在转染miR-21 ASO后,我们利用Annexin V来检测细胞凋亡情况,结果发现转染miR-21 ASO的MG-63细胞凋亡明显增加。Bcl-2即细胞凋亡抑制基因,是目前发现的与凋亡关系密切相关的基因之一。为证实miR-21与Bcl-2是否也存在一定程度上的联系,我们通过检测Bcl-2蛋白的变化,发现转染miR-21 ASO的MG-63细胞Bcl-2蛋白水平明显降低,而Bcl-2 mRNA水平无明显的改变,说明miR-21主要可能通过转录后抑制Bcl-2的表达。而miR-21影响肿瘤细胞增殖也可能通过调节Bcl-2的表达,进而影响细胞的凋亡,从而达到对肿瘤细胞增殖能力的调控。综上所述,miR-21有调控骨肉瘤细胞的增殖能力,利用ASO可能成为基因治疗骨肉瘤的一个新的研究方向。但是miR-21不是骨肉瘤中唯一异常表达的小RNA分子,所以应该找出更多异常表达的小RNA分子,发现它们之间的联系,为更好地理解骨肉瘤的发生机制及骨肉瘤的基因治疗提供更好的理论支持。
[1] Croce CM, Calin GA.miRNAs cancer, and stem cell division[J].Cell, 2005, 122 (1): 6-7.
[2] Chen CZ, Li L, Lodish HF, et al.MicroRNAs modulate hematopoietic lineage differentiation [J].Science, 2004,303 (5654): 83-86.
[3] Volinia S, Calin GA, Liu CG, et al.A microRNA expression signature of human solid tumors defines cancer gene targets[J].Proc Natl Acad Sci USA, 2006, 103 (7): 2257-2261.
[4] Chan JA, Krichevsky AM, Kosik KS.MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells[J].Cancer Res, 2005, 65 (14): 6029-6033.
[5] Iorio MV, Ferracin M, Liu CG, et al.MicroRNA gene expression deregulation in human breast cancer [J].Cancer Res, 2005, 65 (16): 7065-7070.
[6] Diederichs S, Haber DA.Sequence variations of microRNAs in human cancer: alterations in predicted secondary structure do not affect processing [J].Cancer Res, 2005, 66 (12):6097-6104.
[7] Roldo C, Missiaglia E, Hagan JP, et al.MicroRNA expression abnormalities in pancreatic endocrine and acinar tumors are associated with distinctive pathologic features and clinical behavior [J].J Clin Oncol, 2006, 24 (29): 4677-4684.
[8] Zhang W, Ran S, Sambade M, et al.A monoclonal antibody that blocks VEGF binding to VEGFR2 (KDR/Flk-1) inhibits vascular expression of Flk-1 and tumor growth in an orthotopic human breast cancer model [J].Angiogenesis, 2002, 5 (1-2): 35-44.
[9] Han ME, Lee YS, Baek SY, et al.Hedgehog signaling regulates the survival of gastric cancer cells by regulating the expression of Bcl-2 [J].Int J Mol Sci, 2009, 10 (7): 3033-3043.
[10] Boutla A, Delidakis C, Tabler M.Developmental defects by antisense-mediated inactivation of micro-RNAs 2 and 13 in Drosophila and the identification of putative target genes[J].Nucleic Acids Res, 2003, 31 (17): 4973-4980.
[11] Lee YS, Kim HK, Chung S, et al.Depletion of human micro-RNA miR-125b reveals that it is critical for the proliferation of differentiated cells but not for the down-regulation of putative targets during differentiation [J].J Biol Chem, 2005, 280(17): 16635-16641.
[12] Si ML, Zhu S, Wu H, et al.miR-21-mediated tumor growth[J].Oncogene, 2007, 26 (19): 2799-2803.
