铝掺杂对铜铈复合氧化物催化一氧化碳氧化性能的影响
2010-09-15毛东森方珍妮杨志强
王 倩 毛东森方珍妮 俞 俊 杨志强
(上海应用技术学院化学与环境工程学院,上海 200235)
铝掺杂对铜铈复合氧化物催化一氧化碳氧化性能的影响
王 倩 毛东森*方珍妮 俞 俊 杨志强
(上海应用技术学院化学与环境工程学院,上海 200235)
以金属硝酸盐为原料、碳酸钠为沉淀剂,采用共沉淀法制备了一系列Cu0.1Ce0.9-xAlxOy复合氧化物催化剂,并用低温氮气吸附/脱附、X-射线衍射(XRD)和氢-程序升温还原(H2-TPR)等对样品进行了表征,利用微反-色谱评价装置考察了催化剂对CO低温氧化反应的活性,研究了 Al含量(x=0~0.3)和催化剂焙烧温度(350、500 和 650 ℃)对 Cu0.1Ce0.9-xAxOy催化活性的影响。结果表明,随着催化剂中Al含量(x)的增加,Cu0.1Ce0.9-xAlxOy的催化活性先提高,至x=0.1时达到最大,之后又逐渐降低;当催化剂的焙烧温度为 500 ℃时,Cu0.1Ce0.8Al0.1Oy的催化活性最大。Cu0.1Ce0.9-xAlxOy的催化活性与其 CuO 的还原性之间有较好的对应关系。
铝;CuO-CeO2催化剂;CO低温氧化;共沉淀
CO消除在许多方面都有重要的使用价值,随着人们对环境污染问题关注程度的不断提高,如何高效、低成本地消除CO更具有实际意义。因此,实现CO在较低温度下氧化转化已经成为催化研究的热点问题之一[1]。
用于CO低温氧化反应的催化剂主要有贵金属和非贵金属两大类。贵金属催化剂如Pt、Pd和Au等具有很高的催化活性,但由于贵金属的资源有限、价格高昂,限制了其在工业中的广泛应用。因此,人们对非贵金属催化剂如Cu、Co和Mn等进行了大量的研究。其中,CuO-CeO2复合氧化物因具有较高的活性而被认为是最有希望替代贵金属的一类非贵金属催化体系[2-3]。
CuO-CeO2复合氧化物对CO低温氧化反应具有高的催化活性表明,CuO和CeO2之间存在着协同效应,且两者之间的相互作用对其催化活性有显著的影响[4-8]。研究表明,在CuO-CeO2催化剂中添加一些助剂可改善CuO和CeO2之间的相互作用,从而提高其催化活性[9-13]。Wang等[9]的结果表明,添加一定量稀土钐(Sm)的CuO/CeO2-SmO2催化剂,其 CO氧化活性高于CuO-CeO2。Lin等[11]发现添加锡(Sn)的CuO/Ce0.7Sn0.3O2催化剂的活性要高于CuO/CeO2,其催化CO完全氧化的反应温度分别为90和100℃。Zhang 等[12]也发现添加一定量的 Sn(nCe∶nSn=8∶2)可大大提高CuO-CeO2的催化活性,CO完全转化所需的反应温度从120℃显著降低至75℃。最近,Zou等[13]的工作表明,在CuO-CeO2中添加少量的Ti(nTi∶nCe=1∶9和3∶7)可提高CuO-CeO2的催化活性,而添加过量的 Ti(nTi∶nCe=5∶5)则降低 CuO-CeO2的催化活性。另外,虽然在CuO/Al2O3催化剂中添加CeO2以提高其催化活性的研究已不少[14-18],但有关添加Al对CuOCeO2复合氧化物催化CO低温氧化性能影响的研究尚未见报道。
本工作以金属硝酸盐为原料、碳酸钠为沉淀剂,采用共沉淀法制备了一系列 Cu0.1Ce0.9-xAlxOy复合氧化物催化剂,考察了Al含量和催化剂焙烧温度对Cu0.1Ce0.9-xAlxOy催化CO低温氧化反应性能的影响,并将催化剂的活性与物化表征结果进行了关联。
1 实验部分
1.1 催化剂的制备
催化剂采用共沉淀法制备:将准确称量的Cu(NO3)2·3H2O、Ce(NO3)3·6H2O 和 Al(NO3)3·9H2O 用 适量的蒸馏水溶解,加热至60℃,然后滴加质量百分含量为10%的Na2CO3水溶液。磁力搅拌下使沉淀完全,沉淀终点时的pH值约为7,沉淀结束后再恒温搅拌1 h。然后过滤并用50~60℃的蒸馏水反复洗涤以除去残留的Na+。所得到的滤饼经80℃烘干过夜,研磨后置于马弗炉中于500℃焙烧4 h得到Cu0.1Ce0.9-xAlxOy催化剂。
Cu0.1Ce0.9-xAlxOy催化剂中 Cu的物质的量的含量固定为 0.1,Al的物质的量的含量为 0~0.3。为研究焙烧温度对催化剂的影响,将Al含量为0.1的Cu0.1Ce0.8Al0.1Oy样品分别在350、500 和 650 ℃下焙烧4 h。
为方便起见,上述催化剂以CCA-a-T表示,其中,a代表催化剂中Al的物质的量,T代表催化剂的焙烧温度,如CCA-0.10-500表示催化剂中Al的物质的量为0.1,催化剂的焙烧温度为500℃。
上述所用试剂均为分析纯,由国药集团上海化学试剂有限公司经销。
1.2 催化剂的表征
催化剂的比表面积(SBET)在美国Micromeritics公司生产的ASAP 2020M+C型物理化学吸附仪上采用低温N2吸/脱附法测定,测定前样品先在真空下于200℃预处理2 h。
X-射线衍射(XRD)分析在Bruker D8 Focus型X射线衍射仪上进行,采用的辐射源为Cu Kα(λ=0.154 18 nm),石墨单色器,管电压为 40 kV、管电流为 40 mA,扫描范围为 10.0°~80.0°,扫描速度为 6°·min-1。根据X-射线衍射线宽法并利用Scherrer公式计算晶粒的平均粒径。
催化剂的还原性采用氢-程序升温还原(H2-TPR)表征:50 mg样品放入石英管反应器中,从室温以20℃·min-1的速率升温至500℃,还原气为10%H2和90%N2(体积比)的混合气,还原过程所消耗的氢气量由福立公司生产的GC 9750型气相色谱仪的热导池检测器测定,检测器的温度为60℃。
CuO的分散度和晶粒大小采用文献[19]的方法测定:将20 mg样品装入石英管中,先进行第一次H2-TPR测定,温度由室温以20℃·min-1的速率升温至500℃,得到第一次TPR的信号峰面积为A1,在氮气中冷却样品至60℃,然后将气体切换成1%N2O和 99%He(体积比)的混合气,流速为 25 mL·min-1,60℃恒温保持10 min,使催化剂表面的铜全部被氧化,催化剂再用氮气吹扫后进行第二次H2-TPR实验,得到第二次TPR的信号峰面积为A2。CuO的分散度为D=2A2/A1,氧化铜颗粒大小为d(nm)=1/D。
1.3 催化活性的评价
催化剂的CO低温氧化活性测试在自建的微反-色谱装置上进行[20]。将0.2 g颗粒大小为40~60目的催化剂与0.6 g相同粒度的石英砂均匀混合后装入内径为6 mm的不锈钢反应器中,原料气为1%CO、10%O2和 89%N2(体积比)的混合气,其流量为100 mL·min-1,采用Brooks公司生产的5850E型质量流量控制器控制。反应原料气和产物的组成采用福立公司生产的GC 9790型气相色谱仪进行在线分析,氢气为载气,流速为60 mL·min-1,热导池检测器,进样口和检测器的温度均为110℃,色谱柱为2 m×3 mm的TDX-01碳分子筛不锈钢填充柱,柱温采用一阶程序升温:初始温度40℃,保持5 min后以30℃·min-1的速率升温至130℃,然后保持5 min。
2 结果与讨论
2.1 催化剂的活性
图1为不同Al含量的Cu0.1Ce0.9-xAlxOy催化剂对CO氧化反应的催化性能。由此可见,添加Al的Cu0.1Ce0.9-xAlxOy(x>0)催化剂的活性均高于 CuO-CeO2,而且随着Al含量x值的增加,CO的转化率先逐渐增大,至x=0.1时达到最大,之后又逐渐减小。上述结果表明,添加适量的Al可以提高CuO-CeO2催化CO氧化反应的活性,且当Al的物质的量的含量为0.10时达到最佳。这与Wang等[9]所报道的情况相似,他们在用浸渍法制备的CuO/CeO2-SmO2催化剂时也发现,添加物质的量的含量分别为2%,5%,8%的Sm可提高CuO-CeO2的催化活性且当Sm的含量为5%时达到最大。

图2为不同焙烧温度下所制备的Al含量x为0.1的Cu0.1Ce0.8Al0.1Oy催化CO氧化反应的结果。由此可见,当催化剂的焙烧温度由350℃升高至500℃时,CO的转化率显著增大,CO完全转化所需的反应温度由185℃显著降低至110℃。然而,当催化剂的焙烧温度由500℃进一步升高至650℃时,CO的转化率又明显降低,CO完全转化所需的反应温度由110℃升高至160℃。

为了更好地了解Al掺杂对CuO-CeO2催化CO氧化反应性能的影响,将500℃焙烧所制备的Cu0.1Ce0.8Al0.1Oy和Cu0.1Ce0.9Oy催化剂的活性稳定性进行了比较。结果表明,在原料气空速相同(以CO计为 480 ml·g-1·h-1)的反应条件下,Cu0.1Ce0.9Oy催化剂维持CO完全转化的反应时间仅为23 h,反应第30 h时的CO转化率已下降至86%,而Cu0.1Ce0.8Al0.1Oy催化剂连续反应67 h的CO转化率仍然维持100%。上述结果表明,适量的Al掺杂可同时提高CuOCeO2催化CO低温氧化反应的活性和稳定性。
2.2XRD分析
图3和4分别为不同Al含量和不同焙烧温度所制备的Cu0.1Ce0.9-xAlxOy和Cu0.1Ce0.8Al0.1Oy催化剂的XRD图。由此可见,所有样品的衍射峰基本与纯CeO2的特征衍射峰(PDF:81-0792)一致,表明所制备催化剂中的CeO2都呈萤石结构立方相体系。另外,从图3可以看出,添加Al使CuO-CeO2催化剂中CeO2的衍射峰的强度减弱而且峰形变宽,表明添加Al使CuO-CeO2催化剂中CeO2的晶粒变小,这与表1中CeO2晶粒大小的计算结果相一致。该结果表明添加Al对CuO-CeO2催化剂中CeO2晶粒的生长具有一定的抑制作用,而且这种抑制作用随Al含量的增加而有所增大。
由图4可见,对于Al含量x为0.1的Cu0.1Ce0.8Al0.1Oy催化剂,随焙烧温度的升高,催化剂中CeO2的衍射峰强度增强,而且峰形变窄,表明其结晶度变高,CeO2的晶粒增大。尤其是当焙烧温度由500℃升高至650℃时,其CeO2衍射峰的强度显著增强,峰宽明显变窄,表明其CeO2的晶粒显著增大。表1中CeO2晶粒大小的计算结果证明了这一点。
此外,图3和4中所有样品均未出现晶相CuO的特征衍射峰,表明催化剂中的CuO一部分进入了CeO2的晶格形成了Cu-Ce-O固溶体,一部分以高分散的形式存在于CeO2的表面,还有一部分以微小的晶粒存在而无法被XRD所检测到[17-18,21-22]。由于铜离子的价态和半径均与铈离子相差较远,故铜离子难以进入CeO2的体相[23]。张继军等[24]采用电感耦合等离子体原子发射光谱法(ICP-AES)和XRD相定量法分别测定催化剂中总的铜含量和晶相CuO的含量,发现由柠檬酸络合法所制备的CuO-CeO2催化剂中进入CeO2晶格的CuO量很少,最多不超过6%(原子百分比)。



表1 Cu0.1Ce0.9-xAlxOy催化剂的比表面积和CeO2的晶粒大小Table 1 SBETand CeO2crystallite size of the Cu0.1Ce0.9-xAlxOycatalysts
2.3 CuO分散度及晶粒大小的测定
由于所制备的 Cu0.1Ce0.9-xAlxOy催化 剂 中 CuO 的分散度较高、CuO的晶粒较小,低于XRD的检测限(4~5 nm)而无法被检测到。为此,采用文献[19]的方法测 定了 不同 Cu0.1Ce0.9-xAlxOy催化剂中 CuO的分散 度及表面CuO的晶粒大小,结果见表2。由此可见,所有样品中CuO的晶粒大小均小于3 nm,这与上述XRD测定结果相一致。
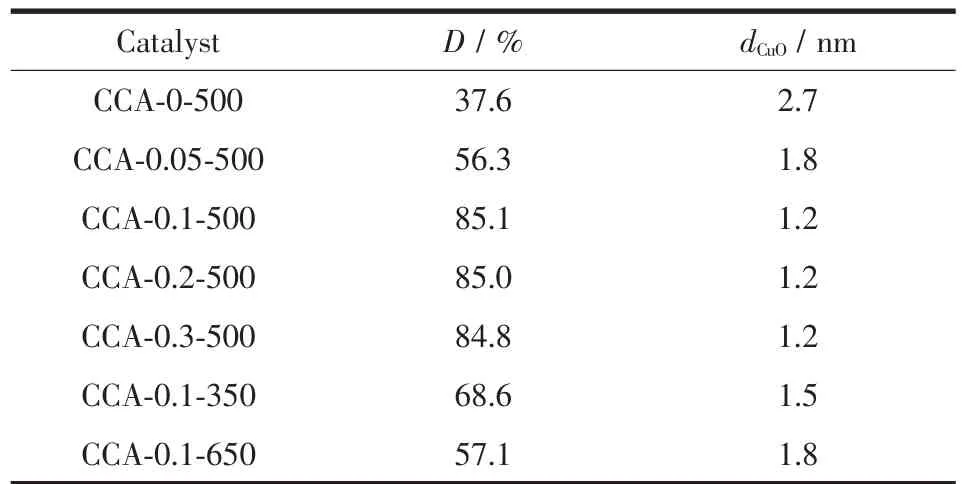
表2 Cu0.1Ce0.9-xAlxOy催化剂中CuO的分散度和晶粒大小Table 2 Dispersion and crystallite size of CuO in the Cu0.1Ce0.9-xAlxOycatalysts
由表2可见,Al的添加使CuO-CeO2中CuO的分散度提高,而且随着Al含量的增加而逐渐增大,至x=0.1时达到最大,之后基本不变。与此相对应,Al的添加使CuO-CeO2中CuO的晶粒减小,而且随着Al含量的增加而逐渐减小,至x=0.1时达到最小,之后基本不变。
对于不同焙烧温度下所制备的Al含量x为0.1的 Cu0.1Ce0.8Al0.1Oy催化剂,当焙烧温度由 350 ℃升高至500℃时,CuO的分散度明显提高,然而,当焙烧温度由500℃进一步升高至650℃时,CuO的分散度又显著降低。与此相对应,催化剂中CuO的晶粒先减小后又明显增大。
2.4 N2吸/脱附表征
表1 列出了不同 Cu0.1Ce0.9-xAlxOy催化剂的 BET比表面积的测定结果。由此可见,对于在500℃焙烧的样品,添加 Al的 Cu0.1Ce0.9-xAlxOy(x>0)催化剂的比表面积均高于CuO-CeO2,而且随着Al含量x值的增加,催化剂的比表面积逐渐增大。这与上述XRD的表征结果相一致,即Al的加入对CuO-CeO2催化剂中CeO2的烧结过程具有抑制作用,而且这种抑制作用随Al含量的增加而不断增大。
对于 Al含量 x为 0.1的Cu0.1Ce0.8Al0.1Oy样品,随着焙烧温度的不断升高,样品的比表面积逐渐减小,尤其当焙烧温度由500℃升高至650℃时,比表面积更是显著降低,这主要是由催化剂中CeO2的高温烧结所致(表 1)。
2.5 H2-TPR分析
不同Al含量和不同焙烧温度所制备的Cu0.1Ce0.9-xAlxOy和 Cu0.1Ce0.8Al0.1Oy催化剂的 H2-TPR表征结果分别见图5和图6。此外,作为比较,在图5中还示出了纯CuO的H2-TPR曲线。由图5可见,纯CuO在250~415℃出现1个很大的包峰,这与文献[7]的结果相一致。500℃焙烧的不同Al含量的Cu0.1Ce0.9-xAlxOy催化剂均具有 2 个还原峰(α 和 β),随着催化剂中Al含量的增加,α峰和β峰的温度先逐渐向低温方向发生位移,至x=0.1时达到最低,之后又逐渐升高。


从图6可以看出,对于350℃焙烧的Cu0.1Ce0.8Al0.1Oy催化剂,分别在约 265 和 250 ℃处出现一个主峰(β)和一个肩峰(α);当焙烧温度由 350 ℃升高至500℃时,2个峰发生了明显的分裂,而且α峰的温度明显向低温方向移动,峰顶温度由250℃位移至230℃,β峰的温度基本不变。当焙烧温度进一步升高至650℃时,α峰又以肩峰的形式存在,峰形变得弥散,这可能是高温焙烧后CuO的存在形式发生了变化所致。
有关CuO-CeO2-MOx催化剂中CuO的还原性研究已有不少报道,如罗金勇等[17]将CuO/CeO2/Al2O3催化剂中168和212℃处的还原峰分别归属于与CeO2强烈作用的高分散Cu物种和与CeO2作用的CuO微晶(这种微晶尺寸小,XRD无法检测)。于一夫等[18]发现经La(或Y)CeZr改性的Al2O3负载的CuO催化剂在200~270℃存在2个还原峰,低温峰(200~230℃)为高分散CuO的还原,高温峰(240~270℃)为孤立的CuO微晶的还原。洪庆红等[19]报道了采用柠檬酸溶胶-凝胶法制备的 CuO-Ce0.7Zr0.3O2催化剂存在2个还原峰,190~200℃处的低温峰为高分散CuO的还原,250℃处的高温峰为存在于CeO2晶格中CuO的还原。根据这些文献并结合前述的XRD测试结果,我们认为本文Cu0.1Ce0.9-xAlxOy催化剂中的α还原峰可归属于与CeO2强相互作用的高分散CuO、β还原峰可归属于进入CeO2晶格或与CeO2弱相互作用且XRD无法检测到的颗粒较大的CuO的还原。
2.6 影响催化活性的因素
大量的研究表明,CuO-CeO2催化CO氧化反应的活性与其CuO的还原性密切相关,催化剂中的CuO越容易还原,则CuO越容易和CO反应生成CO2,催化剂的活性也就越高[6,25-28]。
在本文中,Al的添加可抑制CuO-CeO2催化剂中CeO2的烧结,使其比表面积增大(表1),有利于CuO的分散,CuO的晶粒减小(表2),从而使CuO更容易还原(图5),这与催化活性的提高相一致(图1)。然而,当x≥0.1时,随着x值的进一步增大,Cu0.1Ce0.9-xAlxOy催化剂的比表面增大不明显(表1),CuO的分散度和晶粒大小基本相同(表2)。此外,催化剂中会有一部分CuO与Al2O3相接触发生相互作用,而与Al2O3相互作用的CuO比与CeO2相互作用的CuO难还原[17],从而使CuO的还原温度逐渐升高,故催化剂的活性也相应地降低。钟依均等[29]的研究结果表明,CuO/CeO2的催化活性明显大于CuO/Al2O3。由此可见,Al的添加对CuO-CeO2催化剂具有双重作用:一方面,可提高CuO-CeO2催化剂的比表面积,有利于CuO的分散,从而提高CO的氧化活性;另一方面,Al会与CuO发生相互作用,减少与CeO2相互作用的CuO数量,从而使催化剂的活性降低。在本文中,当Al含量x≤0.1时,前者起主要作用,故随x值的不断增大,Cu0.1Ce0.9-xAlxOy催化剂的活性逐渐提高;而当x≥0.1时,后者起主要作用,故随x值的进一步增大,Cu0.1Ce0.9-xAlxOy催化剂的活性反而降低(图 1)。
对于不同焙烧温度下制备的Cu0.1Ce0.8Al0.1Oy催化剂,当焙烧温度由350℃升高到500℃时,CuO与CeO2之间的相互作用增强[22-23],CuO的分散度提高,CuO的晶粒减小(表2),从而使CuO的还原温度显著降低(图6),表明其还原性明显增强,故催化剂的活性也相应地大幅度提高(图2);当焙烧温度进一步升高到650℃时,由于催化剂中CeO2的高温烧结,使催化剂的比表面积减小(表1),不利于CuO的分散;此外,高温焙烧时CuO本身容易烧结,两者共同作用的结果使CuO的晶粒增大(表2),从而使CuO的还原性明显变差,故催化剂的活性也相应地减弱(图 2)。
3 结 论
适量的铝掺杂可显著提高CuO-CeO2催化CO低温氧化反应的活性和稳定性。铝含量(x)和焙烧温度对Cu0.1Ce0.9-xAlxOy催化剂的催化活性有显著的影响,其最佳值分别为0.1和500℃。Cu0.1Ce0.9-xAlxOy的催化活性与其CuO的还原性密切相关:CuO越容易还原,则催化剂的活性越高。
[1]ZHENG Xiu-Cheng(郑修成),HUANG Wei-Ping(黄唯平),ZHANG Shou-Min(张守民),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2003,19(11):1153-1159
[2]ZHENG Xiu-Cheng(郑修成),WANG Xiang-Yu(王向宇),YU Li-Hua(于丽华),et al.Prog.Chem.(Huaxue Jinzhan),2006,18(2/3):159-167
[3]LIANG Fei-Xue(梁飞雪),ZHU Hua-Qing(朱华青),QIN Zhang-Feng(秦张峰),et al.Prog.Chem.(Huaxue Jinzhan),2008,20(10):1453-1464
[4]Liu W,Flytzani-Stephanopoulos M.J.Catal.,1995,153(2):317-332
[5]Luo M F,Zhong Y J,Yuan X X,et al.Appl.Catal.A,1997,162(1):121-131
[6]FAN Yu(范 煜),WANG Li-Qiu(王力秋),ZHANG Shou-Chen(张守臣),et al.J.Dalian Univ.Technol.(Dalian Ligong Daxue Xuebao),2001,41(4):421-425
[7]JIANG Xiao-Yuan(蒋晓原),ZHOU Ren-Xian(周仁贤),YUAN Jun(袁 骏),et al.J.Chin.Rare Earth Soc.(Zhongguo Xitu Xuebao),2002,20(2):111-115
[8]Tang X L,Zhang B C,Li Y,et al.Catal.Today,2004,93-95:191-198
[9]Wang J B,Shih W H,Huang T J.Appl.Catal.A,2000,203(2):191-199
[10]Huang T J,Kung Y C.Catal.Lett.,2003,85(1/2):49-55
[11]Lin R,Luo M F,Zhong Y J,et al.Appl.Catal.A,2003,255(2):331-336
[12]Zhang T Y,Wang S P,Yu Y,et al.Catal.Commun.,2008,9(6):1259-1264
[13]Zou Z Q,Meng M,Guo L H,et al.J.Hazard.Mater.,2009,163(2/3):835-842
[14]Park P W,Ledford J S.Catal.Lett.,1998,50(1/2):41-48
[15]JIANG Xiao-Yuan(蒋晓原),ZHOU Ren-Xian(周仁贤),MAO Jian-Xin(毛建新),et al.J.Mol.Catal.(China)(Fenzi Cuihua),1999,13(3):176-180
[16]Shiau C Y,Ma M W,Chuang C S.Appl.Catal.A,2006,301(1):89-95
[17]LUO Jin-Yong(罗金勇),MENG Ming(孟 明),ZHA Yu-Qing(查宇清),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(5):861-866
[18]YU Yi-Fu(于一夫),ZOU Zhi-Qiang(邹志强),MENG Ming(孟 明),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(2):223-238
[19]HONG Qing-Hong(洪庆红),SONG Yu-Peng(宋宇鹏),JIA Ai-Ping(贾爱平),et al.J.Mol.Catal.(China)(Fenzi Cuihua),2008,22(5):429-433
[20]YANG Zhi-Qiang(杨志强),MAO Dong-Sen(毛东森),ZHU Hui-Lin(朱慧琳),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(5):812-817
[21]HE Mai(何 迈),FANG Ping(方 萍),XIE Guan-Qun(谢冠群),et al.Acta Phys.-Chim.Sinica(Wuli Huaxue Xuebao),2005,21(9):997-1000
[22]ZHENG Xiu-Cheng(郑修成),ZHANG Xiao-Li(张晓丽),WANG Shu-Rong(王淑荣),et al.Chin.J.Catal.(Cuihua Xuebao),2005,26(11):971-976
[23]LIU Yuan(刘 源),XUN Hai-Long(孙海龙),LIU Quan-Sheng(刘全生),et al.Chin.J.Catal.(Cuihua Xuebao),2001,22(5):453-456
[24]ZHANG Ji-Jun(张继军),LIU Ying-Jun(刘英骏),LI Neng(李 能),et al.Acta Phys.-Chim.Sinica(Wuli Huaxue Xuebao),1999,15(1):15-21
[25]BIAN Yan-Feng(边平风),LIN Rui(林 瑞),LUO Meng-Fei(罗孟飞),et al.Chin.Chem.(Huaxue Tongbao),1998,(5):50-53
[26]Sundar R S,Deevi S.J.Nanopart.Res.,2006,8(3/4):497-509
[27]YANG Zhi-Qiang(杨志强),MAO Dong-Sen(毛东森),ZHU Hui-Lin(朱慧琳),et al.Chin.J.Catal.(Cuihua Xuebao),2009,30(10):997-1000
[28]MAO Dong-Sen(毛东森),TAO Li-Hua(陶丽华),WANG Qian(王 倩),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(3):447-452
[29]ZHONG Yi-Jun(钟依均),CHEN Ping(陈 平),ZHOU Bi(周 碧),et al.Chin.J.Appl.Chem.(Yingyong Huaxue),1997,14(1):49-52
Effect of Aluminum Addition on Performance of CuO-CeO2Catalyst for Oxidation of CO
WANG Qian MAO Dong-Sen*FANG Zhen-NiYU Jun YANG Zhi-Qiang
(School of Chemical and Environmental Engineering,Shanghai Institute of Technology,Shanghai 200235)
A series of Cu0.1Ce0.9-xAlxOycatalysts were prepared by co-precipitation using metal-nitrates and sodium carbonate as raw materials and precipitating agent,respectively.The obtained catalysts were characterized by low temperature N2adsorption/desorption,XRD and H2-temperature-programmed reduction (H2-TPR)techniques.Their catalytic activities for the low temperature oxidation of CO were evaluated by using a microreactor-GC system.The effects of Al content and catalyst calcination temperature on the activity of the Cu0.1Ce0.9-xAlxOycatalysts were investigated.The results show that the catalytic activity of the prepared Cu0.1Ce0.9-xAlxOyincreases firstly with Al content,reaches a maximum at x=0.1,and then decreases.On the other hand,the CO conversion reaches a maximum over the Cu0.1Ce0.8Al0.1Oycatalyst calcined at 500 ℃.The activity of the Cu0.1Ce0.9-xAlxOycatalyst for CO oxidation is well correlated with the reducibility of CuO.
aluminum;CuO-CeO2catalyst;low temperature CO oxidation;co-precipitation
O643.3
A
1001-4861(2010)09-1639-07
2010-04-12。收修改稿日期:2010-06-08。
上海市教委重点学科建设项目(No.J51503)、上海应用技术学院研究生创新能力培养专项资金项目(No.YC200906)和上海应用技术学院科技发展基金(No.KJ2008-01)资助。
*通讯联系人。E-mail:dsmao@sit.edu.cn,Tel/fax:(021)-64941386
王 倩,女,25岁,硕士生;研究方向:环境催化。
