带有位阻基团的钌多吡啶手性配合物与DNA键合及其光断裂DNA性质的研究
2010-09-15蒲小华杨
蒲小华杨 频
(1宝鸡文理学院化学化工系,宝鸡 721007)
(2山西大学分子科学研究所化学生物学与分子工程教育部重点实验室,太原 030006)
带有位阻基团的钌多吡啶手性配合物与DNA键合及其光断裂DNA性质的研究
蒲小华1杨 频*,2
(1宝鸡文理学院化学化工系,宝鸡 721007)
(2山西大学分子科学研究所化学生物学与分子工程教育部重点实验室,太原 030006)
合成了钌多吡啶手性配合物的对映异构体 Δ-Ru(bpy)2DMNP](ClO4)2与Λ-[Ru(bpy)2DMNP](C1O4)2(Δ-1与Λ-1,DMNP=4-咪唑并[4,5-f](1,10)-邻菲咯啉-2-N,N 二甲基苯胺),Δ-[Ru(bpy)2(BOPIP)](ClO4)2与 Λ-Ru(bpy)2(BOPIP)](ClO4)2(Δ-2 与 Λ-2,BOPIP=2-(4-丁氧基基苯基-)咪唑并[4,5-f](1,10)-邻菲咯啉),用元素分析、核磁共振及旋光仪对手性配合物结构进行了表征,通过电子吸收光谱、荧光光谱、粘度实验对手性配合物与CT-DNA相互作用的性质进行了研究。结果表明:两对Δ-型异构体均与CT-DNA以插入模式作用。在紫外光照下,两对对映异构体均能使质粒pBR322DNA断裂,但Λ-1型异构体比Δ-1型异构体断裂DNA效率更高,说明存在立体选择性,而Δ-2与Λ-2对DNA断裂无明显区别。
钌多吡啶手性配合物;CT-DNA;插入作用;光断裂;立体选择性
八面体过渡金属多吡啶配合物被广泛地研究用于DNA结构探针[1-3]、DNA分子光开关[4-6]、DNA介导的电子转移[7-9]、DNA足迹试剂以及DNA断裂试剂等[10-11],而Ru(Ⅱ)多吡啶类配合物因其可以与DNA以插入模式作用,有很强的亲和力,并且与DNA作用之后其光物理性质有明显的变化,便于观察,备受重视。
Barton等用光谱法、流体力学、荧光光谱、光物理和一维核磁等方法选用Ru(phen)32+进行了研究,认为Ru(phen)32+与DNA的相互作用存在插入和静电结合两种方式,但以插入结合为主,由于空间结构匹配的要求,插入方式有利于Δ-异构体,发生在DNA的大沟处,静电结合则较有利于Λ-异构体,位于DNA的小沟处[12-13];Norden等通过线二色谱与二维核磁证实Δ-与Λ-Ru(Ⅱ)以非插入的方式结合在DNA的小沟[14-15]。争论焦点在于不同手性配合物与DNA的作用的位点及模式。
目前国内我们课题组在这方面也做了大量研究[16-20],研究主要集中讨论DNA与配合物的作用模式及作用位点,而为了为使配合物有效插入DNA,研究多选择平面芳香环较大的配体,使得配体在插入时其芳香环平面与DNA碱基对紧密地堆积。但是带有位阻基团的配体的配合物与DNA作用的研究少见,拆分后的异构体与DNA作用如何也鲜有报道,为此我们设计合成并拆分钌(Ⅱ)带位阻基团配体的配合物[Ru(bpy)2DMNP](ClO4)2与[Ru(bpy)2(BOPIP)](ClO4)2,利用元素分析、核磁共振、旋光仪等方法对其进行了结构表征,并用电子吸收光谱、荧光光谱、粘度实验和凝胶电泳技术等手段研究其光学异构体与DNA相互作用的性质,实验结果为研究手性配合物与DNA作用的模式提供了依据,为研究新的光断裂试剂提供了有用信息。
1 实验部分
1.1 仪器与试剂
所用试剂均为分析纯,使用前未作进一步处理。小牛胸腺DNA购自上海华美生物工程公司,其浓度以 ε=6600 mol-1·L·cm-1来确定。质粒 pBR322 DNA(B.R.级)和琼脂糖(电泳级)购自北京华美公司。配合物及小牛胸腺 DNA均用 5 mmol·L-1Tris-HCl及50 mmol·L-1NaCl(pH=7.2)缓冲液配制。电泳缓冲液为 50 mmol·L-1Tris-HC1,18 mmol·L-1NaCl(pH=8.5);TAE 电泳缓冲液为 40 mmol·L-1Tris,20 mmol·L-1冰乙酸和 1 mmol·L-1EDTA(pH=7.4)。所有缓冲溶液均使用三次蒸馏水配制。测试所用仪器为Perkin-Elmer LS 50B荧光光谱仪;Hewlett Packard HP-8432型紫外-可见光谱仪;Bruker DRX-300 MHz核磁共振仪;VarioEL III型微量元素分析仪(德国EA元素分析系统公司);Perkin-Elmer MC 241旋光仪,1 cm样品管;Ubbelodhe粘度测定仪;DYYIII型电泳仪;UVPGDS 8000凝胶成像。
1.2 实验方法
吸收光谱实验、荧光光谱、粘度实验均参照文献方法进行[2,3,21-22]。
凝胶电泳实验:向eppendorf管中分别加入pBR 322DNA和配合物溶液,DNA终浓度为14 mg·L-1。在365 nm波长的紫外光下照射一定的时间,然后加入溴酚蓝溶液终止反应。取一定体积的反应液在90 V电压下进行凝胶电泳150 min,取出凝胶,用凝胶成像分析系统照相。
1.3 配合物的合成及表征
1.3.1 Δ-和 Λ-1 的合成及表征
Δ-1的制备[23]采用文献的方法:由 Δ-[Ru(bpy)2(py)2][O,O′-二苯甲酰基-D-酒石酸]·12H2O 与 DMNP制备。以[Ru(bpy)2(DMNP)](ClO4)2·2H2O计算元素分析理论值(%):C 49.85,H 3.78,N 12.76,实验值(%):C 50.03,H 3.33,N 12.43。1H NMR(ppm,DMSO-d6):9.27(d,2H),9.09(dd,4H),8.46(t,2H),8.35 ~8.25(m,6H),8.14~8.09(m,4H),7.84~7.79(m,4H),7.57(t,2H),7.15(d,2H),3.27(s,6H)。旋光度:2 mg 溶于 1 mL 乙腈中测定,[α]D16=-880°。
Λ-1采用 Λ-[Ru(bpy)2(py)2][O,O′-二苯甲酰基-L-酒石酸]·12H2O与DMNP制备。其余操作同Δ-1,由同样的方法得到。元素分析的实验值(%):C 50.69,H 3.88,N 13.09。其1H NMR 谱与 Δ-[Ru(bpy)2(DMNP)](ClO4)2相似。旋光度:2 mg溶于1 mL乙腈中测定,[α]D16=+860°。
1.3.2 Δ-和 Λ-2 的合成及表征
Δ-2采用同Δ-1的方法合成。元素素分析理论值以 [Ru(bpy)2(BOPIP)](ClO4)2·2H2O 计算 (%),C 49.22,H 3.28,N 11.77,实验值(%):C 50.24,H 3.45,N 10.93。1H NMR(ppm,DMSO-d6):9.31(dd,2H),9.10(dd,4H),8.46(t,4H),8.38~8.28(m,4H),8.17~8.10(m,2H),8.06(d,2H),7.90 ~7.79(m,4H),7.56(t,2H),7.45(d,2H),4.32(t,2H),1.98(q,2H),1.71(m,2H),1.19(t,3H)。旋光度:2 mg溶于 1 mL乙腈中测定,[α]D16=-870°。
Λ-2 合成同 Λ-1。元素分析实验值(%):C 50.79,H 3.56,N 11.02。其1HNMR 谱 与 Δ-[Ru(bpy)2(BOPIP)](ClO4)2相似。旋光度:2 mg溶于1 mL乙腈中测定,[α]D16=+890°(见图 1)。

2 结果与讨论
2.1 吸收光谱
配合物的MLCT吸收峰的强度在有DNA存在时均有一定的减小,这通常被认为是插入作用的特征之一。产生减色效应的原因是DNA碱基对与插入配体间发生电子堆积,使后者π*空轨道上也有一定的电子填充,从而使MLCT跃迁的几率减少。实验发现,Δ-异构体和Λ-异构体与DNA作用之后吸收峰均出现红移和减色效应。表1总结了对映体与DNA作用前后的紫外光谱变化。我们可以看出,当CDNA/CRu=5时,Δ-1和Λ-1与DNA作用之后在可见光区460 nm附近存在金属离子的(dπ轨道)到配体(π*轨道)的电子转移跃迁(MLCT跃迁)与在341 nm处存在π-π*跃迁(DMNP)出现明显的红移和减色效应,Δ-2和Λ-2在461 nm处的MLCT跃迁也有明显的红移和减色效应,但是这对异构体与DNA作用的吸收光谱变化仅有微小差别,这说明这对异构体与DNA结合紧密,可能与DNA以插入方式结合。
为了定量的说明配合物与DNA的结合强度,我们计算了配合物与CT-DNA作用的结合常数K,公式如下:

其中CDNA表示碱基对中DNA的浓度,表观吸收系数 εa,εf和 ε0分别代表 Aobsd/CRu,未与 DNA 结合的钌的配合物的消光系数和完全与DNA结合的钌的配合物的消光系数,以 CDNA/(εa-εf)对 CDNA作图,拟合得直线,K值由其斜率决定即为配合物与DNA结合的固有的结合常数。计算结果显示Δ-异构体与DNA的结合常数大于Λ-异构体的,说明Δ-型异构体插入的比Λ-型异构体深,但是与同类配合物比较这2对异构体与DNA结合常数要小些,这主要是由于N,N-二甲基与丁氧基的存在降低了 DMNP与BOPIP的平面性,使得这对异构体与DNA的结合能力降低[24]。

表1 随着DNA的加入配合物异构体电子吸收光谱的变化Table 1 Electronic absorption spectra changes upon addition of CT-DNA
2.2 荧光光谱
配合物与DNA插入结合时,通常引起荧光强度增强,并且增强的幅度与配合物和DNA的结合程度有关。在水溶液中,配合物1和2分别在591与593 nm处产生荧光,加入DNA后,荧光强度大大增强,表明配合物的发光基团进入一疏水环境中,被水分子猝灭较弱。因此,我们推测DMNP与BOPIP插入DNA碱基对中而受到保护[25]。图2、图3为Δ-异构体和Λ-异构体相对荧光强度比值与CDNA曲线。由图可见,随着DNA的加入,Δ-1和Λ-1的荧光分别增强 2.3和 2倍,Δ-2和 Λ-2的荧光分别增强 1.7和1.5倍,每对对映体的荧光增强强度有所差别。这表明Δ-型异构体更容易插入到B-DNA的双螺旋中,与B-DNA有较大的亲合力。Λ-型异构体也插入到B-DNA双螺旋中,但由于空间构型的影响,使得插入不易进行。我们曾以荧光滴定的方法考察这些对映体与DNA的作用,发现相同条件下,均是Λ-型荧光增强多。于是我们配置系列溶液放置24 h再测,发现Δ-型荧光增强多。这与Λ-型与DNA结合速率快的结论一致[26-27]。




发光淬灭实验也可用于检测手性配合物与DNA的作用强度。在存在和不存在DNA 2种情况下,配合物的对映异构体相对发光强度(F0/F)随淬灭剂Fe[(CN)6]4-浓度变化的淬灭曲线如图4,图5所示。从图可见,在未加入DNA时,Δ-异构体和Λ-异构体的发光减弱与Fe[(CN)6]4-的浓度增加成简单的线性关系,即符合Stern-Volmer方程;加入DNA后,曲线斜率减少,减少的程度反映了配合物与DNA的结合能力,即曲线的斜率越大,配合物与DNA的结合力越小,受保护的程度越小[28],加入DNA后,随着淬灭剂Fe[(CN)6]4-浓度的增加,Δ-1和Λ-1淬灭曲线的斜率接近于零,没有很明显的区别,表明它们都受到DNA很好的保护;而Λ-2淬灭曲线斜率大于Δ-2的斜率,这说明Δ-2与DNA结合能力强,受保护程度大,其荧光不易被淬灭。
2.3 黏度实验
为了进一步证实光学异构体与DNA的作用方式及结合强弱,黏度实验进行了测量。一般光物理探针作为证明结合方式的论据是必要的,但是不充分的,粘度这种对DNA长度变化比较敏感的流体力学方法是检测溶液状态下配合物与DNA作用模式的最有效的手段[21]。一般来讲,当小分子配合物以插入模式与DNA作用时,DNA的相邻碱基对的距离会变大以容纳插入配体,因而导致DNA双螺旋伸长,DNA溶液的粘度增加;当配合物以静电或沟面结合等非插入模式与DNA作用时,DNA溶液的粘度无明显变化;而以部分插入方式与DNA作用时,则可能使DNA的双螺旋扭结,使其粘度减小。图6为配合物的异构体对DNA相对黏度的影响。由图知,当加入配合物的异构体时,DNA的相对黏度均增加,这是由于配合物插入到DNA碱基对之间使DNA双螺旋增长,但是Δ-1和Λ-1黏度曲线斜率大于Δ-2和Λ-2,而每对异构体中Δ-型的黏度曲线斜率大于Λ-型的,说明配合物1与DNA插入能力强,每对异构体的Δ-型与DNA插入能力比Λ-型强。

结合前面光谱实验结论我们判定配合物1与2与DNA以插入方式键合,并且Δ-异构体比Λ-异构体与DNA结合能力强。
2.4 凝胶电泳
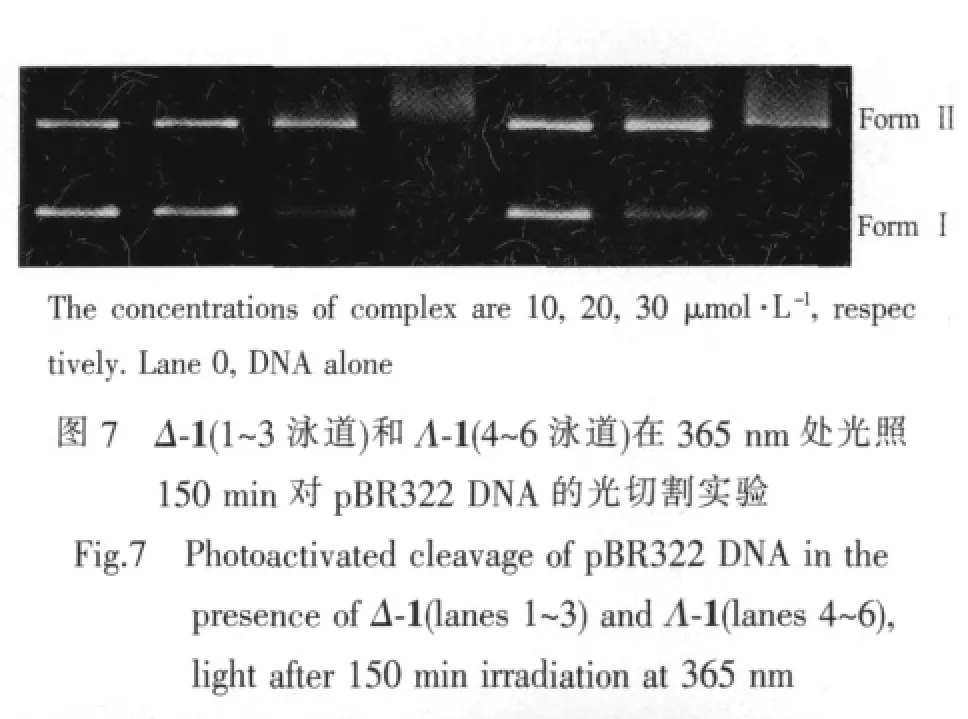
Δ-异构体和Λ-异构体对质粒pBR322 DNA的断裂结果可以通过凝胶电泳实验监测。在实验条件下配合物的异构体都能够将完整的超螺旋型质粒pBR322 DNA(FormⅠ)切割成缺刻(FormⅡ),用365nm的紫外光照射150 min后,随着Δ-异构体和Λ-异构体浓度的增加,FormⅠ的量逐渐减少,FormⅡ的量逐渐增加。对配合物1,如图7所示,当配合物的浓度为30 μmol·L-1时,泳道上有少量的拖尾或者什么也没有,这是因为质粒DNA已经被切成了我们不能捕捉到的微小的碎片,而在同样条件下Λ-1对DNA的断裂效率则比Δ-1更高。这个现象同样 发 生 在 [Ru(bpy)2(TAPTP)](PF6)2,TAPTP=4,5,9,18-tetraazaphenanthreno[9,10-b]triphenylene)。这种切割效率的不同可能是由于这对异构体在不同的结合位点与DNA作用而引起的[29],具体原因还需要进一步实验证明。Δ-2和Λ-2对质粒pBR322 DNA的断裂结果如图8所示,从图可知,在同样的条件下,Δ-2和Λ-2均能切割pBR322 DNA,但这一对异构体对DNA的断裂能力相当,无明显的选择性。

3 结 论
成功拆分了钌配合物[Ru(bpy)2DMNP](ClO4)2与Ru(bpy)2(BOPIP)](ClO4)2,实验结果表明,尽管增大了插入配体的空间位阻,但并不影响它们与DNA的键合模式的改变,只是导致配合物与DNA结合力的减小。而电子吸收光谱、荧光光谱、粘度实验研究结果表明,Δ-型异构体与CT-DNA结合能力比Δ-型异构体强。在紫外光照下,Δ-1和 Λ-1均能使质粒pBR322 DNA断裂,但Λ-型异构体比Δ-型异构体断裂DNA效率更高,说明存在立体选择性,而Δ-2与Λ-2对DNA断裂无明显区别。
[1]JIN Lan(靳 兰),YANG Pin(杨 频).Chin.J.Chem.(Zhongguo Huaxue),1997,15(2):107-113
[2]JINLan(靳 兰),YANG Pin(杨 频),LI Qing-Shan(李青山).Chem.Res.Chin.Univ.(Gaodeng Xuexiao Huaxue Yanjiu),1997,13(3):201-206
[3]Jin L,Yang P.Microchem.J.,1998,58:144-150
[4]Jenkns Y,Friedman A E,Turro N J,et al.J.Am.Chem.Soc.,1990,112(12):4960-4962
[5]Barton J K.Biochemistry,1992,31(44):10809-10816
[6]Olson E J C,Hu D,Hormann A,et al.J.Am.Chem.Soc.,1997,119(47):11458-11467
[7]Holmlin R E,Dandliker P J,Barton J K.Angew.Chem.Int.Ed.,1997,36:2714-2730
[8]Murphy C J,Arkin M R,Jenkins Y,et al.Science,1993,262:1025-1029
[9]Arkin M R,Stemp E D A,Holmlin R E,et al.Science,1996,273:475-480
[10]Burrows C J,Muller J G.Chem.Rev.,1998,98:1109-1151
[11]Basile L A,Barton J K.J.Am.Chem.Soc.,1987,109(24):7548-7550
[12]Yamagishi A.J.Chem.Soc.,Chem.Commun.,1983:572-573[13]Yamagishi A.J.Phys.Chem.Soc.,1984,88:5709-5713
[14]Hiort C,Nordén B,Rodger A.J.Am.Chem.Soc.,1990,112:1971-1982
[15]Eriksson M,Leijon M,Hiort C,et al.J.Am.Chem.Soc.,1992,114:4933-4934
[16]JIN Lan(靳 兰),YANGPin(杨 频),LIQing-Shan(李青山).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1996,17(9):1345-1348
[17]Chen H L,Yang P,Yuan C X,et al.Eur.J.Inorg.Chem.,2005,2005(15):3141-3148
[18]Yang P,Han D X.Sci.China:B,2000,43(5):516-523
[19]Xiong Z H,Yang P.J.Mol.Struc.:Theochem,2002,582:107-117
[20]Wu Y B,Chen H L,Yang P.J.Inorg.Biochem.,2005,99:1126-1134
[21]Song Y F,Yang P.Polyhedron,2001,20:501-506
[22]Han G Y,Yang P.J.Inorg.Chem.,2002,91:230-236
[23]Morgan O,Wang S H,Morgan R J,et al.J.Chem.Soc.,Dalton Trans.,1997:3773-3776
[24]Mei W J,LIU J,Zheng K C,et al.J.Chem.Soc.,Dalton Trans.,2003,1352-1359
[25]CHEN Hui-Li(陈绘丽),YANG Pin(杨 频).Spectros.Spectr.Anal.(Guangpuxue Yu Guangpu Fenxi),2002,22(6):983-986
[26]Zhen Q X,Ye B H,Zhang Q L,et al.J.Inorg.Biochem.,1999,76:47-53
[27]LIU Jing-Gang(刘劲刚),YE Bao-Hui(叶保辉),JI Liang-Nian(计亮年),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1999,20:523-525
[28]Kumsr C V,Barton J K,Tuno N J.J.Am.Chem.Soc.,1985,107:5518-5523
[29]Zhang Q L,Liu J H,Liu J Z,et al.J.Inorg.Biochem.,2004,98:1405-1412
DNA-Binding and Photocleavage of Polypyridyl Chiral Ruthenium(Ⅱ)Complexes Containing Steric Hinderance Group
PU Xiao-Hua1YANG Pin*,2
(1Department of Chemistry,Baoji University of Arts and Sciences,Baoji,Shaanxi 721007)
(2Key Laboratory of Chemical Biology and Molecular Engineering of Education Ministry,Institute of Molecular Science,Shanxi University,Taiyuan 030006)
Two types of chiral polypyridyl ruthenium(Ⅱ) complexes Δ-Ru(bpy)2DMNP](ClO4)2and Λ-[Ru(bpy)2DMNP](ClO4)2(Δ-1 and Λ-1,DMNP=4-(1H-imidazo[4,5-f][1,10]phenanthrolin-2-yl)-N,N-dimethyl-benzenamine),Δ-[Ru(bpy)2(BOPIP)](ClO4)2and Λ-Ru(bpy)2(BOPIP)](ClO4)2(Δ-2 and Λ-2,BOPIP=2-(4-but oxyphenyl)-1H-imidazo[4,5-f][1,10]phenanthroline),have been synthesized.Their structures have been ascertained with elemental analysis,nuclear magnetic resonance spectra and polarimeter.The characteristics of the interaction of the optical isomers with CT-DNA were examined by Ultra-Vis absorption spectra,fluorescent spectra,and viscosity measurements.Experimental data indicate that all the enantiomers of these complexes bound to DNA through an intercalative mode.Upon irradiation at 365 nm,all four complexes have been found to efficiently photocleave plasmid pBR322 DNA.However Λ-1 is more efficient than Δ-1,which demonstrates enantioselective interaction of the optical isomers with plasmid pBR322 DNA.No obvious difference was found between Δ-2 and Λ-2 on photocleaving plasmid pBR322 DNA.
polypyridyl chiral ruthenium(Ⅱ)complexes;CT-DNA;intercalative mode;photocleavage;enantioselectivity
O614.82+1
A
1001-4861(2010)09-1567-06
2010-04-12。收修改稿日期:2010-05-19。
国家自然科学基金(No.20601018)资助项目。
*通讯联系人。E-mail:yangpin@sxu.edu.cn
蒲小华,女,30岁,硕士,讲师;研究方向:生物无机化学。
