薄层色谱-分光光度法测定樟芝菌粉中的总三萜含量
2010-09-15许泓瑜陆震鸣张晓梅窦文芳许正宏
张 寅,许泓瑜,陆震鸣,张晓梅,窦文芳,许正宏,*
1江南大学医药学院制药工程研究室;2江南大学工业生物技术教育部重点实验室,无锡 214122
薄层色谱-分光光度法测定樟芝菌粉中的总三萜含量
张 寅1,许泓瑜1,陆震鸣2,张晓梅1,窦文芳1,许正宏1,2*
1江南大学医药学院制药工程研究室;2江南大学工业生物技术教育部重点实验室,无锡 214122
采用薄层色谱(TLC)-分光光度法测定樟芝菌粉中的总三萜含量。结果表明,适宜的展开剂组成为氯仿:甲醇 =9:1。该方法排除了樟芝菌粉中含有的脂肪等物质对测定总三萜含量的干扰,其准确度明显高于直接分光光度法和重量法,同时该方法具有较好的精密度,准确度及稳定性。
樟芝;深层发酵;三萜;薄层色谱;分光光度法
樟芝 (Antrodia cam phorata),又名牛樟菇、牛樟芝,是一种只生长于我国台湾省牛樟树 (Cinnam om um kanehirai)腐朽内壁的多孔菌[1〗。樟芝长久以来被用来治疗食物、酒精和药物所引起的中毒症状、腹泻、腹痛、高血压、乙型肝炎、肝癌和抗氧化等[2〗。由于樟芝自然产量十分稀少以及人工子实体栽培的不易,近年来樟芝子实体的价格十分昂贵,所以采用生物技术方法液态发酵培养樟芝菌丝体是目前最经济、最符合环保的方法。现在台湾市场上已经有粉末状,胶囊,片剂形式的樟芝发酵产品[3〗。本研究中的菌粉是经过液体发酵生产得到的樟芝菌丝体[4〗。
研究表明,樟芝中的活性成分主要是三萜类化合物[5〗,因此越来越多的研究关注于樟芝三萜。目前通常采用重量法[5,6〗或比色法[7〗定量樟芝三萜类化合物,测定方法准确性并不是很好。比色法是以齐墩果酸等三萜类化合物为对照品,用香草醛-冰醋酸和高氯酸为显色剂,利用分光光度计直接测定总三萜的含量。然而,当样品中含有较多量的脂肪、色素等物质时,采用上述方法会产生较强的干扰,结果存在明显的正偏差。有文献表明,利用薄层色谱(TLC)或快速柱层析法对样品进行预分离,可以排除其它组分对测定的干扰[8〗。本研究测定了樟芝菌粉中的脂肪含量,并采用 TLC-分光光度法测定樟芝菌粉中总三萜的含量。
1 材料与方法
1.1 试剂与仪器
齐墩果酸(sigma,纯度≥97%)。硅胶 G(青岛海洋化工厂),冰醋酸、香草醛、高氯酸等均为分析纯。玉米油为市售商品。
UV-2100紫外可见分光光度计 (UN I CO)、恒温水浴锅、电热烘箱等。
1.2 樟芝菌粉的制备
樟芝菌种保藏于本实验室,接种于 PDA培养基。樟芝菌粉的制备参见文献[7〗。
1.3 樟芝菌粉中脂肪酸的分析
1.3.1 粗脂肪的提取
取樟芝菌粉 5 g,置索氏提取器中,加乙醚 100 mL,回流提取 8 h,提取液冷至室温,过滤,收集滤液,置已干燥至恒重的蒸发皿中,在水浴上低温挥去溶剂,100℃干燥 1 h,移置干燥器中,冷却 30 min,精密称定,计算樟芝菌粉中粗脂肪含量。
1.3.2 脂肪酸的制备
称取 0.2 mg粗脂肪,加入 0.5 mol/L的 NaOH甲醇溶液 2 mL,60℃水浴中加热至油珠完全溶解,冷却后加入 25%BF3甲醇溶液 2 mL,酯化 20 min,冷却后加入 2 mL正已烷,振摇,加入 2 mL饱和NaCl溶液振摇,离心取上层有机相于一只干燥试管中并加入少量无水Na2SO4以除去微量的水,供 GCMS分析使用。
1.3.3 气相色谱条件
色谱柱:PEG 20 M,30 mm×0.32 mm;载气:N21.5 mL/min;燃气:H220 mL/min;助燃气:O250 mL/min;程序升温:起始温度 180℃,保留 1 min,然后 3℃/min升温至 210℃。检测器温度:260℃;进样口温度:230℃;进样量:0.2μL。
1.3.4 质谱条件
采用电子轰击方式进行离子化,EI源温度为200℃,EI电离方式,电子能量 70 eV,加速电压 330 KV,扫描速度 0.85 s,溶剂延迟 7 min,质谱扫描范围 33~450 AMU。
1.4 樟芝菌粉总三萜的提取
采用 Song的方法提取樟芝菌粉三萜类化合物[5〗。取 5.0 g樟芝菌粉,加 50%乙醇 500 mL室温浸提48 h,过滤,减压浓缩至没有乙醇味。剩余水相利用氯仿萃取三次。合并氯仿相,用氯仿定容至 50 mL,备用。另外相同方法制备樟芝菌粉总三萜提取液 50 mL,加入 2 g玉米油,用于考察脂肪对于三萜含量测定的干扰作用。
1.5 TLC-分光光度法测定总三萜
1.5.1 展开剂的选择
取经活化的硅胶 G薄板,将三萜提取液点样,在层析缸中用不同组成的展开剂展开,10%硫酸乙醇显色,105℃加热 10 min,考察不同组成的展开剂的分离效果。
1.5.2 三萜标准曲线的绘制
准确称取齐敦果酸标准品 10.0 mg于 10 mL的容量瓶中,加入甲醇定容,摇匀,即为浓度 1.0 mg/ mL的标准品溶液。依次吸取 20、40、60、80、100和120μL的标准品溶液在经过活化的硅胶板上点样,同时在点样部分旁边点上相同溶液作为对照样,展开后挥干溶剂,在对照样部分喷 10%硫酸乙醇,105℃加热 10 min,然后刮取与红紫色部分相对应的样品部分的条带,用甲醇为溶剂提取 (200 W,10 min)三次,洗脱液加入 10 mL具塞试管,水浴蒸干,加入0.3 mL的 5%香草醛-冰醋酸溶液和 1 mL高氯酸, 60℃反应 10 min,冰水冷却,加 10 mL冰醋酸,摇匀,在 550 nm波长下测定吸光度,绘制标准曲线。1.5.3 TLC-光度法测定樟芝总三萜
用微量进样器吸取樟芝三萜提取液在经过活化的硅胶板上点样,同时在点样部分旁边点上相同溶液作为对照样,展开后挥干溶剂,在对照样部分喷10%硫酸乙醇,105℃加热 10 min,然后刮取与红紫色部分相对应的样品部分的条带,用甲醇为溶剂超声提取三次,洗脱液加入 10 mL具塞试管,水浴蒸干,然后按照标准曲线的测定方法测定樟芝总三萜的含量。另取相同量总三萜 +玉米油样品用于重量法测定总三萜含量。
1.6 重量法测定总三萜
取总三萜提取液 10 mL,60℃烘干至恒重,计算总三萜含量。另取相同量总三萜 +玉米油样品用于重量法测定总三萜含量。
1.7 直接光度法测定总三萜
取总三萜提取液 40μL于 10 mL具塞试管,水浴蒸干,加入 0.3 mL的 5%香草醛-冰醋酸溶液和 1 mL高氯酸,60℃反应 10 min,冰水冷却,加 10 mL冰醋酸,摇匀,在 550 nm波长下测定吸光度,计算总三萜的含量。另取相同量总三萜 +玉米油样品用于直接光度法测定总三萜含量。
1.8 TLC-光度法的评价
1.8.1 测定方法的稳定性
取 80μL齐墩果酸溶液,薄层分离、洗脱后,水浴蒸干,加 0.3 mL 5%香草醛-冰醋酸溶液和 1 mL高氯酸,60℃下反应 15 min,冰水冷却,加 5 mL冰醋酸,在 550 nm波长下测定吸光度,然后测定经过不同时间的吸光度变化。
1.8.2 测定方法的精密度
取 80μL齐墩果酸溶液 5份,薄层分离、洗脱后,水浴蒸干,分别加 0.3 mL 5%香草醛-冰醋酸溶液和 1 mL高氯酸,60℃下反应 15 min,冰水冷却,加 5 mL冰醋酸,在 550 nm波长下测定吸光度。
1.8.3 加样回收率
准确测定样品后加入已知量齐墩果酸进行测定,然后用差减法求出齐墩果酸的回收率。
2 结果与讨论
2.1 樟芝菌粉中脂肪酸分析结果
据报道,樟芝新鲜子实体中粗脂肪含量为37.44%,子实体风干物中粗脂肪含量 为32.23%[9〗。而樟芝发酵菌丝体中粗脂肪含量也达到了 9.79%[10〗。经测定,本实验中樟芝菌粉中总脂肪的含量为 4.69%。脂肪酸的 GC-MS分析结果见表 1。樟芝发酵粉中饱和脂肪酸相对含量为21.29%,不饱和脂肪酸相对含量为 77.77%。其中亚油酸相对含量最高,为 46.03%,其次为油酸。
测定结果表明,樟芝菌粉中含有一定量的脂肪,其在直接分光光度法测定中可能会对樟芝菌粉三萜含量的测定产生影响。
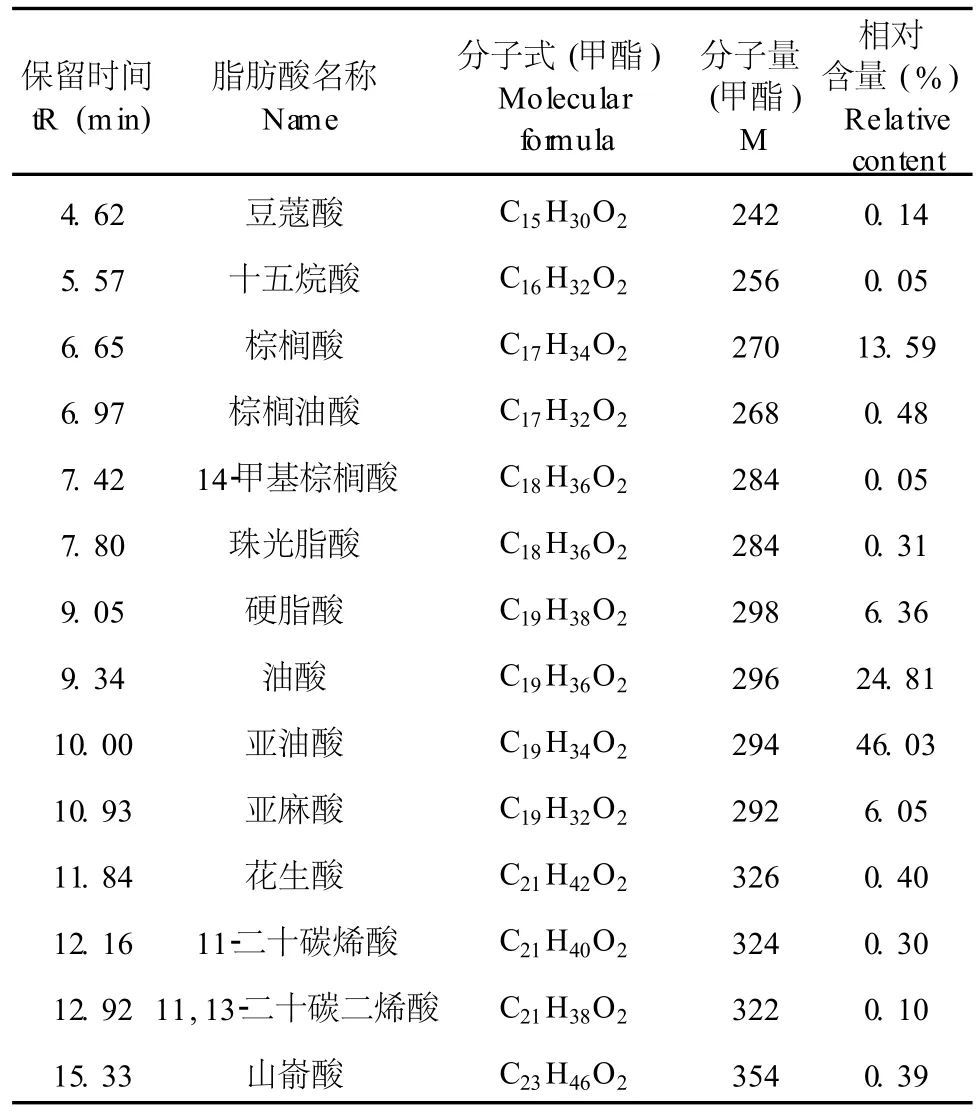
表 1 樟芝菌粉中脂肪酸的 GC-MS分析结果(以其甲酯计)Table 1 Determination of composition of fatty acid inAntrodiacam phoratain submerged culture
2.2 TLC展开剂的选择
对不同组成和配比的 TLC展开剂进行比较后发现,氯仿∶甲醇 =9∶1的展开剂效果较好,在该条件下展开,三萜类物质(Rf为 0.2~0.8)能与脂肪酸(Rf值为 0.8~1.0)、色素等物质分离开。
2.3 标准曲线的制作
以齐敦果酸的微克数为横坐标,吸光度为纵坐标,作图得到标准曲线 (图 1),其回归方程为:Y= 0.0036X-0.0242,其中X为含量(μg),Y为吸光度,r2=0.9953。说明在 20~120μg范围内呈良好得线性关系。
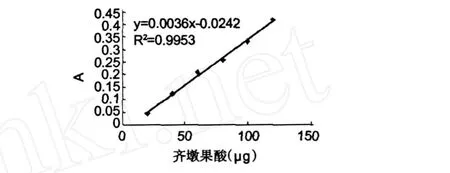
图 1 三萜类化合物的标准曲线Fig.1 Standard curve of the triterpenoids
2.4 重量法、直接光度法和 TLC-光度法测定樟芝总三萜的比较
分别采用重量法、直接光度法和 TLC-光度法对樟芝菌粉中的三萜类化合物的含量进行测定,结果见表 2。三种方法测得的总三萜含量为 TLC-光度法<直接光度法 <重量法。另外,本实验在樟芝菌粉三萜提取液中加入 2 g玉米油用来考察脂肪对于三萜含量测定的影响。由于玉米油可以溶于氯仿,所以采用重量法测定樟芝总三萜 +玉米油中总三萜含量时,玉米油使得三萜含量明显偏高。另外,玉米油在香草醛-冰醋酸体系中对于三萜含量的测定也具有干扰作用。本研究中的樟芝菌粉中本身含有4.69%的粗脂肪,因此樟芝中脂肪类物质对于樟芝菌粉中三萜含量测定具有不可忽视的干扰作用[8〗,而应当在测定前将及其它可能对总三萜含量测定造成干扰的物质分离除去。由此可知,T LC-光度法在直接光度法的基础上能进一步排除脂肪、色素等干扰。

表 2 不同方法测定总三萜含量的比较Table 2 Comparison of different methods for deter mining total triterpenoids
2.5 TLC-光度法的评价
2.5.1 测定方法的稳定性
从图 2可见,30 min内吸光度稳定,所以测定应该在显色后 30 min内测定。

图 2 显色反应的稳定性Fig.2 Stability of reaction
2.5.2 测定方法的精密度
从表 2可见,连续测定 5次,其 RSD=3.64%,表明该法具有较好的精密度。

表 2 测定方法的精密度Table 2 Accuracy ofmeasurement
2.5.3 加样回收率
从表 3可见,加样回收率为 99.70%,RSD= 2.78%,表明加样回收可以满足要求。
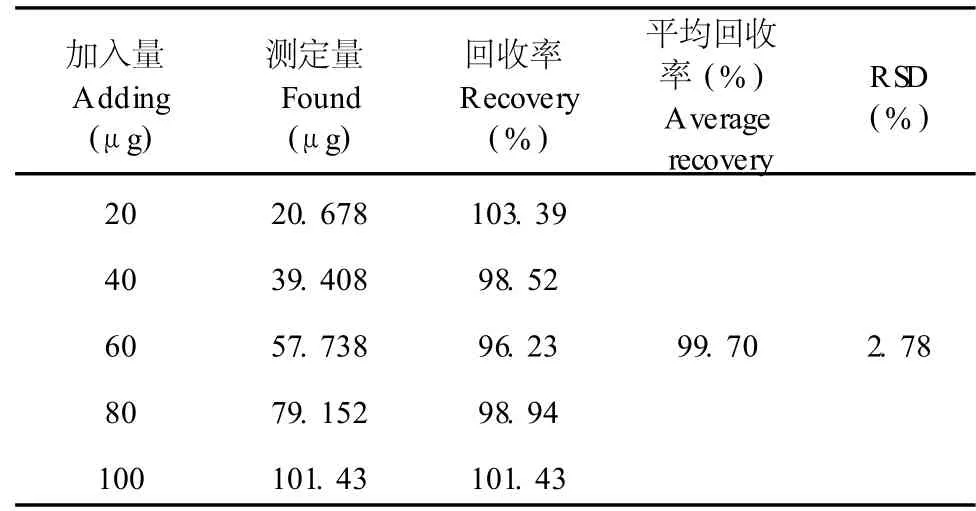
表 3 齐敦果酸的回收率Table 3 Recovery ofmeasurement
3 结论
樟芝菌粉三萜提取物中含有脂肪、色素等物质,这些物质对于香草醛-高氯酸体系测定三萜含量具有明显的正偏差作用,以至于在进行菌种生产能力鉴定和分析樟芝产品时产生误差。采用薄层色谱分离,分光光度法测定樟芝菌粉中的总三萜含量,可以去除提取物中脂肪、色素等物质对于测定的干扰,从而能够获得较为准确的三萜含量结果。同时该方法具有简单,操作方便,灵敏度高的特点。该法可用于樟芝原料及相关产品的质量分析。
1 Wu SH,Ryvaredn L,Chang TT.Antrodia camphorata(“niuchang-chih”),new combination of amedicinal fungus in Taiwan.BotBull Acad Sin,1997,38:273-275.
2 LuMK,ChengJJ,LaiWL,et al.Adenosine as an active component ofAntrodia cinnamom eathat prevents rat PC12 cells from serum deprivation-induced apoptosis through the activation of adenosine A2A receptors.L ife Sci,2006,79:252-258.
3 Cheng JJ,Yang CJ,Cheng CH,et al.Characterization and functional study ofAntrodia cam phoratalipopolysaccharide.J Agric Food Chem,2005,53:469-474.
4 Lu Z M,Ao ZH,Zou XL,et al.Protective effects ofmycelia ofAntrodia cam phorataandA r m illariellatabescensin submerged culture against ethanol-induced hepatic toxicity in rats.J Ethnophar m,2007,110:160-164.
5 Song TY,Yen GC.Antioxidant properties ofAntrodia camphoratain submerged culture.J Agric Food Chem,2002,50: 3322-3327.
6 Song TY,Yen GC.Protective effectsof fer mented filtrate fromAntrodia cam phoratain submerged culture against CCl4-induced hepatic toxicity in rats.J Agric Food Chem,2003,51: 1571-1577.
7 Lu Z M(陆震鸣),Tao WY(陶文沂),Xu HY(许泓瑜),et al.樟芝菌粉三萜类化合物含量的测定.Chin Tradit Pat M ed(中成药),2008,30:402-405.
8 WangJH(王江海),Yuan JP(袁建平),Xu SP(徐世平),et al.薄层色谱-光度法测定灵芝孢子油中的总三萜含量.J Chin Instit Food Sci Tech(中国食品学报),2004,4(3): 76-79.
9 Chen JC,Lin WH,Chen CN,et al.Development ofAntrodia cam phoratamycelium with submerge culture.Fung Sci, 2001,16:7-22.
10 Chang HL,Chao GR,Chen CC,et al.Non-volatile taste components ofAgaricusblazei,AntrodiacamphorataandCordyceps m ilitarismycelia.Food Chem,2001,74:203-207.
Determ ination of Total Triterpenoids inAntrodia cam phoratain Submerged Culture by TLC-spectrophotometryM ethod
ZHANG Yin1,XU Hong-yu1,LU Zhen-ming2,ZHANG Xiao-mei1,DOU Wen-fang1,XU Zheng-hong1,2*
1Laboratory of Pha rm aceutical Engineering,School of M edicine and Pha rm aceutics,Jiangnan University;2The Key Laboratory of Industrial B iotechnology,M inistry of Education,W uxi 214122,China
A method of thin layer chromatography(TLC)-spectrophotometry analysis of total triterpenoids inAntrodia cam phoratain submerged culturewas investigated in thispaper.The results showed that the spectrophotometry combined with the TLC waswell suitable to accurately deter minate the contentof total triterpenoids inAntrodia cam phoratain submerged culture.The accuracyof thismethodwas better than thatof the direct spectrophotometry.The recovery of the procedure was 99.70%and RSD of 2.78%(n=5).
Antrodia cam phorata;submerged culture;triterpenoids;TLC;spectrophotometry
Q946.91;R284.1;TS202.3
A
1001-6880(2010)04-0639-04
2008-12-04 接受日期:2009-03-16
教育部新世纪人才支持计划(NCET-07-0380);国家“863”重点项目(2007AA021506)
*通讯作者 Tel:86-510-85918206;E-mail:zhenghxu@jiangnan.edu.cn
