维持性血液透析患者成纤维细胞生长因子23与心血管病变的临床研究
2010-09-14邢昌赢徐道亮魏丛军刘昌华
陈 蕊,邢昌赢,徐道亮,魏丛军,刘昌华,李 冰,陈 勇
(1.南京医科大学,江苏南京,210009;2.南京医科大学附属第一医院肾内科,江苏南京,210029;3.扬州大学第一临床医学院,江苏扬州,225009)
随着血液净化技术的不断发展,维持性血透(MHD)患者的生存率有了显著提高。然而,心血管疾病仍然威胁着透析患者,是终末期肾病(ESRD)患者的主要死亡原因之一[1]。约有1/2的患者死于心血管病。慢性肾脏病随着疾病的进展往往会出现钙磷代谢紊乱,并进一步导致肾性骨营养不良、心血管动脉硬化、钙化、心血管事件的发生。新近研究发现一种成纤维细胞生长因子23(FGF-23)也参与了血磷的调节过程,并且与维生素D3的调节有密切关系。本研究通过分析MHD患者FGF-23与血磷、血钙、全段甲状旁腺激素(iPTH)的相关性及其与颈部血管超声、超声心动图等相关指标的关系,探讨FGF23在维持性血透患者心血管病变发生发展中的作用。
1 对象与方法
1.1 研究对象
2008~2009年本院维持性血透患者50例,其中男26例,女 24例;年龄32~78岁,平均(56.22±11.81)岁。每周透析均为2~3次,每次 4~5 h。透析龄 1.2~180个月,平均(26.82±34.56)个月,中位透析龄23个月。透析膜均为聚砜膜,透析液为碳酸氢盐,血流量200~300mL/min,透析液流量500 mL/min。所有患者均无合并恶性肿瘤,无风湿活动、肝硬化等严重疾病,近期内无急性感染、手术、创伤史,无急性心衰竭等病史。
心血管病变定义[2]:根据心电图、心肌酶谱、冠脉造影、支架术或冠脉搭桥术后所证实的心绞痛级心肌梗死;根据神经系统表现或脑CT变化所证实的短暂性脑缺血发作、脑梗死或脑出血;根据肢端疼痛坏疽、间歇性跛行或四肢动脉多普勒超声所证实的周围血管病变;颈动脉超声检测有斑块形成;根据临床表现、肺部体征、胸部X线片或心脏彩超(EF<35%)所证实的充血性心衰。
经询问病史,检测心电图、胸部X线片等各项检查,结合临床心血管疾病标准分为合并心血管病变组和未合并心血管病变组。根据颈部血管超声检查结果分为钙化斑块组和无钙化斑块组。
另选取年龄性别与病例组相匹配的20人为对照组。经简化MDRD公式计算,肾小球滤过率为(89.0±9.7)mL/(min·1.73 m2),排除严重感染、肝功能损害、甲状旁腺疾病、恶性肿瘤、服用维生素D及相关制剂、骨折及高血压者。
1.2 方法
1.2.1 一般指标测定:所有患者入选后,记录5次透析前后体重、血压及超滤量,取其平均值,计算体重指数(BMI)、平均动脉压(MAP)。
1.2.2 生化指标测定:清晨空腹采血,受试者于血液透析前空腹抽取静脉血5 mL测定血白蛋白(ALB)、肌酐(Cr)、尿素氮(Bun)、钙(Ca)、磷(P)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)、C-反应蛋白(CRP),采用日本自动生化分析仪Olympus AU2700测定。同时查血红蛋白(HGB),血清iPTH采用BECKMAN COULTER Unicel Dx2800全自动免疫分析仪测定。
1.2.3 FGF-23及1,25-(OH)2VitD检测:FGF-23及1,25-(OH)2VitD均采用酶联免疫吸附双抗体夹心方法测定,试剂盒购自武汉中美科技公司,严格按照说明书操作(本实验在江苏省人民医院肾内科实验室完成)。
1.2.4 颈部血管检查:使用美国GE-V2VI3型彩色多普勒超声仪测量颈动脉内膜中层厚度(IMT),均由超声室同一名医生完成。将与血管外膜相比强回声并伴有声影的斑块定义为钙化斑块。根据检查结果分为钙化斑块组和无钙化斑块组。
1.2.5 心室肥厚及心脏射血等相关指标的检测:采用美国GE-V2VI3型彩色多普勒超声仪,由专职超声医师做单盲检测,检测指标包括:左室舒张末内径(LVDd),左室收缩末内径(LVDs),左室后壁厚度(LVPWT),室间隔厚度(IVST),左房内径(LAD),射血分数(LVEF)。
2 结 果
2.1 两组资料比较
MHD患者组与对照组在年龄、性别、BMI等方面比较,差异无统计学意义。血清FGF-23、肌酐、磷和iPTH均显著高于正常对照组(P均<0.01);1,25-(OH)2VitD水平、血清钙浓度均明显低于正常对照组(P<0.05),见表1。相关性分析显示,血清FGF-23与血清肌酐、磷、iPTH呈显著正相关(r=0.701、0.400、0.366,P均<0.01),与1,25-(OH)2VitD呈显著负相关(r=-0.835,P<0.01),与血清钙无关(r=-0.120,P>0.05)。
2.2 心血管病变组与未合并心血管病变组比较
心血管病变组血清FGF-23显著高于未合并心血管病变组(P<0.01)。见表2。

表1 MHD组和正常对照组FGF-23及相关因子比较
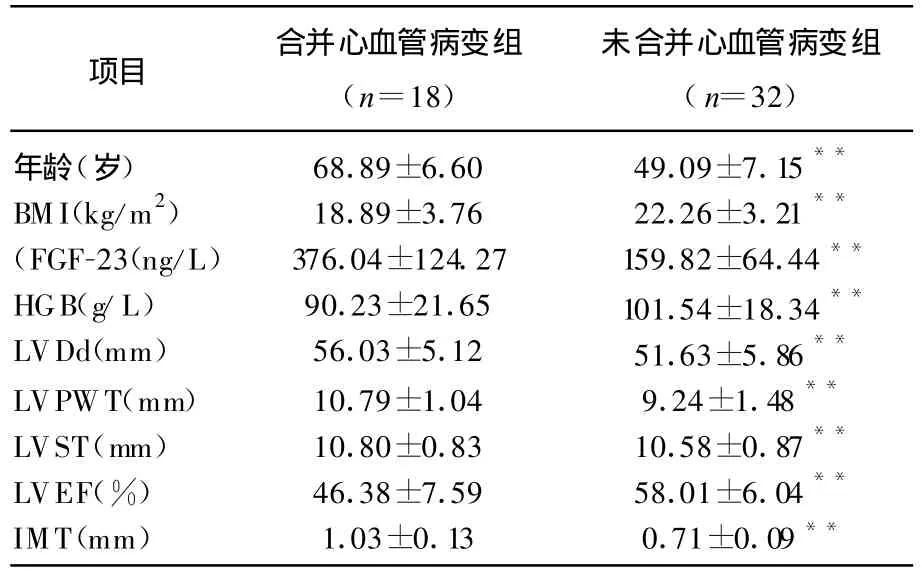
表2 心血管病变组与非心血管病变组比较
2.3 MHD患者颈动脉有无钙化斑块两组间比较
50例患者中有颈动脉钙化斑块10例,无钙化斑块40例,钙化发生率 20%。钙化斑块组FGF23(431.21±137.91 ng/L)较无钙化斑块组FGF23(189.27±86.29 ng/L)明显升高,差异有统计学意义(P<0.01)。
2.4 FGF23与颈部血管超声指标IMT相关分析
相关分析显示,MHD患者的血清FGF-23水平与颈总动脉IMT呈正相关(r=0.859,P<0.01)。见图1。

图1 MHD患者FGF-23与IMT呈正相关
IMT与各变量的多元逐步回归以IMT为因变量,自变量选择:TG 、FGF-23、年龄、HGB、BMI、CRP 、ALB 、TC 、HDL-C 、LDL-C 、SBP 、DBP 、MAP进行多元逐步回归分析。结果显示IMT与TG、FGF-23、年龄呈正相关,差异有统计学意义(β =0.532,0.189,0.300,P 均 <0.01),与HGB 、BMI、CRP 、ALB 、TC 、HDL-C 、LDL-C 、SBP 、DBP、MAP无关(P均>0.05)。提示FGF-23可能参与了MHD患者动脉粥样硬化的发生发展。
3 讨 论
成纤维细胞生长因子23(FGF-23)是近年新发现的一种参与血磷代谢的细胞因子,属于FGF-19亚家族,人类的 FGF-23基因定位于染色体12p13区。它来源于骨组织,在正常人和有残余肾功能的终末期肾病患者的尿液中有免疫原性的FGF-23的C肽片段,因此它可能通过肾脏清除。其基本生理功能为抑制肾小管对磷的重吸收,抑制肾脏1-a羟化酶的活性,抑制1,25-(OH)2VitD的合成,减少肠道磷的吸收,从而降低血磷[3]。CKD患者体内血FGF-23的水平随着肾功能减退而逐渐增高。大多数透析患者FGF-23远远高于正常水平,血液透析并不能清除FGF-23。仍不清楚其增高的临床意义。本组资料结果表明血透患者与对照组在年龄、性别、BMI构成均衡比的情况下,血透患者FGF-23水平显著性地高于对照组,同时伴有高磷血症、低活性VITD3等。
本研究发现MHD患者发生心血管事件者FGF-23水平、LVDd、LVPWT、LVEF明显高于未发生心血管事件者,提示FGF-23是尿毒症患者发生心血管事件的危险因素。其机制可能与钙磷代谢紊乱、继发性甲旁亢、动脉粥样硬化等有关。
维持性血液透析(MHD)患者磷的潴留更加明显,此时增高的FGF-23并不能进一步增加尿磷的清除,尿磷清除极度减低,血磷增高,刺激FGF-23明显升高。升高的FGF-23可以进一步使1,25-(OH)2VitD的生成减少,FGF-23本身也会促进CKD患者甲状旁腺细胞的生长,导致继发性甲状旁腺功能亢进症(secondary hyperparathyroidism,SHPT)[4]。本研究结果显示,MHD患者FGF-23、血磷和iPTH水平均显著高于正常对照组,且FGF-23和血磷、iPTH均呈正相关,与1,25-(OH)2VitD呈显著负相关。高磷血症和钙磷乘积的升高是CKD患者并发异位钙化和心血管疾病的重要危险因素。目前已有资料提示钙磷乘积增加导致冠状动脉、心瓣膜和心肌组织的钙化,可能引起心血管组织的结构和功能异常[5]。Ganesh[6]研究发现血磷水平、钙磷乘积与因CVD致死(包括猝死)正相关,血磷>6.5 mg/dl是其中一项独立危险因素。FGF-23升高反映患者长期处于高磷负荷下,而钙磷代谢紊乱便是尿毒症高死亡率的新危险因子[7]。Gutierrez等[8]发现在早期慢性肾脏病患者中血清钙磷浓度还没有出现异常时FGF-23就有升高,进一步说明FGF-23水平升高在继发性甲状旁腺功能亢进早期发病机制起到核心作用。近有研究报告[9],在临床上发现SHPT患者的PTH增高,左心室肥厚(LVH)发生率也增多,左室舒张功能减退。London等报告:尿毒症血透患者 LVH与PTH正相关。PTH通过一系列复杂的机制,影响心脏的结构与功能,尤其引起左室肥厚与心肌纤维化,从而影响心脏的舒张以及收缩功能。FGF-23是新发现的死亡危险标志物[10]。Kobayashi[11-12]等研究发现继发性甲旁亢的尿毒症患者FGF23和血钙密切相关。而本研究结果显示,MHD患者FGF-23与血清钙无关,可能与所选人群不一样有关。
近年研究显示,动脉粥样硬化(AS)斑块的形成是由于内皮损伤后,单核细胞和平滑肌细胞大量增生,迁入内皮下间隙,摄取氧化的LDL(ox-LDL)等脂质,转化为泡沫细胞所致。颈动脉多普勒超声反映的粥样硬化可提示其他部位血管甚至冠状动脉分支的粥样硬化病变严重程度,而IMT是观察亚临床型AS较为简便的指标。本实验通过横断面研究,前瞻性分析了50例MHD患者的血清FGF-23水平与颈动脉超声相关指标间的关系,结果显示有颈动脉斑块的患者血清FGF-23水平较无斑块明显增高,差异有统计学意义。多元回归分析显示FGF23是颈总动脉IMT的独立危险因素。提示FGF-23可能参与MHD患者AS的发生发展。FGF-23对心血管病变的影响与动脉粥样硬化、血管钙化有密切关系,一方面FGF-23通过作用于下游Egr-1(early growth response)因子,参与促进动脉粥样硬化的发生[13];另一方面FGF-23能调节肾脏近曲小管Ⅱ型钠磷共同转运体的表达,推测它可能对广泛分布的Ⅲ型钠磷共同转运体也有影响,进而促使血管钙化,特别是用来解释为何在没有出现高磷血症之前,慢性肾脏病患者出现的血管钙化[14]。而那些非透析阶段FGF-23就明显升高的患者中,不论是c端还是全段FGF-23都是独立于血清磷等已知危险因子之外的死亡预测因子[15],其原因便可能与血管钙化相关,而血管钙化是动脉粥样硬化的病理生理基础,而血管钙化越严重的维持性血液透析患者其1年生存率越低[16]。心血管系统的普遍钙化是造成维持性透析患者心血管疾病(CVD)高发生率和患CVD后高死亡率的重要因素之一。
有关FGF-23在预测心血管病变中的作用的研究较少见。通过本研究发现,FGF-23与尿毒症患者心血管病变有着密切的联系。因此,检测FGF-23对监控尿毒症心血管病的发生、发展、进行早期干预有着重要的意义。已有资料表明升高的FGF-23可能对CKD患者的转移性钙化起到一个保护机制,但是由于它对血磷调节的特殊机制,FGF-23对血管的钙化的防御机制是不是独立于钙磷之外还不清楚。
[1]Parekh RS,Carroll CE,Wolfe RA,et al.Cardiovarscular death in children and young adults with end-stage kidney disease[J].J Pediatr,2002,141:191.
[2]Samak MJ,Levey AS,Schoolwenh AC,et al.Kidney disease as a risk factor for development of cardiovascular disease:A statement fiom the American Heart Association Councils on kidney in cardiovascular disease,high blood pressure research,cnnical cardiology,and epidemiology and prevention[J].Hypertension,2003,42:1050.
[3]Kenneth B,Jonsson.The ro1e of fibroblast growth factor 23 in renal disease[J].Nephrol Dialys T ransplant,2005,20:479.
[4]Fukagawa M,Kazama JJ.FGF23:its role in renal bone disease[J].Pediatr Nephrol,2006,21:1802.
[5]Capomolla S,Febo O.Gnemmi M.et al.Beta-blockade therapy in chronic heart failure:diastolic function and mitral regurgitation improvement by carvedilol[J].Am Heart J,2000,139(4):596.
[6]Ganesh SK,Stack AG,Levin NW,et al.Association of elevated serum PO(4)。Cax PO(4)product。And parathyroid hormone with cardiac mortality risk in chronic hemodialysis patients[J].J Am Soc Nephrol,2001,12:2131.
[7]Block GA,Klassen PS,Lazarus JM,et al.Mineral metabolism,and morbidity in maintenance hemodialysis[J].J Am Soc Nephrol,2004,15:2208.
[8]Gutierrez O,lsakova T,Rhee E,et al.Fibroblast growth factor 23 mitigates hyperphosphatemia but accentuates calcitriol deficiency in Chronic kidney disease[J].J Am Soc Nephrol,2005,16:2205.
[9]Stephen G,Rostand Tilman B.Drueke parathyroid hormone,Vitamin D,and cardiovascular disease in CRF[J].Kidney Int,1999,56:383.
[10]Go AS,Chertow GM,Fan D,et al.Chronic kidney disease and the risks of death,cardiovascular events,and hospitalization[J].N Engl J M ed,2004,351:1296.
[11]Kobayashi K,Imanishi Y,Miyauchi A,et al.Regulation of plasma fibroblast growth factor 23 by calcium in primary hyperparathyroidism[J].Eur J Endocrinol,2006,154:93.
[12]Imanishi Y,Inaba M,Nakatsuka K,et al.FGF-23 inpatients with end-stage renal disease on hemodialysis[J].Kidney Int,2004,65:1943.
[13]Khachigian LM.Early growth response-1 in cardiovascular pathobiology[J].Circ Res,2006,98:186.
[14]Mehrotra RJ.Disordered mineral metabolism and vascular calcification in nondialyzed chronic kidney disease patients[J].Ren Nutr,2006,16:100.
[15]Gutierrez OM,Mannstadt M,Isakova T,et al.Fibroblast growth factor-23 and mortality among patients undergoing hemodialysis[J].N Engl J Med,2008,359:584.
[16]Jean G,Bresson E,Terrat JC,et al.Peripheral vascular calcification in long-haemodialysis patients:associated factors and survival consequences[J].Nephrol Dial Transplant,2009,24:948.
