有氧训练对阿尔茨海默病模型大鼠海马区细胞凋亡的影响
2010-09-14金华锋史兆春
金华锋,万 琪,吴 婷,史兆春
(南京医科大学第一附属医院神经内科,江苏南京,210029)
阿尔茨海默病(Alzheimer′s disease,AD)是一种以进行性认知功能障碍为特征的神经系统退行性疾病。研究发现,AD脑海马新生神经元的存活率显著降低,新生神经元的突起生长异常[1-2]。这表明,AD脑的神经再生过程受到严重损害,提示神经再生障碍可能是AD认知功能进行性减退的重要病理机制之一[3]。关于有氧训练引起AD大鼠认知功能改善进而影响海马细胞存活的情况,国内尚未见报道。为此,本研究通过观察运动训练后AD大鼠学习记忆能力和海马细胞存活的改变,初步探讨AD后有氧训练对海马神经元功能的影响。
1 材料与方法
1.1 材料
清洁级健康雄性SD大鼠(24月龄)24只,体重450±20 g,由中国人民解放军军事科学院实验动物中心提供(合格证号:SCXK-(军)-2008-004)。Aβ25-35、DAB 和 Triton X-100购自美国Sigma公司;Hoechst 33342购自美国Vector Laboratories。其他试剂均为分析纯,购自南京化学试剂公司。
1.2 方法
1.2.1 动物分组:迷宫筛选非先天愚型SD大鼠24只。随机分为假手术组(侧脑室注射生理盐水,n=8)、实验组(侧脑室注射Aβ25-35,n=8)、有氧训练组(侧脑室注射Aβ25-35+四周有氧训练,n=8)。
1.2.2 老年痴呆大鼠模型制备:大鼠10%水合氯醛(0.4 mL/100 g)腹腔注射进行麻醉,麻醉成功后将大鼠固定在立体定位仪(STOELTING)上,门齿固定插设在正中处,头正中部去毛后皮肤消毒,头顶正中切口,逐层切开皮肤、肌肉,于脑矢状缝中部开口暴露颅盖骨,参照Paxinos和Watson大鼠脑立体定位图谱,于前囟后1.0 mm,向右旁开1.5 mm,硬脑膜下3.0 mm向双侧侧脑室区缓慢注入 5 μ L(2 μ g/μ L,用无菌生理盐水溶解Aβ25-35肽段完之后分装,-20℃保存,用的时候取出一管37℃孵育7天),每侧注射时间5 min,留针2 min,缓慢退针。所有操作均在无菌条件下进行,皮肤切开处用青霉素抗菌,缝合伤口。
1.2.3 有氧训练:Aβ25-35注射后第三天(此时Aβ的毒性最强)行有氧训练,采用无负重游泳,从实验日起进行游泳训练,每次运动时间从最初的10 min/日,每天递增10 min,直至达到60 min/日,并持续此量,共训练四周。水温30±1℃,游泳训练池为180 cm×60 cm×80 cm,内壁光滑。
根据啮齿类动物的生活习惯,所有运动训练在晚上6点之后进行。
1.2.4 行为学测试:有氧训练结束后各组大鼠行Morris水迷宫(上海吉量软件科技有限公司)检测。Morris水迷宫为一圆形水池,直径200 cm,高50 cm,水深30 cm,水温控制在22~24℃。池壁表明四个入水点,由此将水池分为4个象限,任选某一象限(本实验选择第四象限),正中放置一个直径11 cm、高29 cm的平台。每天约同一时间(每晚七点)将大鼠按四个象限入水点依次放入水池中,记录90 s内大鼠从入水到找到平台所用的时间,即逃避潜伏期(Escape Latency)。如90 s内未能找到,引导其上平台并停留10 s,本次成绩记做90 s。Morris水迷宫测试一天一次,共训练5 d,实验第6天撤去平台,记录大鼠穿越在原平台位置的时间即空间探索实验两个部分。取4个象限测试成绩的平均值为当日的学习成绩。
1.2.5 Hoechst染色:细胞发生凋亡时,染色质会固缩,荧光染料Hoechst 33342能少许进入正常细胞膜,使其染上低蓝色,而凋亡细胞的膜通透性增强,因此进入凋亡细胞中的Hoechst 33342比正常细胞的多,荧光强度要比正常细胞中要高,在荧光显微镜下观察,正常细胞的细胞核呈正常的蓝色,而凋亡细胞的细胞核会呈致密浓染,或呈碎块状致密浓染,颜色有些发白。大鼠取脑、多聚甲醛固定方法同前。次日取出固定后的鼠脑,沿大脑纵裂切开成左右两半并修饰脑片,行梯度酒精脱水、二甲苯透明、浸蜡、石蜡包埋,做海马连续冠状石蜡切片(片厚4 μ m),每个动物连续切片计数5张取一张,取6张。将石蜡切片放入37℃烘箱过夜后,脱蜡水化,用PBS漂洗5 min,共洗3次后,吸尽液体。加入0.5 mL Hoechst 33342染色液,染色5 min。用PBS洗两遍,每次3 min。将切片置于载玻片上,滴一滴抗淬灭封片液,盖上一洁净的盖玻片,尽量避免气泡。荧光显微镜可检测到呈蓝色的细胞核。最大激发波长为350 nm,最大发射波长为460 nm。Hoechst+细胞的计数,按照单盲原则,计数前对所有免疫组化染色的脑片进行随机编码。在40×物镜下,观察每张脑片海马亚颗粒细胞层(SGZ)及颗粒细胞层(GCL)内的Hoechst+细胞数,算出每张脑片SGZ和GCL区Hoechst+细胞数的平均值;用software Image J(NIH)测出每张脑片SGZ的长度,求得每张脑片SGZ的单位长度的Hoechst+细胞数。
2 结 果
2.1 各组大鼠Morris水迷宫测试结果比较
与假手术组比较,实验组的逃避潜伏期显著延长(P<0.05)。有氧训练组与实验组相比,逃避潜伏期明显缩短(P<0.05);有氧训练组与正常对照组相比,差异无统计学意义(P>0.05),见表1。
表1 各组水迷宫测试结果比较( ±s)

表1 各组水迷宫测试结果比较( ±s)
注:与假手术组比较,P<0.05;与实验组比较,*P<0.05
组别 n 逃避潜伏期(S)假手术组 8 18.1±5.9实验组 8 25.5±18.4有氧训练组 8 15.5±5.3*
2.2 各组大鼠海马亚颗粒细胞层内的Hoechst+细胞数比较
与假手术组比较,实验组大鼠海马区内的Hoechst+细胞呈碎块状致密浓染,颜色有些发白,Hoechst+细胞数明显增多(P<0.05);有氧训练组大鼠亚颗粒细胞层及颗粒细胞层内的Hoechst+细胞呈致密浓染,阳性细胞数比实验组明显减少(P<0.05)。假手术组与有氧训练组大鼠海马区内的Hoechst+细胞数差异无统计学意义(P>0.05),见表2、图1、图2。
表2 各组大鼠海马区的Hoechst+细胞数比较( ±s)

表2 各组大鼠海马区的Hoechst+细胞数比较( ±s)
注:与假手术组比较,P<0.05;与实验组比较,*P<0.05
组别 n 阳性细胞数(个/高倍视野)假手术组 8 5±1.7实验组 8 15±3.9有氧训练组 8 7.4±2.2*

图1 各组大鼠海马脑区内的Hoechst染色比较
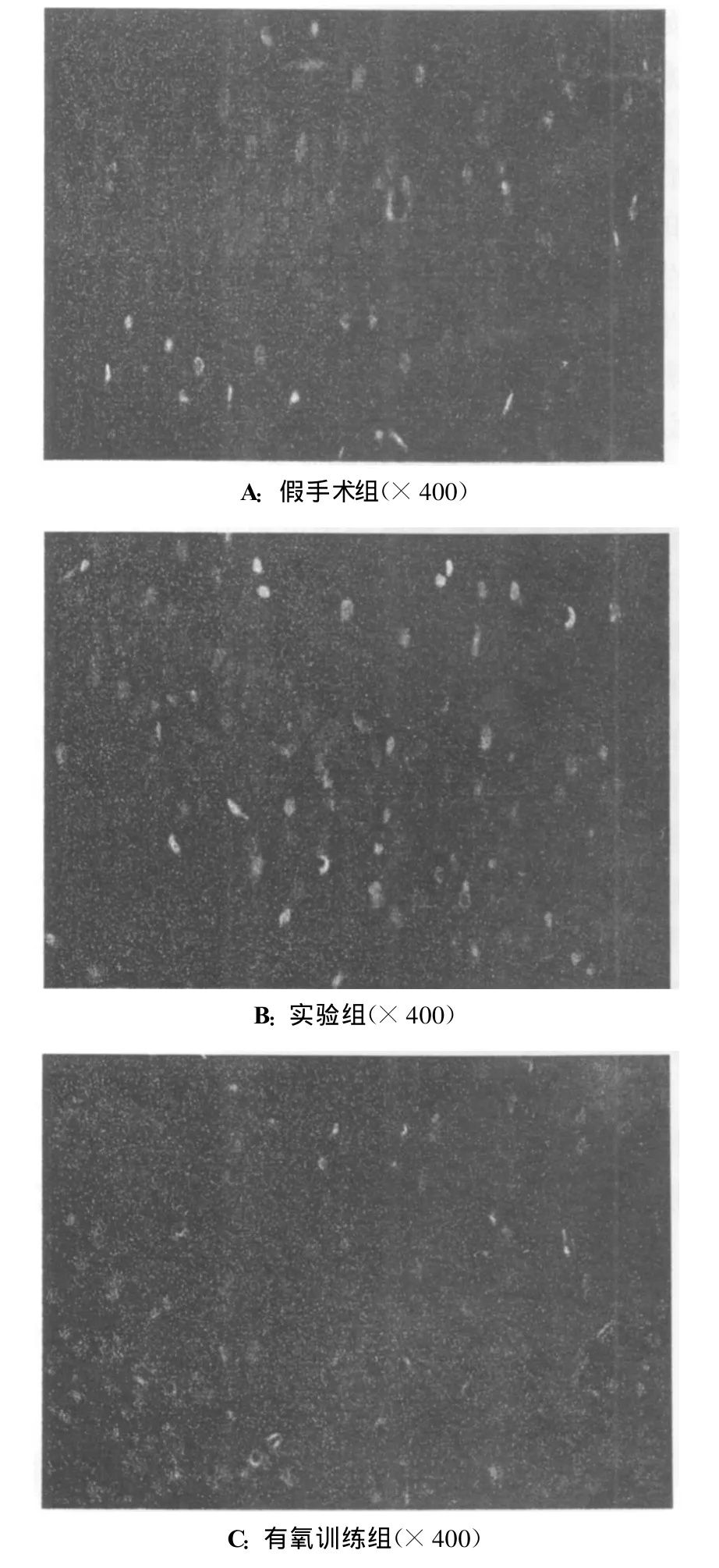
图2 各组大鼠海马脑区内的Hoechst染色比较
3 讨 论
AD是一种以获得性持续性记忆减退、认知功能障碍以及行为异常为特征的中枢神经系统退行性疾病。大量实验验证,Morris水迷宫作为检测实验动物学习记忆水平的重要工具,可以较好的评价认知功能。本实验Morris水迷宫测试结果显示实验组较假手术组逃避潜伏期明显延长,撤离平台后在原平台象限内游泳的时间占整个游泳时间百分比显著降低,表明实验组大鼠学习记忆能力明显下降。有氧训练组大鼠测试结果明显好于实验组,而与正常对照组比较差异无统计学意义。表明有氧训练可以显著改善AD大鼠的认知功能,对AD大鼠空间认知功能损伤具有保护作用。研究发现,AD脑海马干细胞增殖有增加的趋势,前体细胞的神经元分化比例明显减少,新生神经元的存活率显著降低,新生神经元的突起生长异常。这些研究证实,AD脑的神经再生过程受到严重损害,提示神经再生障碍可能是AD认识功能进行性减退的重要病理机制之一。
AD基本的神经病理学改变为:神经元外形成大量的老年斑、神经元内出现神经原纤维缠结、区域性的神经元及突触丢失。目前研究认为β淀粉样蛋白(β-amyloid protein,Aβ)沉积是AD发病的中心环节,Aβ的神经毒性作用是导致AD发病的重要病因之一。Aβ是由淀粉样前体蛋白剪切而来,Aβ25-35是具有Aβ神经毒作用的最短片段。侧脑室注射Aβ25-35能引起神经元变性、突触丢失、学习记忆能力受损等神经系统退化的表现,因此,Aβ25-35侧脑室注射建立的AD模型与APP或APP/PS1转基因鼠被广泛地应用于AD的研究[4-5]。
大量实验证据已表明,高浓度的Aβ寡居体具有神经毒性,导致神经细胞的凋亡[6]。为本实验结果显示Aβ(25-35)短片段损害海马区神经细胞的存活。与假手术组相比,实验组大鼠Hoechst阳性细胞增多,而经过有氧训练后大鼠海马各区域神经元细胞凋亡明显减少,这表明,Aβ损害细胞存活,有氧训练能阻止Aβ损害细胞存活。这一结果对于探求有氧运动改善AD认知功能障碍的病理生理机制,具有重要意义,同时在临床上也有一定的应用价值[7-8]。但本研究只是初步探讨有氧运动与海马神经元细胞凋亡的关系,至于有氧运动影响海马神经元的细胞凋亡的机制及其相关的调控因子还有待于进一步的研究。
[1]Peng Y,Sun J,Hon S,et al.Nylander AN.L-3-n-butylphthalide improves cognitive impairment and reduces amyloid-beta in a transgenic model of Alzheimer's disease[J].J Neurosci,2010,30(24):8180.
[2]Pan YF,Chen XR,Wu MN,et al.Arginine vasopressin prevents against Abeta(25-35)-induced impairment of spatial learning and memory in rats[J].Horm Behav,2010,57(4-5):440.
[3]Charalampopoulos I,Remboutsika E,Margioris AN,et al.Neurosteroids as modulators of neurogenesis and neuronal survival[J].T rends Endocrinol Metab,2008,19(8):300.
[4]Serneels L,Van Biervliet J,Craessaerts K,et al.Gamma-Secretase heterogeneity in the Aph1 subunit:relevance for Alzheimer's disease[J].Science,2009,324(5927):639.
[5]Biscaro B,Lindvall O,Hock C,et al.Abeta immunotherapy protects morphology and survival of adult-born neurons in doubly transgenic APP/PS1 mice[J].J Neurosci,2009,29(45):14108.
[6]Peng Y,Sun J,Hon S,et al.L-3-n-butylphthalide improves cognitive impairment and reduces amyloid-beta in a transgenic model of Alzheimer's disease[J].J Neurosci,2010,30(24):8180.
[7]Geda YE,Roberts RO,Knopman DS,et al.Physical exercise,aging,and mild cognitive impairment:a population-based study[J].Arch Neurol,2010,67(1):80.
[8]Etgen T,Sander D,Huntgeburth U,et al.Physical activity and incident cognitive impairment in elderly persons:the INVADE study[J].Arch Intern Med,2010,170(2):186.
