手性配体喹尼叮衍生物的合成及在Baylis-Hillman反应中的应用
2010-09-14杨桂秋刘春成崔广坚于秀兰仇兴华
杨桂秋, 刘春成, 崔广坚, 于秀兰, 仇兴华
(1.沈阳化工大学化学工程学院,辽宁沈阳 110142; 2.沈阳科创化学品有限公司,辽宁沈阳 110021)
手性配体喹尼叮衍生物的合成及在Baylis-Hillman反应中的应用
杨桂秋1, 刘春成2, 崔广坚2, 于秀兰1, 仇兴华1
(1.沈阳化工大学化学工程学院,辽宁沈阳 110142; 2.沈阳科创化学品有限公司,辽宁沈阳 110021)
以廉价的喹尼叮硫酸盐为原料,经中和制取喹尼叮,再经进一步反应制备具有较好不对称诱导效果的催化剂 (3R,8R,9S)-10,11-二氢-3,9-环氧-6’羟基-脱氧辛可宁 (简称 QD-4),经1H-NMR、I R确定结构正确.应用制备的手性催化剂QD-4催化不对称 Baylis-Hillman反应,获得了具有左旋的 1,1,1,3,3,3-六氟异丙基 (R)-3-羟基-3-(对硝基苯基)-2-丙烯酸酯.
喹尼叮硫酸盐; 手性催化剂QD-4; Baylis-Hil lman反应
碳-碳键的形成及化合物不同官能团间的相互转化一直是构建新分子骨架的一类最基础反应之一,也是有机化学合成领域中研究的前沿课题之一.最近,Baylis-Hillman反应因具有原子经济性和生成多官能团产物的特点重新引起人们的注意,各国化学家对该反应进行深入研究,尤其针对该反应的缺点进行广泛研究,也逐步取得了一些令人满意的结果.国内该反应只有少数科研机构进行了研究,其中中科院上海有机化学研究所、南开大学元素有机化学国家重点实验室对该反应都作了研究,取得了一定进展[1-4].
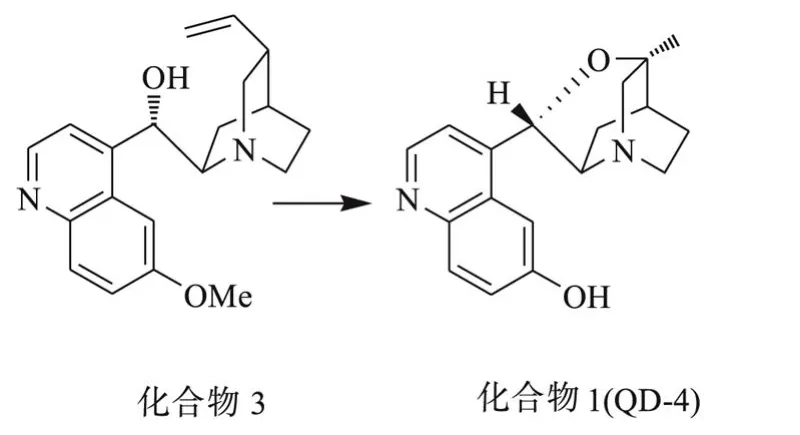
不对称Baylis-Hillman反应是一个具有极大挑战性的热门课题[5].1998年,由 Barret[6]等人报道了用催化量的含氮手性配体在常压下催化的不对称 Baylis-Hillman反应;1999年, Iwabuchi[7]等人报道的用喹尼叮衍生物 (3R,8R,9S)-10,11-二氢-3,9-环氧-6’羟基-脱氧辛可宁 (简称QD-4)催化的醛与六氟代丙烯酸异丙酯的不对称合成反应,是用手性配体催化不对称 Baylis-Hillman反应的突破.有关不对称催化剂喹尼叮衍生物 (3R,8R,9S)-10,11-二氢-3,9-环氧-6’羟基-脱氧辛可宁的合成相关报道很少.本文以廉价的喹尼叮硫酸盐为原料合成 QD-4,其合成路线为:

用上述所得的手性催化剂 QD-4催化不对称 Baylis-Hillman反应.
1 实验部分
1.1 仪器和试剂
ZF-I型三用紫外分析仪,上海顾村电光仪器厂;Mercury 300(Varian)型核磁共振波谱分析仪,溶剂 CDCl3,内标 T MS;EA 1108(Fisons)型元素自动分析仪; Impact 400型红外吸收光谱仪, KBr压片;WZZ-1S自动数显旋光仪,上海光学仪器厂.柱层析硅胶为青岛海洋化工厂生产的 H60型,所用试剂均为分析纯.
1.2 喹尼叮(化合物 3)的合成
在三口瓶中加入 100.0 mL甲醇,将喹尼叮硫酸盐 (化合物 2,进口)20.0 mmol,15.7 g溶于甲醇中,在冰水浴冷却下缓慢滴入 50.0 mL(0.8 mol/L)KOH水溶液,有白色沉淀生成,滴加完毕后 pH值控制在 8到 9左右.混合物溶于200.0 mL氯仿中,水洗 2次 (150.0 mL×2),用100.0 mL饱和盐水洗 1次,将油层用无水硫酸镁干燥、过滤,减压蒸馏脱除溶剂,得 10.6 g白色固体产物喹尼叮(化合物 3),收率 82.0%.
1H-NMR(300 MHz,CDCl3)δ:8.466(s, 1H),7.909~7.867(t,1H),7.492~7.477(d,J=4.5 Hz,1H),7.275~7.227(m,1H),7.165 (s,1H),6.111~5.994(m,1H),5.579~5.568 (s,2H),5.067~5.012(t,1H),3.841(s,3H), 3.407~3.337(t,1H),3.007~2.720(m,5H), 2.226~2.197(m,1H),2.081~2.008(m,1H), 730(s,1H),1.493~1.400(m,2H),1.089(t, 1H,—OH).
IR(KBr)ν:3 440(s),3 070(s),2 920(s), 2 700(s),1 620(m),1 510(s),1 260(s),1 040 (m),860(m),820(m),720(w),640(w).
1.3 QD-4(化合物1)的合成
在 500 mL的三口瓶中加入 36.7 g(308.0 mmol)KBr,150.0 mL质量分数为 85%的H3PO4,室温搅拌,将 11.3 g(34.8 mmol)喹尼叮(化合物 3)慢慢加入,氮气保护下加热,使白色固体全溶,溶液透明,升温至 100℃反应 7 d.冰浴下冷却缓慢加入 600.0 mL质量百分数为25%的氢氧化钾水溶液 .再滴 27.0 mL质量分数为 25%~28%的氨水调节 pH值至 8~9之间,得白色悬浊物,用 1 400 mL的 CHCl3萃取,白色悬浊物溶解,静止过滤,再用盐水对油层进行萃取,将油层过滤,溶液由淡黄色变为粉红色,无水 K2CO3干燥,脱溶得 12 g红色固体,产品进行柱色谱分离 (V(CH3OH)/V(CHCl3)=1/20),得 3.8 g白色固体产物 (3R,8R,9S)-10,11-二氢-3,9-环氧-6’-羟基-脱氧辛可宁即 QD-4,收率为 41.2%.
1H-NMR(300 MHz,CDCl3)δ:8.733~8.718 (d,J=4.5 Hz,1H),8.128(s,1H),7.987~7.956 (d,J=9.3 Hz,1H),7.662~7.647(d,J= 4.5 Hz,1H),7.269~7.222(m,H),6.047(s, 1H),3.763~3.717(d,J=13.8 Hz,1H), 3.493~3.474(d,J=5.7 Hz,H),3.248~3.207 (t,1H),3.105(s,1H),2.827~2.781(d,J= 13.8 Hz,1H),2.224~2.209(d,J=4.5 Hz,H), 1.920~1.634(m,5H),1.284~1.217(q,2H), 1.077~1.027(t,3H).
IR(KBr)ν:3 360(s),2 980(s),1 610(s), 1 470(m),1 350(w),1 290(w),1 230(s), 1 200(m),1 010(m),900(m),860(s).
1.4 QD-4催化的不对称Baylis-Hil lman反应
将制得的喹尼啶衍生物 QD-4催化不对称Baylis-Hillman反应,其反应过程如下:
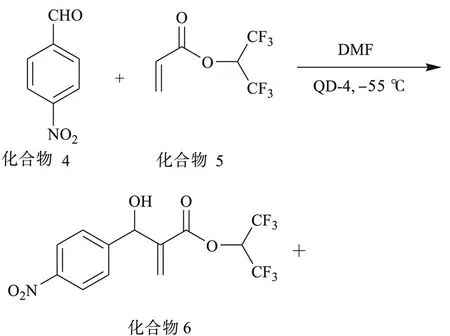

向 250 mL圆底烧瓶中分别加入 302.0 mg对硝基苯甲醛、62.0 mg QD-4和 4.0 mL DMF,在以液氮为冷却剂、氯仿为溶剂下,-55~-58℃时加入丙烯酸 1,1,1,3,3,3-六氟异丙酯,搅拌反应,反应进行1.5 h后,加入 0.1 mol/L HCl萃灭反应,加乙酸乙酯萃取,静止分层,水洗,将油层用无水硫酸镁干燥并过滤,减压蒸馏后得653 mg粗品,柱色谱分离 (V(乙酸乙酯)/V(石油醚)=1/20),得 201 mg黄色油状物质 1,1,1, 3,3,3-六氟异丙基 (R)-3-羟基-3-(对硝基苯基)-2-丙烯酸酯 (化合物 6),收率为27.0%,并未得到化合物 7.

在 25℃下,将 128 mg化合物 6溶于 13.0 mL的 CHCl3,装入长为 1 dm的旋光管中,以钠光为光源,在旋光仪上测得比旋光度为αD25= -54.6°,即化合物 6为左旋物质.
2 结果与讨论
2.1 酸的种类对QD-4合成的影响
在QD-4的合成中酸的种类和浓度对合成的影响很大,主要采用盐酸和磷酸进行反应,结果如表 1所示.

表 1 酸的种类和浓度对QD-4合成的影响Table 1 Effects of kinds and concentration of acid on QD-4 synthesis
从表 1可以看出:采用盐酸作为反应试剂时,100℃反应 10 d均没有生成产物;改用磷酸后有产物生成,并且采用质量分数为 85%的浓磷酸结果更好.
2.2 不同用量的 QD-4对不对称 Baylis-Hillman反应的影响
在不对称 Baylis-Hil lman反应中,手性催化剂的用量直接影响所得产品的多少,实验结果见表 2.由表 2可以看出:催化剂QD-4的用量对反应结果影响很大,其最佳用量为对硝基苯甲醛用量的 10%左右.
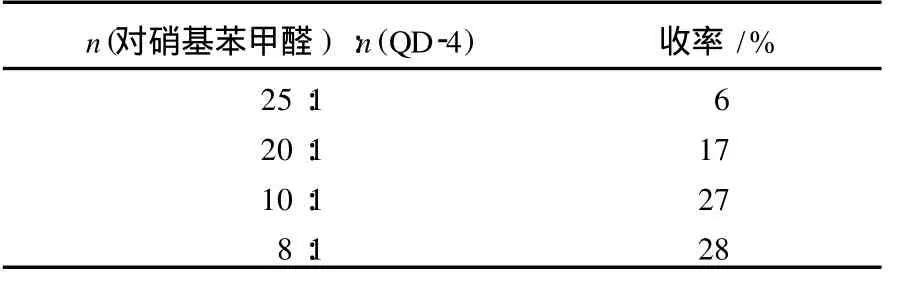
表2 不同用量的QD-4对不对称Baylis-Hil lman反应的影响Table 2 Effects of amounts ofQD-4 on asymmetric Baylis-Hillman reaction
3 结 论
(1)采用廉价的喹尼叮硫酸盐为原料,合成具有较好不对称诱导效果的催化剂 QD-4,并经1H-NMR、I R确定结构正确.
(2)在 QD-4的合成中采用质量分数为85%的浓磷酸时收率较高.
(3)用制备的手性催化剂 QD-4催化不对称 Baylis-Hillman反应,获得具有左旋的 1,1,1, 3,3,3-六氟异丙基 (R)-3-羟基-3-(对硝基苯基)-2-丙烯酸酯,经1H-NMR确定结构正确.
(4)QD-4催化的不对称 Baylis-Hillman反应中催化剂 QD-4的最佳用量为对硝基苯甲醛用量的 10%左右.
[1] W ei Yin,Shi M in.Privileged Chiral Catalysts in A symm etric M orita-Baylis-Hillm an/aza-M orita-Baylis-H il lm an Reaction[J].Chinese Science Bulletin,2010,55(17):1699-1711.
[2] Rafel S,L eahy J W.An U nexpected Rate A ccelera-tions Practical Improvem ents in the Baylis-Hillm an Reaction[J].J.O rg.Chem.,1997,62(5):1521-1522.
[3] 李月明,范青华,陈新滋.不对称有机反应[M].北京:化学工业出版社,2005:316-329.
[4] 蔡觉晓.α-取代膦酸的不对称合成及水参与的均相 Baylis-Hillm an反应 [D].天津:南开大学, 2002:1-35.
[5] Iw abuchi Y,Hatakeyam a S.Recent Progress in the M orita-Baylis-H illm an Reactions[J].Jouralof Synthetic O rganic Chem istry,Japan,2002,60(1):4 -14.
[6] Barrett A G M,Cook A S,Kam im ura A.A symm etric Baylis-Hillm an Reactions:Catalysis Using a Chiral Pyrrolizidine Base[J].Chem ical Comm unications,1998(22):2533-2534.
[7] Iw abuchi Y,N akataniM,Yokoyam a N,et al.Chiral Am ine-Catalyzed A symm etric Baylis-H illm an Reaction:A Reliable Route to H ighly Enantiom erically Enriched(α-M ethylene-β -hydroxy)esters[J].J. Am.Chem.Soc.,1999,121(43):10219-10220.
Synthesis of ChiralLigand Quinoline Derivatives and TheirApplication to Baylis-Hillman Reaction
YANG Gui-qiu1, L IU Chun-cheng2, CU I Guang-jian2, YU Xiu-lan1, Q IU Xing-hua1
(1.Shenyang U niversity of Chem ical Technology,Shenyang110142,China; 2.Shenyang Sciencreat Chem icals CO.,L TD,Shenyang110021,China)
A kind of effective asymm etric catalyst(3R,8R,9S)-10,11-dihydro-3.9-oxido-6′-hydroxydeoxy cinchonine(QD-4) was prepared utilizing cheap quinidine sulfate as starting m aterials.The structure was confirm ed by1-HNM R and IR.(R)-1,1,1,3,3,3-Hexa fluoropropan-2-yl2-(hydroxy(4-nitrophenyl)m ethyl)acrylate was prepared by asymm etric B aylis-H il lm an reaction of4-nitrobenzaldehyde and 1,1,1,3,3,3-hexafluoropropan-2-yl acrylate using(3R,8R,9S)-10,11-dihydro-3.9-oxido-6′-hydroxydeoxy cinchonine as catalysis.
quinidine sulfate; asymm etric catalyst QD-4; B aylis-H il lm an reaction
O621.3
A
1004-4639(2010)04-0308-04
2010-04-13
辽宁省教育厅资助项目(2008560);沈阳化工大学博士启动资金项目(200809)
杨桂秋(1970-),女,辽宁盘锦人,副教授,博士,主要从事药物及中间体的合成研究.
