膜分离技术提取山竺红色素的工艺优化
2010-09-13张小曼马银海鄢胜波
张小曼,马银海*,李 勇,鄢胜波
(昆明学院化学科学与技术系,云南 昆明 650031)
膜分离技术提取山竺红色素的工艺优化
张小曼,马银海*,李 勇,鄢胜波
(昆明学院化学科学与技术系,云南 昆明 650031)
以山竺果皮为原料,对山竺红色素提取、纯化工艺进行研究。采用正交试验研究山竺红色素的提取条件,结果表明最佳提取工艺条件为浸提温度50℃、浸提时间120min、料液比1:8(g/mL)。应用膜分离技术对山竺红色素提取液进行除杂纯化,研究微滤预处理、操作压差和膜面流速对超滤膜通量的影响,确定超滤最佳纯化工艺为操作压差0.12MPa、膜面流速2500L/h。超滤液经蒸发、干燥可得到纯度较高的山竺红色素,其色价达22.15,为未经超滤提取色素色价的3.5倍。
山竺;红色素;提取;纯化
Abstract:A procedure based on acid extraction and membrane ultrafiltration separation was presented for the preparation of red pigments from the fruits of Garcinia mangostana L.. The optimal conditions for red pigment extraction were determined using a 3-factor, 3-level orthogonal array design to be extraction temperature 50 ℃ and material/liquid 1:8 (g/mL) for an extraction duration of 120 min. Microfiltration followed by ultrafiltration under the optimal conditions of transmembrane pressure 0.12 MPa and cross flow velocity 2500 L/h provided optimal purification of the obtained red pigment extract. The Garcinia mangostana L. red pigment product obtained after vacuum distillation and vacuum drying exhibited a color value of 22.15, which was 3.5 times higher than before purification.
Key words:Garcinia mangostana L.;red pigment;extraction;purification
随现代生活水平的提高,食用色素已被广泛用于食品、药品、化妆品等行业。由于合成食用色素对人体健康不利,天然色素倍受人们的青睐。面对天然色素市场的巨大需求,天然色素的开发与利用已成为当前食用色素研究的热点和主题。利用天然植物、动物开发丰富的天然食用色素,进而取代合成色素在食品、医药等工业的应用也已成为绿色化发展的必然趋势[1-2]。
山竺(Garcinia mangostana L.)又名倒捻子、莽吉柿,在云南傣族地区又叫给哈蒿,属于藤黄科常绿乔木,原产印度、马来西亚,是一种典型的热带水果。目前,在泰国、缅甸、越南以及我国海南、福建、云南等地有广泛种植[3]。山竺果实肉白、柔嫩、水多、味香,为人们喜爱的水果之一,被誉为“热带果后”。山竺果皮深紫红色,约占果实质量的50%~60%,泰国民间常用该果皮治疗腹泻、痢疾等疾病[4]。近年来发现山竺果皮提取物化学成分主要为山酮(xanthone)类化合物,具有抗HIV-1 RT作用[5]。在深紫红色的山竺果皮中含有丰富的天然红色素,可作天然食用色素提取原料,且其色素含量高,是天然食用色素开发的优质资源。本实验以山竺果皮为原料,水(盐酸调至pH2)为提取液,对山竺红色素的提取条件及膜分离技术纯化工艺进行研究,确定最佳工艺条件,旨在为山竺红色素的开发与利用提供可借鉴的实验参考数据。
1 材料与方法
1.1 材料、试剂与仪器
山竺果实 市购。
体积分数75%乙醇溶液、盐酸(均为化学纯) 广州化学试剂有限公司。
VIS-723G可见光分光光度计 北京瑞利分析仪器公司;PQ201型旋转蒸发仪 瑞士Buchi仪器有限公司;ZK-82A真空干燥箱 上海实验仪器设备厂;IM-1-1型无机陶瓷膜微滤机(膜孔径0.2μm、膜面积0.44m2) 南京九思高科有限公司;有机膜超滤机(螺旋卷式纤维超滤膜,截流相对分子质量8000) 南京九思高科有限公司。
1.2 方法
1.2.1 山竺红色素的浸提
用盐酸调至pH2的水(自来水)为提取液,按不同的料液比、提取温度和提取时间对山竺果皮浸泡后,过滤去渣,得山竺红色素提取液。
1.2.2 微滤预处理[6]
山竺红色素提取液由储槽经泵循环打入微滤膜组件进行错流过滤,微滤操作压差为0.15MPa,膜面流速3000L/h,收集微滤液。
1.2.3 超滤方法
微滤液经泵压入超滤膜组件错流过滤。操作压差通过调节流速和回流阀控制,膜面流速由流量计读数得到,分别测定不同时间超滤透过液的体积,计算膜通量[7]。

1.2.4 工艺流程
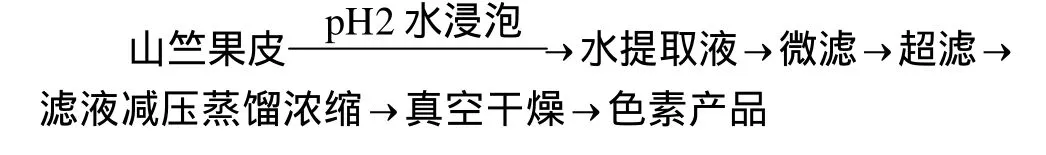
1.2.5 分析测定方法
1.2.5.1 山竺红色素的特征吸收光谱
根据文献[8-9],红色素在可见光区有比较好的光吸收性质。用可见光分光光度计,以pH2的盐酸溶液为空白,1cm石英比色皿,在400~620nm波长范围内对山竺红色素溶液进行扫描,测定色素的吸收光谱。
1.2.5.2 色素纯度比较
采用色价法[10]比较色素纯度。精确称取色素产品1.000g,用盐酸溶液(pH2)溶解定容至100mL,再稀释至一定浓度,使吸光度测定值在0.2~0.8之间,测定其吸光度A,计算色价。

2 结果与分析
2.1 山竺红色素最大吸收波长的确定
在400~620nm波长范围内,山竺红色素吸收光谱图见图1。

图1 山竺果皮红色素吸光度Fig.1 Absorption spectrum of Garcinia mangostana L. red pigments
由图1可知,山竺红色素在可见光区516nm波长处出现最大吸收峰,因此其最大吸收波长为516nm。
2.2 山竺红色素提取正交试验方案设计
为获得最优提取工艺条件,经初步实验,筛选出浸提温度、浸提时间和料液比(山竺果皮:酸水)为考察因素,采用三因素三水平进行L9(33)正交试验,因素与水平的选择见表1,正交试验方案与结果见表2。

表1 因素水平表Table 1 Factors and levels in the orthogonal array design
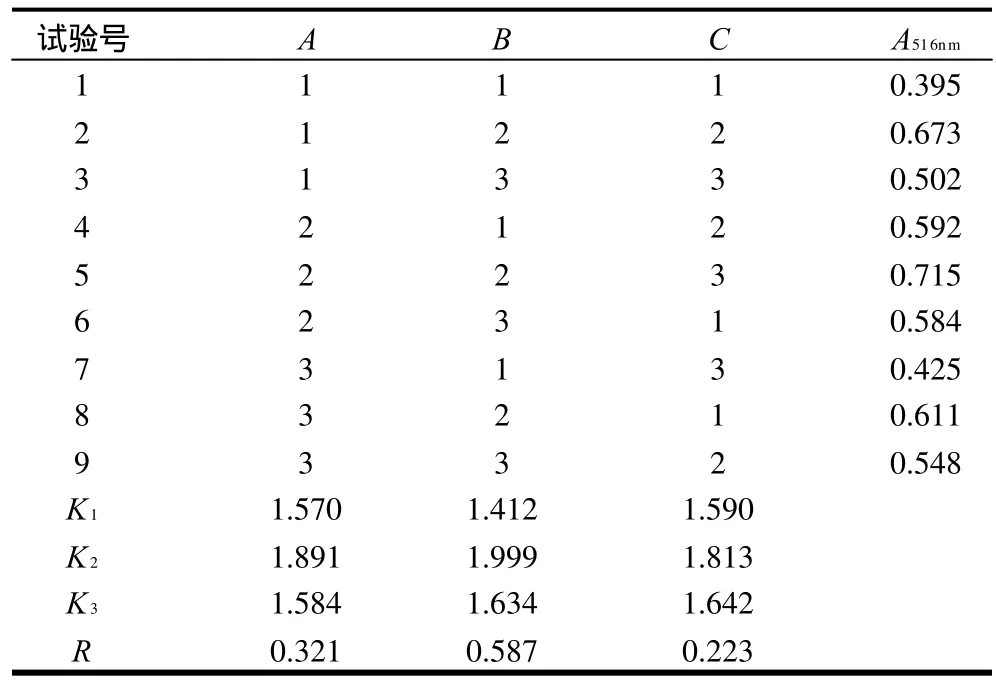
表2 L9(33)正交试验方案和结果Table 2 Orthogonal array design matrix and experimental results of the absorbance at a wavelength of 516 nm of the red pigment extract from the fruits of Garcinia mangostana L.
由表2、3可见,浸提温度、浸提时间和料液比对色素提取率均有显著性的影响,其影响程度依次顺序为:B浸提时间>A浸提温度>C料液比。最佳提取条件为A2B2C2,即浸提温度50℃、浸提时间120min、料液比1:8(g/mL)。

表3 方差分析Table 3 Variance analysis for the absorbance at a wavelength of 516 nm of the red pigment extract from the fruits of Garcinia mangostana L.
2.3 最佳工艺条件的验证实验
称取20g山竺果皮按正交试验所得最佳提取工艺条件(A2B2C2) 进行平行实验5次,结果见表4。计算得出,RSD为0.23%,说明此方法稳定可行。

表4 最佳工艺的验证实验Table 4 Results of validation for optimized red pigment extraction conditions
2.4 超滤膜过滤除杂工艺的优化
2.4.1 微滤预处理对超滤中膜通量的影响
山竺红色素提取液和微滤液分别进行超滤,考察膜通量随时间的变化,实验结果见图2。

图2 微滤对超滤过程膜通量的影响Fig.2 Change of membrane flux during ultrafiltration separation of Garcinia mangostana L. red pigment extract with or without micro-filtration pretreatment
由图2可知,经微滤预处理后超滤过程中膜通量相比较未微滤处理过的要大。在开始时,差别不太明显,但随时间延长差别逐步加大。未经微滤预处理的山竺红色素提取液的膜通量因超滤膜孔堵塞迅速下降,直至35min后趋于稳定;经微滤预处理过的提取液膜通量随时间延长下降较慢,20min后膜通量趋于稳定。说明微滤预处理能有效除去悬浮颗粒和部分果胶、多糖大分子,减少超滤膜的堵塞和污染,使超滤过程容易进行,并保持较大的膜通量,有效缩短超滤时间和生产周期。
2.4.2 超滤中膜面流速对膜通量的影响
膜面流速是影响膜通量的重要因素之一。在超滤20min膜通量基本稳定后,恒定操作压差0.12MPa,改变膜面流速,考察膜通量的变化,结果见图3。

图3 膜面流速对膜通量的影响Fig.3 Effect of cross flow velocity on membrane flux
由图3可知,增大膜面流速可以有效增加膜通量。当流速小于2500L/h时,膜通量随膜面流速呈正比增长,在较大膜面流速下,液体高速流动产生的剪切力能带走膜面上的部分沉积物,以减轻膜污染和浓差极化的影响,提高了膜通量;但当流速大于2500L/h时,膜通量变化不大,液体流动的剪切力达到均衡,增加流速只增加膜管中单位时间液体的循环量,对膜通量的影响不大,机械动力消耗增大,因此膜面流速选择2500L/h为宜。
2.4.3 超滤中操作压差对膜通量的影响
对于压力驱动的膜分离过程,操作压差直接影响膜通量的变化。在超滤20min后膜通量基本稳定,保持2500L/h的膜面流速,改变操作压差,测定膜通量的变化,结果见图4。

图4 操作压差对膜通量的影响Fig.4 Effect of transmembrane pressure on membrane flux
由图4可知,在操作压差小于0.12MPa时,膜通量随操作压差的增加而显著增加;当操作压差大于0.14MPa时,膜通量随操作压差增加反而略减。这可能因为操作压差增大,导致沉积物沉降和吸附速率增加,抵消了膜面流速剪切力所引起的减弱作用,膜面沉积物在高压差作用下不断增厚、变实,出现过滤阻力增加,使膜通量随操作压力增加呈现下降的情况。因此最佳操作压差为0.12MPa。
2.4.4 膜的清洗
在实际操作过程中,为提高超滤除杂效率,膜需要适时清洗。本实验依次用不同清洗剂对膜进行清洗,以纯水通量计算膜通量的恢复率[5],结果见表5。


表5 膜通量的恢复率Table 5 Flux recovery after cleaning
由表5可见,膜面、膜孔堵塞易清洗,分别用0.001mol/L NaOH、纯水、0.001mol/L HCl、纯水依次清洗后,膜通量恢复率达95.0%。超滤膜为有机中空纤维制作,耐酸耐碱抗氧化,在工业生产中,膜适时清洗,超滤速率快,使用寿命长,应用成本低。
2.5 不同提取工艺所得色素质量的比较
用不同方法提取山竺红色素,并计算产品提取率。分别准确称取未纯化、75%乙醇溶液助沉、微滤、微滤-超滤工艺组合得到的山竺红色素产品配制成一定浓度的溶液,在516nm波长处测定其吸光度,计算色价,结果见表6。
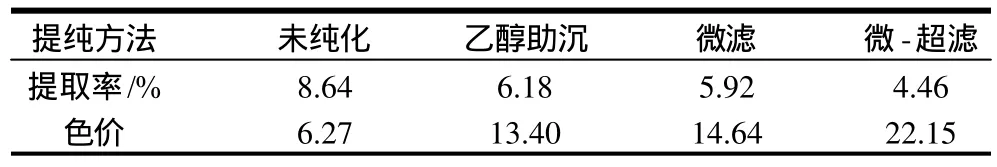
表6 不同方法对山竺红色素纯化效果Table 6 Yield and color value of Garcinia mangostana L. red pigments before and after purification by different methods
从表6可见,微滤与乙醇助沉除杂效果相差不大,但微滤的优势在于操作简单,水提取液可直接上膜过滤而得到相对纯的色素提取液,无溶剂回收生产成本较低。当把微滤和超滤组合联用,产品提取率稍低,但除杂效果最好,色价达22.15,是未经处理的3.5倍,是乙醇除杂的1.7倍。说明微滤把较大的杂质除去后,再经超滤可进一步把相对分子质量大于8000随水而溶出的果胶、多糖、纤维素等杂质除去,得到较纯的色素。因此,山竺红色素提取液采用微滤-超滤膜除杂纯化方法是比较经济可行的。
3 结 论
3.1 山竺红色素提取的最佳工艺条件为以盐酸调至pH2的水作溶剂,料液比1:8(g/mL)、浸取温度50℃、浸提时间120min,提取效果最好。
3.2 超滤膜分离纯化的最佳工艺条件为操作压差0.12MPa、膜面流速2500L/h。超滤液经减压蒸馏、浓缩、干燥得到的山竺红色素产品,其相对色价达22.15,是未经超滤提取色素的色价3.5倍。
3.3 膜分离技术提取山竺红色素,生产工艺简单、操作容易、生产成本低,产出色素纯度高,适合于工业化生产。
[1] 王统一, 樊静, 赵兵. 天然色素的提取和精制研究进展[J]. 中国食品添加剂, 2008(增刊1): 58-62.
[2] 高海荣, 张辉, 李冬生. 天然食用色素的研究进展[J]. 农产品加工:学刊, 2009, 175(6): 64-66.
[3] 中国科学院昆明植物研究所. 云南植物志: 第五卷[M]. 北京: 科学出版社, 1991: 135.
[4] VORAVUTHIKUNCHAI S P, KITPIPIT L. Activity of medicinal piant extracts against hospital isolate of methicillin-resistant Staphylococcus aureus[J]. Clin Microbiol Infect, 2005, 11(6): 510-512.
[5] 胡江苗, 陈纪军, 赵友兴, 等. 山竺果壳的化学成分[J]. 云南植物研究, 2006, 28(3): 319-322.
[6] 姜淑, 马银海, 古昆, 等. 陶瓷膜微滤澄清黄芩提取液的研究[J]. 云南大学学报, 2005, 27(3): 245-248.
[7] 徐南平, 邢卫红, 赵宜江. 无机膜分离技术与应用[M]. 北京: 化学工业出版社, 2003: 10.
[8] 张弘, 卢艳民, 郑华, 等. 水溶法提取胭脂虫红色素的工艺条件及其优化[J]. 食品科学, 2009, 30(16): 115-118.
[9] 陈美红, 徐玉娟, 李春美. NKA大孔树脂分离纯化桑椹红色素的研究[J]. 食品科技, 2007(10): 32-35.
[10] 杨晓伟, 薛红玮, 牟德华. 酿酒葡萄皮渣中花色苷提取工艺的优化[J]. 食品与机械, 2009, 25(2): 130-132.
Optimization of Extraction and Membrane Separation of Red Pigments from Garcinia mangostana L.
ZHANG Xiao-man,MA Yin-hai*,LI Yong,YAN Sheng-bo
(Department of Chemical Science and Technology, Kunming University, Kunming 650031, China)
TS202.3
A
1002-6630(2010)10-0133-04
2009-12-16
云南省教育厅科研项目(09Y0346)
张小曼(1956—),女,副教授,本科,主要从事天然产物及精细化学品化学研究。E-mail:ynzhxm@yahoo.com.cn
*通信作者:马银海(1964—),男,教授,本科,主要从事天然产物研究。E-mail:MYH5929251@163.com
