两种方法制备氟苯尼考人工抗原及其鉴定
2010-09-13赵朋玲郑海涛姜盼盼朱学加何计国
赵朋玲,郑海涛,姜盼盼,朱学加,何计国*
(中国农业大学食品科学与营养工程学院,北京 100083)
两种方法制备氟苯尼考人工抗原及其鉴定
赵朋玲,郑海涛,姜盼盼,朱学加,何计国*
(中国农业大学食品科学与营养工程学院,北京 100083)
目的:通过两种不同方法制备氟苯尼考人工抗原并将制备的人工免疫原用于动物免疫。方法:分别采用琥珀酸酐法和强碱水解法制备两种人工半抗原(HP1和HP2)。将两种半抗原与牛血清白蛋白(BSA)和卵清白蛋白(OVA)通过活泼酯法和戊二醛法进行偶联,制备人工免疫原和人工包被原,分别命名为HP1-BSA、HP1-OVA、HP2-BSA和HP2-OVA。分别将两种方法合成的人工免疫原用于动物免疫,用两种人工包被原对获得的两种抗血清进行评价。结果:经质谱、紫外光谱表征,氟苯尼考两种半抗原均合成成功,并且与载体蛋白的偶联比分别为12.4:1(HP1-BSA)、8.5:1(HP1-OVA)、21.8:1(HP2-BSA)、15.4:1(HP2-OVA)。动物实验结果表明,获得的针对HP1-BSA的抗血清与HP2-OVA包被原结合最为灵敏。结论:活泼酯法和戊二醛法均成功制备了氟苯尼考人工抗原。
氟苯尼考;抗原合成;活泼酯法;戊二醛法
Abstract:Two hapaten synthesis methods, succinic anhydride method and alkaline hydrolysis were used for florfenicol deriviazation and the synthesized hapatens, named HP1 and HP2, were separately conjugated with BAS (bovine serum albumin)by active ester method and OVA (ovalbumin) by glutaraldehyde method to obtain two immunoagents, named HP1-BAS and HP2-BAS and two coating antigens, named HP1-OVA and HP2-OVA. HP1-BAS and HP2-BAS were separately used to immunize Balb/c mice for obtaining antisera. Antisera response to HP1-BAS and HP2-BAS were evaluated for their titers using HP1-OVA and HP2-OVA. The mass spectrometric and UV spectral characterization demonstrated that HP1 and HP2 were successfully synthesized. The coupling ratios between HP1 or HP2 and BAS or OVA were determined to be 12.4:1 (HP1-BSA),8.5:1 (HP1-OVA), 21.8:1 (HP2-BSA) and 15.4:1 (HP2-OVA). The antiserum responses to HP1-BAS had the most specificity to HP2-OVA.
Key words:florfenicol;synthesis of antigen;active ester method;glutaraldehyde method
氟苯尼考是一种由美国Schering-plough公司研制的,用于治疗畜禽细菌性疾病、伤寒、副伤寒、呼吸道感染的动物专用广谱抗菌药物[1],具有吸收良好、体内分布广、抗菌谱广的特点。由于氯霉素在食品动物中被禁止使用,氟苯尼考成为其替代品在水产、牲畜及禽类中使用广泛[2-3]。目前,已在亚洲、欧洲、美洲等20多个国家上市使用[1]。氟苯尼考具有血液系统毒性及胚胎毒性[1],广泛的应用,导致其在动物食品中的残留情况日趋严重,对人体健康构成潜在威胁。
目前国内外用于检测动物性食品中氟苯尼考残留的主要方法有液相色谱法[4-5]、气相色谱法[6-7]、液质联用[8-9]、气质联用[10-11]等,均具有前处理复杂、烦琐耗时、仪器化程度高且价格昂贵等缺点,不易推广并应用于大批量样品的检测。近年来,免疫分析技术已经越来越广泛的应用于兽药残留分析领域,以其简单、廉价、快捷、灵敏度高、适用于大批量样品检测等优点而成为一种重要的分析方法。
利用氟苯尼考的结构可以设计出两种合成半抗原的途径,将两种半抗原分别与载体蛋白BSA和OVA偶联以制备相应的人工抗原,为氟苯尼考单克隆抗体的制备提供可靠的免疫原和包被原。
1 材料与方法
1.1 材料与试剂
6周龄雌性Balb/c小鼠14只,购于军事医学科学院实验动物中心,合格证号:SCXK(京) 2006—0009。
氟苯尼考(Florfenicol,含量>98.0%) 浙江海翔药业股份有限公司;牛血清白蛋白(BSA)第五组分(含量>98.0%)、卵清白蛋白(OVA)、弗氏完全佐剂、弗氏不完全佐剂 Sigma公司;薄层色谱硅胶预制板 烟台市化学工业研究所;丁二酸酐(化学纯) 中国医药集团上海化学试剂公司;N-羟基琥珀酰亚胺(NHS) 德国Merck-Schuehardt公司;N,N二环乙基碳酰亚胺(DCC)(化学纯)国药集团化学试剂有限公司;戊二醛、N,N-二甲基甲酰胺(DMF)(分析纯) 北京化学试剂厂;乙二胺四乙酸(EDTA,纯度>99.0%) Amresco公司;4-二甲氨基吡啶(DMAP,含量>98.0%) 上海共价化学科技有限公司;氟苯尼考标准品 Dr.Ehrenstorfer GmbH公司。
1.2 仪器与设备
ZAB-HS质谱仪 英国VG公司;FA1004上皿电子天平 北京东南仪诚实验室设备有限公司;722S分光光度计 上海精密科学仪器有限公司;UV-2450紫外-可见分光光度计 岛津分析仪器公司;Alpha-Pure纯水系统 上海瑞枫生物科技有限公司;LGJ-10冷冻干燥机 北京四环科学仪器厂;透析袋(分子质量12000~14000D)北京拜尔迪有限公司;X-4数字显示显微熔点测定仪 北京泰克仪器有限公司。
1.3 方法
1.3.1 活泼酯法合成人工抗原
1.3.1.1 氟苯尼考琥珀酸酯半抗原(HP1)的制备
精确称取氟苯尼考2.8657g,置于圆底烧瓶中,加入40mL丙酮作为溶剂,再加入丁二酸酐2.400g及DMAP 0.0488g,加热回流24h。反应过程中采用薄层色谱(TLC)监测反应进程。减压蒸馏除去反应液中的丙酮,干燥得淡黄色结晶状粉末,即为合成产物。合成产物用数显显微熔点测定仪进行测定,并采用质谱法进行鉴定,合成路线见图1。
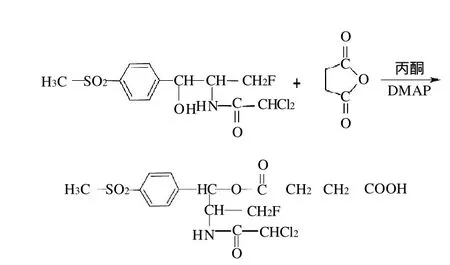
图1 半抗原HP1的合成路线Fig.1 Synthetic route of HP1
1.3.1.2 人工抗原的合成[12]
将半抗原HP1与BSA偶联制备免疫原(HP1-BSA),合成路线见图2。准确称取45.8mg半抗原溶于2mL DMF中,加入20.6mg DCC和11.5mg NHS,在室温下磁力搅拌24h。反应液2000r/min离心10min,弃去沉淀,制备氟苯尼考活化中间产物。
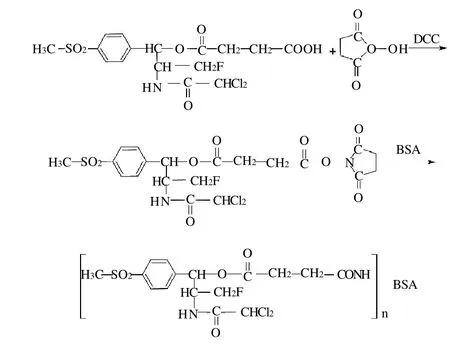
图2 活泼酯法制备人工免疫原的合成路线Fig.2 Synthetic route of immunogen by active ester method
按载体蛋白与半抗原物质的量的比为1:100的比例,准确称取66.0mg BSA,溶于8mL pH7.4的PBS中,振荡溶解,在冰水浴及磁力搅拌下,将活化中间物逐滴加入到BSA-磷酸盐缓冲液中,4℃搅拌过夜。反应液于次日置于处理过的透析袋内,4℃、pH7.4的PBS中透析72h,每8h换液一次。活泼酯法人工包被原的制备选用OVA载体蛋白,操作方法及各物质所用剂量同活泼酯法人工免疫原的合成。
透析结束后,反应液用考马斯亮蓝染色法测定偶联物的蛋白质质量浓度,并结合紫外扫描图谱计算出半抗原与载体蛋白的结合比[13]。剩余反应液分装,-20℃保存。

式中:A为吸光度;M为相对分子质量;c为质量浓度/(mg/mL)。
1.3.2 戊二醛法合成人工抗原
1.3.2.1 氟苯尼考胺半抗原(HP2)的制备
准确称取5.3730g氟苯尼考及1.2800g氢氧化钠放入圆底烧瓶中,加入15mL水作为溶剂,加热搅拌至溶液澄清。加入3.0000g氯化钠,再搅拌至全部溶解,冷却至室温后过夜,滤出固体,干燥,得到氟苯尼考胺半抗原。合成产物经薄层色谱法初步鉴定,用数显显微熔点测定仪进行测定,并采用质谱法进行鉴定,合成路线见图3。

图3 半抗原HP2的合成路线Fig.3 Synthetic route of HP2
1.3.2.2 人工抗原的合成[14-15]
将氟苯尼考胺与BSA偶联制备免疫原(HP2-BSA),合成路线见图4。将24.7mg氟苯尼考胺溶于2mL DMF中,逐滴加入到含有66.0mg BSA的8mL pH7.4的PBS中。然后逐滴加入100μL戊二醛于反应液中,4℃搅拌过夜。反应液于4℃、pH7.4的PBS中透析72h,每8h换液一次。戊二醛法人工包被原的制备选用OVA载体蛋白,操作方法及各物质所用剂量同戊二醛法人工免疫原的合成。透析结束后的反应液处理方法见1.3.1.2节中所述。
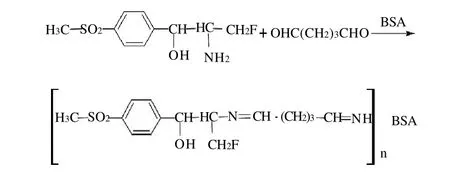
图4 戊二醛法制备人工免疫原的合成路线Fig.4 Synthetic route of coating immunogen by glutaraldehyde method
1.3.3 动物免疫
选取14只6周龄Balb/c雌性小鼠,随机分成两组,每组6只,另两只用于阴性血清对照。用两种不同方法合成的人工免疫原HP1-BSA和HP2-BSA分别进行动物免疫,免疫剂量均为100μg/mL,首次免疫使HP1-BSA和HP2-BSA与等体积的弗氏完全佐剂乳化后注射,采用颈背部皮下多点注射方式。每两周免疫一次,共3次,后两次乳化剂改用弗氏不完全佐剂,免疫剂量和免疫方法同前。3次免疫后10d对小鼠进行眼眶内龇采血0.2mL,室温静置1h,4℃冰箱过夜,3000r/min离心15min,收集血清,4℃保存。采用间接ELISA方法[16],用HP1-OVA和HP2-OVA分别作为包被原对两种免疫原进行免疫获得的抗血清进行测定。
2 结果与分析
2.1 半抗原的结构鉴定
2.1.1 薄层色谱(TLC)监测结果及熔点分析
薄层色谱(展开剂:氯仿:丙酮:乙酸乙酯体积比为1:1:1)结果表明,在合成氟苯尼考琥珀酸酯(HP1)的反应中,生成了不同于氟苯尼考(Rf=0.78)的新产物(Rf=0.64);在合成氟苯尼考胺(HP2)的反应中,生成了不同于氟苯尼考(Rf=0.78)的新产物(Rf=0.43)。
在常压室温下,采用数显显微熔点测定仪对新合成产物进行测定表明,氟苯尼考琥珀酸酯(HP1)的熔点为99~101℃,在此温度范围内,中间体全部熔为淡黄色液体;氟苯尼考胺(HP2)的熔点为161~163℃。据文献[17]报道,氟苯尼考的熔点为152~156℃,丁二酸酐熔点为118~120℃,氟苯尼考胺的熔点为162~164℃。由此可初步判断,HP1与HP2均为新生成物质。
2.1.2 质谱鉴定结果
新合成两种半抗原HP1和HP2的质谱鉴定结果见图5、6。

图5 HP1半抗原的质谱图Fig.5 Mass spectrum of HP1
由图5可见,新生成物[HP1-H]-相对分子质量为456.0299,表明产生的新化合物的相对分子质量为456.0299+1,与目标物氟苯尼考琥珀酸酯(HP1)的理论相对分子质量457. 37基本一致,因此可推断合成产物即为所需的目标产物HP1。
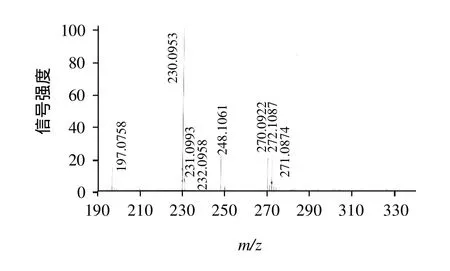
图6 HP2半抗原的质谱图Fig.6 Mass spectrum of HP2
由图6可见,新生成物[HP2-H]+相对分子质量为248.1061,表明产生的新化合物的相对分子质量为248.1061-1,与目标物氟苯尼考胺(HP2)的理论相对分子质量247.28基本一致,因此可推断合成产物即为所需的目标产物HP2。
2.2 人工抗原的鉴定
用考马斯亮蓝法[18]测定HP1-BSA、HP1-OVA、HP2-BSA、HP2-OVA中蛋白质质量浓度分别为3.20、3.42、10.59、12.47mg/mL。采用紫外扫描法[18]测定两种不同方法合成的人工抗原中半抗原与载体蛋白的偶联情况。根据偶联物中所测蛋白质质量浓度,将半抗原、载体蛋白及偶联物均配制成200μg/mL的质量浓度,紫外扫描图谱见图7~10。
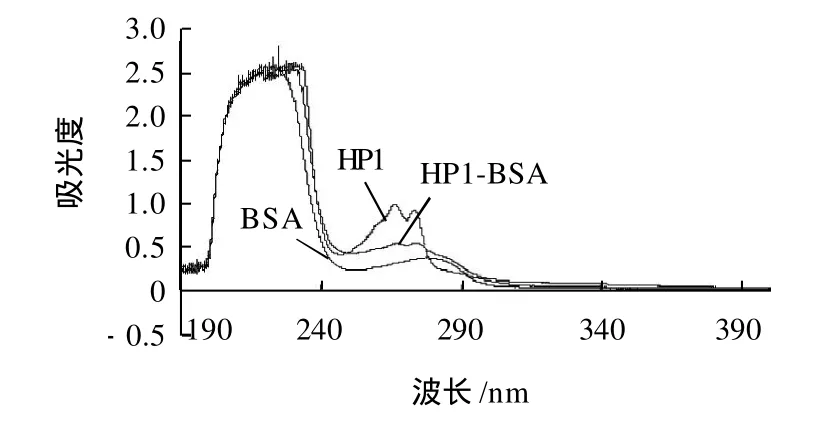
图7 HP1、BSA和HP1-BSA的紫外扫描图谱Fig.7 UV absorption spectra of HP1, BSA and HP1-BSA
由图7可见,偶联物HP1-BSA与BSA在相同的蛋白质质量浓度下,HP1-BSA与载体BSA相比,吸收曲线发生了改变,且是在HP1的最大吸收范围内,HP1-BSA的吸光度有所增加,说明载体蛋白成功偶联上了一定数目的小分子半抗原HP1。

图8 HP1、OVA和HP1-OVA的紫外扫描图谱Fig.8 UV absorption spectra of HP1, OVA and HP1-OVA
由图8可见,偶联物HP1-OVA的吸收曲线既具有载体蛋白的紫外吸收特征,也具备半抗原的紫外吸收特征。HP1-OVA与OVA在相同的蛋白质质量浓度下,HP1-OVA与载体OVA相比,吸收曲线发生了改变,且是在HP1的最大吸收范围内,HP1-OVA的吸光度有所增加,说明载体蛋白成功偶联上了一定数目的小分子半抗原HP1。
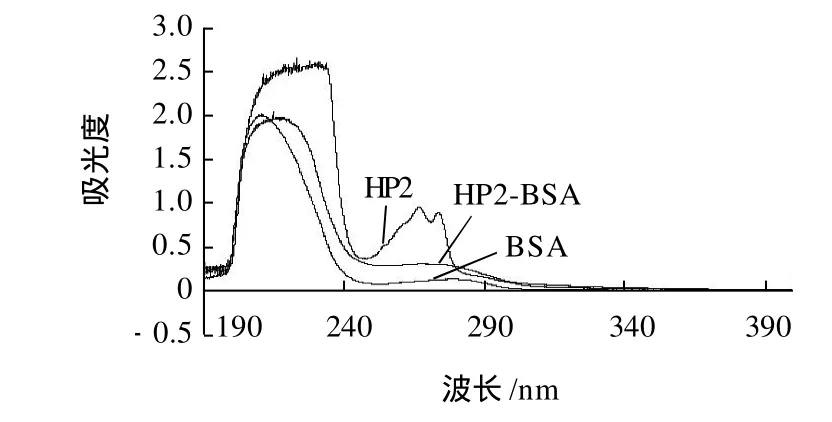
图9 HP2,BSA和HP2-BSA的紫外扫描图谱Fig.9 UV absorption spectra of HP2, BSA and HP2-BSA
由图9看出,偶联物HP2-BSA与BSA在相同的蛋白质质量浓度下,HP2-BSA与载体BSA相比,吸收曲线发生了改变,且是在HP2的最大吸收范围内,HP2-BSA的吸光度有所增加,说明载体蛋白成功偶联上了一定数目的小分子半抗原HP2。

图10 HP2,OVA和HP2-OVA的紫外扫描图谱Fig.10 UV absorption spectra of HP2, OVA and HP2-OVA
由图10看出,偶联物HP2-OVA的吸收曲线既具有载体蛋白的紫外吸收特征,也具备半抗原的紫外吸收特征。HP2-OVA与OVA在相同的蛋白质质量浓度下,HP2-OVA与载体OVA相比,吸收曲线发生了改变,且是在HP2的最大吸收范围内,HP2-OVA的吸光度有所增加,说明载体蛋白成功偶联上了一定数目的小分子半抗原HP2。
常用的人工抗原结合比的测定方法是紫外光谱法。根据上述所测各人工抗原紫外扫描图谱中278nm波长处偶联物与蛋白质的吸光度,计算得各半抗原与载体蛋白的结合比分别为12.4:1(HP1-BSA)、8.5:1(HP1-OVA)、21.8:1 (HP2-BSA)、15.4:1 (HP2-OVA)。
2.3 小鼠血清测定结果
用两种包被原分别对两种免疫原免疫获得的小鼠抗血清进行测定,结果见表1。

表1 以HP1-OVA与HP2-OVA为包被原测定氟苯尼考对小鼠抗血清的半抑制浓度Table 1 IC50of mouse antisera response to HP1-BAS and HP2-BAS assayed using HP1-OVA or HP2-OVA as coating antigen
由表1可见,用HP1-BSA免疫获得的抗血清在以HP2-OVA为包被原时,与氟苯尼考小分子的亲和力最好,包被原的异源性显著提高了检测的灵敏度,半数抑制浓度(IC50)达到0.28μg/mL。
3 讨 论
3.1 半抗原的合成
在兽药残留的免疫分析中,人工抗原的合成是抗体制备和免疫分析方法建立中最关键的步骤,而半抗原的合成是兽药残留免疫分析中最基础的步骤。半抗原设计的关键在于尽可能保留原待测物的特征结构,并在适当的位置引入合适的间隔臂和与载体蛋白偶联的活性基团。
Kim等[19-20]发现在制备免疫原和包被原时,使用不同结构的连接臂、采用不同的偶联方法或改变连接臂的引入位置,则可以大大提高ELISA检测的灵敏度。沈建忠等[21]在建立马杜霉素酶联免疫检测方法过程中,在制备免疫原时以半抗原的羧基为活性位点与载体蛋白的氨基偶联,而包被原的制备则使用引入带有氨基连接臂半抗原与载体蛋白的羧基偶联,通过改变半抗原与免疫原和包被原的键合方式,使检测灵敏度提高了2~3倍。分析认为,半抗原的结构特征及其与载体蛋白连接的间隔臂会影响人工抗原的免疫效果,这样可以消除多克隆抗体对间隔臂的识别能力,使抗体与包被原上的可识别位点减少,降低抗体对包被原的亲和力,通过异源分析降低抗体对间隔臂的识别能力从而增强抗体对目标化合物的识别能力。
为能与载体蛋白相偶联,小分子物质必须具备能与载体蛋白偶联的功能性基团(-COOH、-NH2、-OH、-SH等)。本研究根据氟苯尼考分子结构上既无羧基又无氨基、不能直接与载体蛋白相联的结构特征,采用两种方法对其结构进行改造,使得两种半抗原与蛋白相连接的间隔臂以及连接位点均不同。一种方法是利用氟苯尼考分子上所带的羟基,采用活泼酯法将其活化成具有羧基(-COOH)的活性半抗原,然后与蛋白上的氨基相连,合成含CO-NH键的抗原。另外一种方法是将氟苯尼考分子上的酰胺键用强碱水解,生成氟苯尼考胺,借助戊二醛两端的醛基与半抗原和载体蛋白的氨基以共价键连接。本研究证实间隔臂结构的改变明显提高了抗血清与小分子待测物的特异性结合能力,与前人研究结果相一致。
3.2 人工抗原的合成
由于氟苯尼考是小分子物质,只可以被B细胞表面的抗原识别受体所识别,无法引发T细胞对B细胞的辅助作用来活化B细胞,因此就需要将其连接到一个载体蛋白上,借助载体T细胞表位间接诱导B细胞,产生免疫应答和针对免疫原的特异性抗体。在人工抗原的合成中,要注意尽量保留人工抗原中原有半抗原的原始立体构象和电子分布特征,半抗原分子越少,越应注意保留其特征基团不被改变,实验中要尽量避免使用其特征性的官能团用以交联反应[22]。因此,在不改变两种氟苯尼考半抗原特征性结构的前提下,采用活泼酯法和戊二醛法同时合成免疫原和包被原,使两种方法合成的人工抗原间隔臂结构不同,期望制备出对氟苯尼考小分子特异性强、选择性好、对间隔臂亲和性低的抗体。同时为了避免载体蛋白之间的交叉反应,本实验制备免疫原和包被原分别用的是牛血清白蛋白和卵清蛋白。
由于半抗原的特异性不仅取决于半抗原整个分子或部分结构的性质,还与其人工抗原中载体上连接的半抗原数目有关。因此在免疫前,测定合成的人工抗原载体上连接的半抗原数目是非常必要和重要的。通常每一载体上含有8~25个半抗原时能取得较好的免疫效果[23],本研究用活泼酯法和戊二醛法分别合成了两种免疫原和包被原,计算出的结合比均在此最适结合比范围内,理论上应能得到效价较高的抗体,动物免疫表明,两种免疫原所免疫的老鼠效价均在8000以上,为下一步特异性单克隆抗体的制备提供参考。
4 结 论
活泼酯法和戊二醛法均成功的合成了免疫原和包被原,偶联比分别为12.4:1(HP1-BSA)、8.5:1(HP1-OVA)、21.8:1 (HP2-BSA)、15.4:1 (HP2-OVA) ,可以用于下一步单克隆抗体的制备及免疫学快速检测方法的建立。
[1] 陈晓慧, 刘明春, 焦阳. 氟苯尼考的研究新进展及其应用[J]. 现代畜牧兽医, 2006(10): 51-54.
[2] SAMUELSEN O B, BERGH O. Efficacy of orally administered florfenicol and oxolinic acid for the treatment of vibrosis in cod[J]. Aquaculture,2004, 235: 27-35.
[3] SHIN S J, KANG S G, NABIN R, et al. Evaluation of antimicrobial activity of florfenicol against bacteria isolated from bovine and porcine respiratory disease[J]. Vet Micro Biol, 2005, 106: 73-77.
[4] 张立军, 戒江瑞, 齐敏. 高效液相色谱法检测鱼中的氟苯尼考残留量[J].中国卫生检验杂志, 2007, 17(3): 438-439.
[5] WRZESINSKI C L, CROUCH L S. Determination of florfenicol amine in channel catfish muscle by liquid chromatography[J]. AOAC Int, 2003,86: 515-520.
[6] PFENNING A P, ROYBAL J E, RUPP H S, et al. Simultaneous determination of residues of chloramphenicol, florfenicol, florfenicol amine,and thiamphenicol in shrimp tissue by gas chromatography with electron capture detection[J]. AOAC Int, 2000, 83: 26-30.
[7] ZHANG Suxia, SUN Fengyun, LI Jiancheng, et al. Simultaneous determination of florfenicol and florfenicol amine in fish, shrimp, and swine muscle by gas chromatography with a microcell electron capture detector[J]. AOAC Int, 2006, 89: 1437-1441.
[8] 殷平, 陈舜胜, 邓晓军, 等. 液质联用检测水产品中氯毒素、氟苯尼考和甲砜氯毒素的残留量[J]. 现代食品科技, 2007, 23(10): 83-87.
[9] van de RIET J M, POTTER R A, CHRISTIE-FOUGERE M, et al.Simultaneous determination of residues of chloramphenicol,thiamphenicol, florfenicol, and florfenicol amine in farmed aquatic species by liquid chromatography/mass spectrometry[J]. AOAC Int, 2003,86: 510-514.
[10] 贺利民, 曾振灵, 黄显会, 等.气相色谱-质谱联用法测定猪肉组织中氟苯尼考残留[J]. 华南农业大学学报, 2005, 26(3):100-102.
[11] 康继韬, 愈雪钧, 谢东华, 等. 气相色谱-质谱测定水产中氯霉素残留量[J]. 分析实验室, 2005, 24 (7): 38-40.
[12] 徐敦明, 徐向前, 刘映前. 鬼臼毒素人工抗原的合成与鉴定[J]. 药学学报, 2005, 40(6): 518-524.
[13] 姜盼盼, 陈晨, 何计国. 有机磷农药共性结构人工抗原的合成与鉴定[J]. 卫生研究, 2009, 38(6): 649-652.
[14] SHENG Jianwu, HE Miao, SHI Hanchang, et al. A comprehensive immunoassay for the detection of microcystins in waters based on polyclonal antibodies[J]. Anal Chim Acta, 2006, 572: 309-315.
[15] CLIQUET P, COX E, HAASNOOT W, et al. Generation of groupspecific antibodies against sulfonamides[J]. Agric Food Chem, 2003,51: 5835-5842.
[16] 朱学加. 喹乙醇单克隆抗体制备与初步应用研究[D]. 北京: 中国农业大学, 2007.
[17] 刘海燕. 喹乙醇对中华鳖稚鳖的影响及其促生长机制的探讨[D]. 石家庄: 河北师范大学, 2004.
[18] 汪家, 政范明. 蛋白质技术手册[M]. 北京: 科学出版社,2000, 73:77-101.
[19] KIM Y J, CHO Y A, LEE T S, et al. Synthesis of haptens for immunoassay of organophosphorus pesticide and effect of heterology in hapten spacer arm length on immunoassay sensitivity[J]. Analytica Chimica Acta, 475, 2003: 85-96.
[20] KIM Y J, CHO Y A, LEE H S. Investigation of the effect of hapten heterology on sensitivity and development of an enzyme linked immunosorbent assay for the organophosphorus insecticide fenthion[J].Analytical Chimica Acta, 2003, 494(1/2): 29-40.
[21] 沈建忠, 钱传范, 杨汉春, 等. 肌肉组织中马杜霉素残留检测的研究[D]. 北京: 中国农业科学, 1998, 31(6): 1-5.
[22] GB/T 22262—2008饲料中氯羟吡啶的测定高效液相色谱法[S].
[23] LI Qingxiao, ZHAO Mengshu, GEE S L, et a1. Development of enzyme-linked immunosorbent assays for 4-nitrophenol and substituted 4-nitrophenols[J]. J Agric Food Chem, 1991, 39: 1685-1692.
Preparation of Haptens by Two Different Methods for Immunoassay Determination of Florfenicol and Their Identification
ZHAO Peng-ling,ZHENG Hai-tao,JIANG Pan-pan,ZHU Xue-jia,HE Ji-guo*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
TS201.2
A
1002-6630(2010)15-0225-06
2010-04-18
赵朋玲(1985—),女,硕士研究生,研究方向为食品营养与卫生。E-mail:zhaopengling1128@yahoo.cn
*通信作者:何计国(1966—),男,副教授,研究方向为营养学、食品卫生与安全。E-mail:hejiguo0870@sina.com
