1,3-1,4-β-葡聚糖酶基因克隆表达及其耐热性研究进展*
2010-09-12孙军涛王洪新吕文平马朝阳戴易兴
孙军涛,王洪新,吕文平,马朝阳,戴易兴
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡,214122)
1,3-1,4-β-葡聚糖酶基因克隆表达及其耐热性研究进展*
孙军涛,王洪新,吕文平,马朝阳,戴易兴
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡,214122)
1,3-1,4-β-葡聚糖酶(E.C.3.2.1.73)是一类降解β-葡聚糖中与β-1,3糖苷键相邻的β-1,4糖苷键的酶,因其主要分解大麦中的1,3-1,4-β-葡聚糖和细菌地衣多糖(又称地衣多糖酶),广泛应用于发酵和饲料工业。但其高温条件下酶活较低,构建高温下活性高的1,3-1,4-β-葡聚糖酶成为近年来研究的热点。文中介绍了1,3-1,4-β-葡聚糖酶的生化特性,综述了1,3-1,4-β-葡聚糖酶基因的克隆表达、耐热性及其应用方面的研究进展,并对其研究前景进行了展望。
1,3-1,4-β-葡聚糖酶,基因克隆,基因表达,耐热性
1,3-1,4-β-葡聚糖是禾本科高等植物(谷物类)细胞壁的多糖组分,是由1200个以上的β-D-葡萄糖残基通过β-1,3和β-1,4糖苷键连接而成的线性分子,在大麦、燕麦、高粱、大米和小麦等谷物胚乳细胞壁中的含量尤为丰富,不同谷物β-葡聚糖中2种糖苷键键型的比例和寡糖单元的长度有所不同,如大麦,90%以上的水溶性β-葡聚糖是由单一的β-1,3糖苷键连接纤维三糖和纤维四糖所组成;谷物中1,3-1,4-β-葡聚糖在萌发初期主要被其内源性葡萄糖水解酶所降解,其中活性最强的内源性葡聚糖水解酶是1,3-1,4-β-葡聚糖酶(1,3-1,4-β-D-glucan 4-glucanohydrolase,1,3-1,4-glucanase,E.C.3.2.1.73,简称β-葡聚糖酶或地衣多糖酶),它是只降解β-葡聚糖中与β-1,3糖苷键相邻的β-1,4糖苷键的酶,其降解产物主要是纤维三糖和纤维四糖(见图1)[1]。
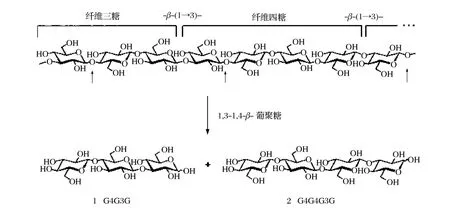
图11,3-1,4-β-葡聚糖酶催化水解大麦β-葡聚糖反应
不仅植物中能够产生β-葡聚糖酶,许多微生物(细菌和真菌)也能分泌β-葡聚糖酶,这2类酶在氨基酸序列和三维空间结构上虽无同源性,但具有相同底物的专一性。植物产β-葡聚糖酶属于糖水解酶家族17,其三级结构呈(a/β)8折叠桶;而微生物产β-葡聚糖酶属于糖水解酶家族16,其三级结构呈果冻状β-三明治结构[2]。
β-葡聚糖在啤酒生产和饲料加工过程中会产生一些问题,如降低麦芽汁和啤酒过滤速度,影响啤酒风味,在啤酒储存过程中易引起沉淀[3];过多的β-葡聚糖会增加饲料的黏性和不可消化性,降低饲料的营养价值。在生产加工过程中,由于高温处理,使谷物内源性的1,3-1,4-β-葡聚糖酶失活,在啤酒生产和饲料加工过程中,添加适量的耐热的活性高的1,3-1,4-β-葡聚糖酶能够解决工业生产中由β-葡聚糖引起的负面影响。
本文主要对微生物产生的1,3-1,4-β-葡聚糖酶的生化特性,酶基因的克隆,表达和耐热性以及其在工业中的应用进行了综述,旨在为研究高活性耐热1,3-1,4-β-葡聚糖酶提供参考。
1 酶的生化特性
芽孢杆菌β-葡聚糖酶是由1条蛋白多肽链折叠而成,其分子质量在25~30 ku,等电点(p I)为7.5~9.1,最适pH接近中性,为6~7.5[除短芽胞杆菌(B.brevis),最适pH为9,嗜碱芽孢杆菌N137(A lkalophilic B acillussp.N137)在pH7~12内仍有大于80%酶活外]。酶的最适反应温度分别为45℃[多黏芽孢杆菌(B.polym yxa)[4]],55℃[枯草芽孢杆菌(B.subtilis)[5],解淀粉芽孢杆菌(B.am yloliquefaciens)[5],地衣芽孢杆菌(B.lichenifor m is)[6])和 65℃(浸 麻 芽 孢 杆 菌(B.m acerans)[5]]。酶的比活力在 1200~4500 μmol/(min·mg)之间(以水解大麦β-葡聚糖转化为还原糖葡萄糖的量计算),以大麦和地衣多糖为底物时的Km值分别在1.2~1.5 mg/mL和0.8~2.0 mg/mL之间。
虽非芽孢杆菌的1,3-1,4-β-葡聚糖酶与芽孢杆菌相比多出了其他功能的结构域,但是他们有相似的生物化学特性,几种非芽胞杆菌1,3-1,4-β-葡聚糖酶的分子量大小,最适pH值,最适温度如表1所示。

表1 非芽胞杆菌1,3-1,4-β-葡聚糖酶的酶学特性
2 1,3-1,4-β-葡聚糖酶基因克隆
许多芽孢杆菌属来源的1,3-1,4-β-葡聚糖酶基因已经克隆并进行了测序,主要包括B.subtilis[11],B.am yloliquefaciens[12],B.m acerans[13],B.circulans[14]等,除了环状芽孢杆菌1,3-1,4-β-葡聚糖酶外,已经克隆的芽孢杆菌1,3-1,4-β-葡聚糖酶基因在核苷酸和氨基酸酸序列上都有同源性,环状芽孢杆菌酶的分子质量约为其它芽孢杆菌酶的2倍,并能降解纤维素。嗜碱芽孢杆菌N137的酶在C-末端有富含赖氨酸区域,而在其他的β-葡聚糖酶中没有发现这样的区域。
1,3-1,4-β-葡聚糖酶基因也在非芽孢杆菌属中克隆,它们的催化活性区域序列与芽孢杆菌酶的同源性很高,但常常也有其他功能结构域。从瘤胃球菌(Rum inococcus flavofaciens)克隆了双功能xynD基因,该基因是既有木聚糖酶结构域(N-末端),又有1,3-1,4-β-葡聚糖酶结构域(C-末端),两结构域通过含309个氨基酸残基的结构域相连,该结构域中有功能未知由30个氨基酸残基组成的富含Thr氨基酸的序列,与芽孢杆菌β-葡聚糖酶相比,该酶对海带多糖呈现一定的专一性,但是对地衣多糖或谷物葡聚糖的活力较低[15]。
已经确定真菌有产生1,3-1,4-β-葡聚糖酶的基因,Chen等首次从厌氧真菌O rpinom yces中克隆出1,3-1,4-β-葡聚糖酶的基因,其氨基酸残基序列与细菌1,3-1,4-β-葡聚糖酶序列同源性高,并且不含有大多数真菌水解酶具有的非催化结构域[9]。
3 1,3-1,4-β-葡聚糖酶基因表达
细菌产1,3-1,4-β-葡聚糖酶已经在许多不同宿主菌中表达,如大肠杆菌(Escherichia coli)、芽孢杆菌(Bacillusstrains)、啤酒酵母(Saccharom yces cerevisiae)以及其他转基因植物大麦和烟草中。
在大肠杆菌中表达1,3-1,4-β-葡聚糖酶是采用芽孢杆菌自身的启动子和信号肽序列或采用大肠杆菌的启动子,根据目的基因和宿主菌的不同而不同,所表达的1,3-1,4-β-葡聚糖酶不仅能够积累在周质空间内,也能够分泌在细胞外(细胞外占20%~60%,细胞质周围占60%~20%),有10%~50%的酶仍保留在细胞内。Goldenkova[16]等通过修饰细菌产1,3-1,4-β-葡聚糖酶的基因(licBM2)建立一种新的报告基因系统,研究基因在原核生物(大肠杆菌)和真核生物(酿酒酵母)中表达的机理,结果表明表达产物具有很好的活性。吕文平[17]等在克隆载体上亚克隆了短小芽孢杆菌β-1,3-1,4-葡聚糖酶基因全长,用BamHI和XhoⅠ双酶切目的片段构建重组表达载体pET-pum,导入大肠杆菌BL21中成功表达了β-1,3-1,4-葡聚糖酶基因。
芽孢杆菌作为宿主菌进行1,3-1,4-β-葡聚糖酶表达时,表达的水平取决于质粒的拷贝数和菌株的种类[18],酿造和饲料工业上用的1,3-1,4-β-葡聚糖酶主要是由枯草芽孢杆菌和解淀粉芽孢杆菌的高产菌株获得。通过去除相关的基因序列,已经构建出一系列基因缺失的β-葡聚糖酶,纤维素酶,木糖酶芽孢杆菌菌株。
酵母菌作为宿主菌,将芽孢杆菌1,3-1,4-β-葡聚糖酶基因进行异源表达,构建杂合酿酒酵母,用于降解麦芽中的β-葡聚糖。在酵母中表达的N-末端糖基化的1,3-1,4-β-葡聚糖酶与在大肠杆菌中表达的非糖基化酶相比有更好的热稳定性,糖基化的形式取决菌株种类和培养条件[19]。通过对地衣芽孢杆菌1,3-1,4-β-葡聚糖酶基因优化,该密码子的96个氨基酸进行优化,其中102个核苷酸发生变化,使(G+C)比例从43.6%上升到45.5%,并在Pichia pastoris表达,表达水平是未优化的10倍多,重组酶的最适pH和温度分别为6.0和45℃[20]。Huang等[21]也通过对来自琥珀酸丝状杆菌的1,3-1,4-β-葡聚糖酶基因进行优化,并在Pichia pastoris表达,获得了较好的表达水平。
转基因植物也被用作宿主进行耐热细菌1,3-1,4-β-葡聚糖酶基因表达。来自解淀粉芽孢杆菌和浸麻芽孢杆菌的杂合葡聚糖酶基因已经被克隆,并在大麦中表达[22];用嗜热纤梭菌1,3-1,4-β-葡聚糖酶作为表达基因,分析其在转基因烟草中表达的同源性[23]。
4 耐热性研究
在1,3-1,4-β-葡聚糖酶耐热性研究中也有通过酶固定化,添加保护剂或金属离子等物理方法提高酶的耐热性。本文主要从分子生物学角度,如构建杂合基因工程菌,定点诱变,基因缺失等方面综述耐热1,3-1,4-β-葡聚糖酶的研究概况。
为了获得工业生产pH条件下具有较高热稳定性的酶,将不同来源的芽孢杆菌1,3-1,4-β-葡聚糖酶基因进行杂合,获的适合工业生产需要的杂合酶。浸麻芽孢杆菌是在中性条件下是热稳定性最好的杆菌之一,最适酶催化温度为65℃,在75℃下仍能保持80%的酶活,但在酸性条件下活性低;而解淀粉芽孢杆菌的活性受酸性影响少,最适pH为6.0,根据二者的各自优点,已经成功构建出一系列杂合酶[5]。
Pons等[24]研究了地衣芽孢杆菌1,3-1,4-β-葡聚糖酶与底物结合的表面环上(从Asp51到Arg64)丙氨酸的突变与酶热稳定的关系,表明酶去折叠时的能量与其在65℃时的半失活时间呈正相关;其中一个突变酶(N57A)的热稳定性高于野生酶,说明处于表面环可及面积较高区域Asn57氨基侧链在高温下不稳定。
通过对琥珀酸丝状杆菌1,3-1,4-β-葡聚糖酶不同位点氨基酸与催化活性的关系研究,为研究其耐热性奠定一定的基础。Chen等[25]对琥珀酸丝状杆菌1,3-1,4-β-葡聚糖酶活性位点Met39,Glu56,Asp58,Glu60,Gly63氨基酸残基定点突变,用酶催化动力学,荧光色谱和空间结构模型分析研究酶催化活性和空间结构稳定性的变化。与野生型酶相比,突变酶E56D,E60D,D58N和D58E的反应速率常数(kcat)分别下降了240,540,570和880倍,但具有相似底物的亲和性;相反,突变酶E56A,E56Q,D58A,E60A和E60Q没有检测到酶活,与野生型酶和其他突变酶相比G63A突变酶显示较低的热稳定性。表明Glu56,Asp58和Glu60残基在琥珀酸丝状杆菌1,3-1,4-β-葡聚糖酶催化活性上发挥重要作用。Cheng等[26]也通过对琥珀酸丝状杆菌1,3-1,4-β-葡聚糖酶Trp54,Trp105,Trp112 Trp141,Trp148,Trp165,Trp186,Trp198和Trp203九个色氨酸残基定点诱变,研究其对酶催化活性的影响。结果表明,Trp54,Trp141,Trp148和Trp203氨基酸残基在维持酶结构完整性和催化活性方面发挥重要作用。为了提高琥珀酸丝状杆菌1,3-1,4-β-葡聚糖酶的催化活性和耐热性,扩大其在工业中的应用,Wen等[27]研究了琥珀酸丝状杆菌1,3-1,4-β-葡聚糖酶C-末端与酶结构和功能的关系,利用PCR获得了去除C-末端部分基因片段(分子质量为10 ku左右),并将其在Escherichia coliBL21或Pichia pastorisX-33宿主中表达,结果表明去除琥珀酸丝状杆菌1,3-1,4-β-葡聚糖酶C-末端部分氨基酸序列,包括丝氨酸重复片段和末端结构域中富含正电荷的序列,能够显著增强酶的催化活性和耐热性。
Fu[28]等利用Clostridium ther m ocellum ZJL41,3-1,4-β-葡聚糖酶(CG)N-末端部分片段(除了信号肽序列)被Bacillus subtilis A31,3-1,4-β-葡聚糖酶(BG)相对应的片段所替代,构建了高产酶的基因片段mHG(669bp),设计了一系列的定点诱变的信号肽。由人工合成疏水信号肽H1控制的mHG从细胞质进入培养基中,培养22 h后酶活达到80.56 U/mL,通过对来自Bacillus subtilis(pBSG-H1)的mHG(25.3 ku)纯化,其酶催化最适温度为70℃,pH为5.0,在90℃下保温10 min,仍保留83.45%的酶活,具有很好的耐热性,有利于酶在工业生产中的应用。
李卫芬[29]通过基因缺失、基因突变、构建杂合基因等方法系统地研究热纤维梭菌β-葡聚糖酶热稳定性机制,结果发现热纤维梭菌β-葡聚糖酶热稳定性与C-末端尾巴无关,与其催化结构域有关;热纤梭菌β-葡聚糖酶催化结构域N-末端和C-末端氨基酸残基都会影响酶热稳定性,这些氨基酸残基对酶热稳定性的提高具有累加作用,第10~216位氨基酸残基的存在对酶热稳定性的维持必不可少;蛋白质表面氨基酸的静电作用力是影响热纤梭菌β-葡聚糖酶催化结构域热稳定性的主要作用力,其中193E和169E是决定热纤维梭菌β-葡聚糖酶热稳定性的关键氨基酸。
5 1,3-1,4-β-葡聚糖酶在工业中的应用
5.1 在发酵工业中的应用
β-葡聚糖酶广泛应用于发酵工业,中国、美国、日本、丹麦、德国、澳大利亚等国均已采用β-葡聚糖酶作为啤酒工业的主要酶制剂。在啤酒酿造过程中,大麦胚乳细胞中的β-葡聚糖不能充分降解,β-葡聚糖的残留是造成啤酒酒体混浊、泡沫持久力减少和挂杯力不强的主要原因,β-葡聚糖酶可以专一分解黏度很高的各种大麦β-葡聚糖,提高原料的利用率,使麦芽汁黏度降低,大大缩短麦芽汁和啤酒的过滤时间,增加啤酒产量,改善啤酒的质量。
5.2 在饲料工业中的应用
大麦是我国主要的谷物之一,产量仅次于小麦、稻谷和玉米,随着饲料生产规模化、现代化,谷物饲料尤其是大麦饲料的用量不断增加,但其成分中的β-葡聚糖这一抗营养因子的存在严重制约了饲料的利用率。将β-葡聚糖酶作为饲料添加剂,能够消除β-葡聚糖的抗营养作用,提高饲料的利用率。
5.3 在制糖工业中的应用
在制糖工业中,肠膜明串珠菌感染压榨的蔗糖汁后,产生高黏度的葡聚糖,导致堵塞压榨机和管道,给浓缩、结晶带来困难,使蔗糖大量损失。添加杀菌剂不但增加成本,而且容易造成蔗糖的污染。通过添加β-葡聚糖酶来处理煎汁中的葡萄糖,减少了糖分的损失,并能取得较好的效果。
6 展望
1,3-1,4-β-葡聚糖酶是重要的工业用酶,可有效降解谷物中β-葡聚糖,减少在酿造和饲料工业中产生的负面影响,现代高温的糖化工艺,对酶的热稳定性提出了更高的要求,并且饲料造粒的温度也常常使酶活性损失。开发适应工业加工需要的耐热、高活性的1,3-1,4-β-葡聚糖酶将成为发酵和饲料行业的研究热点之一。从自然界中筛选出产1,3-1,4-β-葡聚糖酶菌株,并通过诱变等手段来提高其催化活性和耐热性,是一种较为普遍的改善酶学特性的方法,但此方法有很大的随机性,效果不太显著;随着分子生物学技术的发展,1,3-1,4-β-葡聚糖酶基因已经被克隆,并在不同的载体中得到很好的表达,因此,可以通过对1,3-1,4-β-葡聚糖酶耐热和催化机理的研究,采用定点突变或构建杂合基因的方法来提高1,3-1,4-β-葡聚糖酶催化活性和耐热性将是一个很好的途径。
[1]Hrmova M,Banik M,Harvey A J,et al.Polysaccharide hydrolases in ger minated barley and their role in the depolymerization of plant and fungal cellwalls[J].International Journal of Biological Macromolecules,1997,21(1):67-72.
[2]HenrissatB.Updating the sequence-based classification of glycosyl hydrolases[J].BiochemicalJournal,1996,316:695-696.
[3]Schimming S,Schwarz W H,Staudenbauer W L.Properties of a ther moactive beta-1,3-1,4-Glucanase(lichenase)fromClostridium ther m ocellumexpressed inEscherichia coli[J].Biochemical and Biophysical Research Communication,1991,177:447-452.
[4]Borriss R,Zemek J.Beta-1,3-1,4-glucanase in sporeformingmicroorganis msIV.Properties of someBacillus-βglucan-hydrolases[J].Naturwissenschaften,1981,136:63-69.
[5]Olsen O,Borriss R,Simon O,et al.Hybrid Bacillus(1-3,1-4)-beta-glucanases:engineering thermostable enzymes by construction of hybrid genes[J].Molecular Genetics and Genomics,1991,225:177-185.
[6]Lloberas J,Querol E,Bernues J.Purification and characterization of endo-β-1,3-glucanase activity fromBacillus lichenifor m is[J].Applied Microbiology and Biotechnology,1988,29:32-38.
[7]Erfle J D,Teather R M,Wood P J,et al.Purification and properties of a 1,3-1,4-β-D-glucanase(lichenase 1,3-1,4-β-D-glucan 4-glucanohydrolase,EC 3.2.1.73)fromBacteroides succinogenescloned inEscherichia coli[J].Biochemical Journal,1988,255:833-841.
[8]M Sait Ekinci,Sheila IMccrae,Harry J Flint.Isolationand overexpression of a gene encoding an extracellularβ-(1,3-1,4)-glucanase fromStreptococcus bovisJB1[J].Applied and EnvironmentalMicrobiology,1997,63(10):3752-3756.
[9]Chen H,LjungdahlL G.Sequencing of a 1,3-1,4-beta-D-glucanase(lichenase)from the anaerobic fungusO rpinomycesstrain PC-2:properties of the enzyme expressed in Escherichia coliand evidence that the gene has a bacterial origin[J].The Journal of Bacteriology,1997,179(19):6028-6034.
[10]Antoni Planas.Bacterial 1,3-1,4β--glucanases:structure,function and protein engineering[J].Bioch imica et Biophysica Acta,2000,1543:361-382.
[11]Edward Hinchliffe.Cloning and expression of aBacillus subtilisendo-1,3-1,4-β-D-glucanase gene inEscherichia coliK12[J].Journal of General Microbiology,1984,130:1285-1291.
[12]JHofemeister J,Kurtz A,Borriss R,et al.Theβ-glucanase gene fromBacillus am yloliquefaciensshows extensive homology with that of Bacillus subtilis[J].Gene,1986,49(2):177-187.
[13]Borriss R,Buettner K,Maentsaelae P.Structure of the beta-1,3-1,4-glucanase gene of Bacillus macerans:homologies to other beta-glucanases[J].Molecular and General Genetics,1990,222:278-283.
[14]Bueno A,Vazquez de Aldana CR,Correa J,et al.Synthesis and secretion of aBacillus circulansWL-121,3-1,4-beta-D-glucanase inEscherichia coli[J].The Journal of Bacteriology,1990,172(4):2160-2167.
[15]Flint H J,Martin J,McPherson C A,et al.A bifunctional enzyme,with separate xylanase and beta(1,3-1,4)-glucanase domains,encoded by thexynD gene ofRum inococcus flavefaciens[J].The Journal of Bacteriology,1993,175(10):2943-2951.
[16]Goldenkova IV,Musiychuk K A,Piruzian E S.A thermostableClostridium the rmocellumlichenase-based reporter system for studying the gene expression regulation in prokaryotic and eukaryotic cells[J].Molecular Biology,2002,36(5):698-704.
[17]吕文平,许梓荣.短小芽孢杆菌β-1,3-1,4-葡聚糖酶基因克隆、表达及其酶特性研究[J].浙江大学学报:农业与生命科学版,2004,30(6):679-683.
[18]Borriss R,Noack D,Geuther R,et al.β-1.3-1.4-glucanase in sporeforming microorganis ms.V I.Genetic instability ofβ-glucanase production in a high producer strain of Bacillus am yloliquefaciensgrown in a chemostat[J].ZAllgMikrobiol,1982,22:293-298.
[19]MeldgaardM,Svendsen I.Different effectsofN-glycosylation on the thermostabilityof highly homologous bacterial(1,3-1,4)-beta-glucanases secreted from yeast[J].Microbiology,1994,140:159-166.
[20]TengDa,Fan Ying,Yang Ya-lin,et al.Codon optimization of Bacillus lichenifor m isβ-1,3-1,4-glucanase gene and its expression inPichia pastoris[J].AppliedMicrobiology and Biotechnology,2007,74:1074-1083.
[21]Huang Huo-qing,Yang Pei-long,Luo Hui-ying,et al.High-level expression of a truncated 1,3-1,4-β-D-glucanase fromFibrobacter succinogenesinPichia pastorisby opt imization of codons and fermentation[J].AppliedMicrobiology and Biotechnology,2008,78:95-103.
[22]Hovarth H,Huang J,Wong O,et al.The production of recombinant proteins in transgenic barley grains[J].Proceedings of the NationalAcademy of Science of the U-nited States ofAmerica,2000,97:1914-1919.
[23]Piruzian E S,Monzavi-KarbassiB,Darbinian N S,et al.The use of a thermostableβ-glucanase gene fromClostridium ther m ocellumas a reporter gene in plants[J].Molecular and General Genetics,1998,257:561-567.
[24]Pons J,Querol E,Planas A.Mutational analysis of the major loop of Bacillus1,3-1,4-beta-D-glucan 4-glucanohydrolases[J].The Journal of Biological Chemistry,1997,272:13006-13012.
[25]Chen Jui-lin,TsaiLi-chu,Wen Tuan-nan,et al.Directed mutagenesis of specific active site residues onFibrobacter succinogenes1,3-1,4-β-D-glucanase significantly affects catalysis and enzyme structural stability[J].The Journal of Biological Chemistry,2001,276(21):17895-17901.
[26]Cheng Hsueh-Ling,Tsai Li-Chu,Lin Su-Shiang,et al.Mutagenesis of Trp54 and Trp203 residues onFibrobacter succinogenes1,3-1,4-β-D-glucanase significantly affects catalytic activities of the enzyme[J].Biochemistry,2002,41:8759-8766.
[27]Wen Tuan-Nan,Chen Jui-Lin,Lee Shu-Hua,et al.A truncatedFibrobacter succinogenes1,3-1,4-β-D-glucanase withimproved enzymatic activity and thermotolerance[J].Biochemistry,2005,44:9197-9205.
[28]Fu Ling-lin,Xu Zi-rong,Shuai Jiang-bing,et al.High-Level secretion of a chimeric ther mostable lichenase from Bacillus subtilisby screening of site-mutated signal peptideswith structural alterations[J].CurrentMicrobiology,2008,56:287-292.
[29]李卫芬,热纤梭菌β-葡聚糖酶热稳定性机制的研究[D].杭州:浙江大学,2005.
ABSTRACT1,3-1,4-β-glucanases(E.C.3.2.1.73)exhibits a strict substrate specificity for degradation ofβ-1,4 glycosidic bonds in 3-O-substituted glucopyranose units such as cerealβ-glucans and lichenan,which have been widely used in fermentation and feed industry.But its enzyme activity is low under high temperature,it has been a research hotspot to build a 1,3-1,4-β-glucanase with high activity under high temperature.This paper describes the biochemical characteristics of 1,3-1,4-β-glucanase and reviews its gene cloning,expression,ther mostability and application research,the research prospects of 1,3-1,4-β-glucanase are also forecasted.
Key words1,3-1,4-β-glucanases,gene cloning,expression,ther mostability,application
Development on 1,3-1,4-β-glucanases Gene Clon ing,Expression and Thermostability
Sun Jun-tao,Wang Hong-xin,LvWen-ping,Ma Chao-yang,Dai Yi-xing
(State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
博士研究生(吕文平副教授为通讯作者)。
*国家自然科学基金项目(20090964);无锡市科技创业计划项目(CIE00920)
2010-01-05,改回日期:2010-03-02
