NaC lO2/氨水溶液同时脱除SO2和NO的热力学研究
2010-09-12张晓波郭瑞堂潘卫国徐宏建吴黎明彭皓
张晓波,郭瑞堂,潘卫国,徐宏建,吴黎明,彭皓
(1.上海电力学院能源与环境工程学院,上海 200090;2.上海瑞帆环境工程有限公司,上海 200080)
NaC lO2/氨水溶液同时脱除SO2和NO的热力学研究
Ther modynamic study ofNaClO2/ammonia solution simultaneous removal of SO2and NO
张晓波1,郭瑞堂1,潘卫国1,徐宏建1,吴黎明1,彭皓2
(1.上海电力学院能源与环境工程学院,上海 200090;2.上海瑞帆环境工程有限公司,上海 200080)
利用化学热力学基本原理分别对NaClO2/氨水溶液同时脱除SO2、NO的反应过程中摩尔反应吉布斯自由能变、摩尔反应焓变、化学反应平衡常数以及化学反应达到平衡时的SO2和NO的分压力进行了计算,结果表明:利用NaClO2/氨水溶液同时脱除SO2、NO是可行的,且SO2和NO的脱除效率几乎可以达到100%。
NaClO2/氨水溶液;同时脱除SO2、NO;化学热力学
0 引言
空气中SO2、NOx是造成空气污染的主要原因之一。据统计,燃煤排放的SO2约占SO2总排放量的85%以上,排放出的NOx约占NOx总排放量的67%以上[1],对人类及生态环境造成极大的危害。随着环保政策的日益严格,许多燃煤锅炉需同时减少NOx和SO2的排放量。目前,主要采用不同措施分别对SO2、NOx进行脱除:石灰石/石膏湿法以其脱硫效率高、运行稳定、运行费用低等特点成为当今世界应用最广泛的脱硫技术;NOx的脱除分为燃烧中脱除和燃烧后脱除,典型的有选择性催化还原法和选择性非催化还原法。尽管其脱除效率均较高,但分别脱除SO2和NOx会使得设备占地面积大,投资和运行费用高。因此,在现在的主流脱硫技术(石灰石/石膏湿法脱硫)的基础上,向吸收浆液中加入添加剂,将NOx中含量最高的NO氧化为易溶于水的NO2,实现SO2和NOx的同时脱除具有广阔的工业应用前景。
国内外已有学者将NaClO2、K MnO4等强氧化剂作为添加剂[1-9]进行研究,并取得了许多成果。在几种氧化NO的氧化剂中,NaClO2被认为是最有前景的[10]。Hyung-Keun Lee[10]等研究指出在Na-ClO2同时脱硫、脱硝试验中,SO2在溶液中反应后生成,NO在碱性溶液中反应后生成。Hsu等[11]研究了NaC lO2溶液吸收低浓度NO的动力学过程,Hsin Chu等[12]对NaC lO2/NaOH溶液吸收SO2与NO的化学反应动力学进行了研究。本文从热力学原理上对NaC lO2/氨水溶液同时脱除SO2和NO反应的可能性和限度进行分析,并与只用NaClO2溶液同时脱除SO2和NO进行对比,旨在为湿法烟气脱硫、脱硝技术提供理论依据。
1 化学反应
从Hyung-Keun Lee等研究可知NaClO2/氨水溶液同时脱除SO2和NO反应的产物与溶液的pH值有关。在氨水存在的碱性条件下,这一过程将会发生如下化学反应[10-13]:

2 热力学分析
2.1 化学反应的焓变计算
在一个等压变温的化学反应过程中,由基尔霍夫公式知其焓变可以用如下公式进行计算[14]:

反应中涉及各种物质的标准生成焓及定压比热容如表1所示。鉴于目前没有NaClO2的等压热容数据,因此用相近的物质NaClO4代替[11]。

表1 各种物质的标准生成焓、标准生成吉布斯自由能、标准熵及定压比热容[15]
由于在脱硫塔中,烟气中SO2与浆液中CaCO3的最佳反应温度为50℃(323 K)左右[16],故根据式(3),在300~370 K范围内计算反应(1)、(2)焓变随温度的变化情况,结果如图1所示。

图1 温度对反应焓变的影响
从图1可以看出当温度在300~370 K中变化时,化学反应焓变均为负值,说明这两个反应为放热反应,单纯温度的升高不利于反应的进行。
2.2 化学反应的吉布斯自由能变计算
化学热力学中,在等温等压条件下反应时,常用自由能的变化来判别化学反应的方向和限度。当△G<0时,反应能向正方向进行;当 △G>0时,反应不能向正反应进行;当 △G=0时,反应体系达到平衡。脱硫塔内部的化学反应一般是在恒温、恒压条件下进行的。因此,可以计算不同温度下化学反应过程中吉布斯自由能的变化。计算公式如下[17]:

不同温度下反应(1)和反应(2)的吉布斯自由能变随温度的变化情况如图2所示。

图2 温度对反应吉布斯自由能变的影响
从图2中可以看出,反应(1)、(2)的吉布斯自由能变均为负值,这也说明反应(1)、(2)是正向进行的。两反应吉布斯自由能随温度的升高而增大,从化学热力学角度来看,单纯升高温度不利于SO2和NO的脱除,尤其对于反应(2)影响更明显。但当温度在300~370 K范围内反应(1)、(2)的吉布斯自由能变均远小于-40 kJ/mol,因此,反应均可以进行且限度较深[17]。
2.3 化学反应平衡常数的计算
不同温度下的化学反应平衡常数用如下公式进行计算[18]:
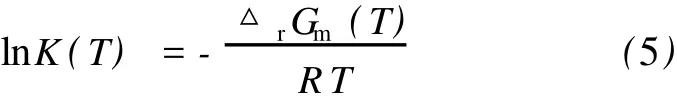
根据式(5)计算得出了不同温度下反应(1)、(2)的平衡常数K1(T)和K2(T),结果见表2。
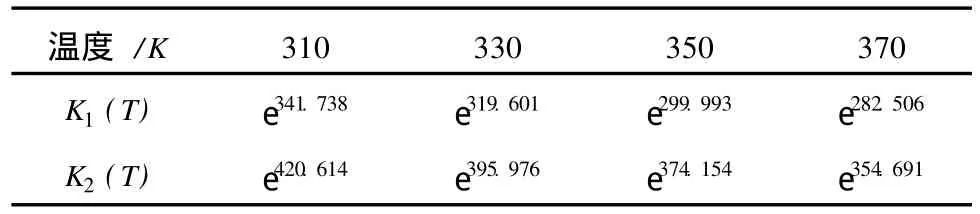
表2 不同温度下反应的平衡常数
从表2中可以看出,在不同的反应温度下,反应(1)和反应(2)的平衡常数都是非常大的,因此反应可以正向进行,并且进行得限度很深。
2.4 不同温度下SO2和NO平衡分压的计算
反应达到平衡时,化学反应的吉布斯自由能变为零,即有[18]:
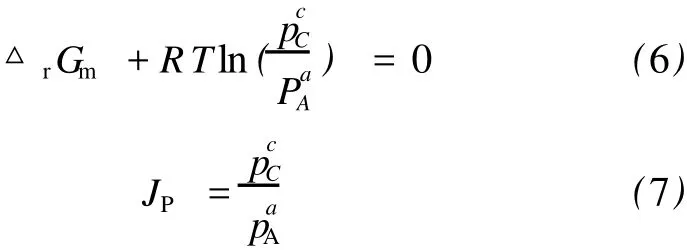
根据上式分别计算出不同温度下的SO2和NO的平衡分压,结果发现,在310~370 K之间,随着温度的升高,以上两反应在达到平衡时的SO2和NO分压随着温度升高而增大,这说明温度的升高不利于SO2和NO的脱除。但是即使温度升高到370 K, SO2和NO的分压也极小,这说明利用NaClO2/氨水溶液同时脱除SO2和NO是可行的,几乎可以脱除100%的SO2和NO。
3 结语
利用化学热力学原理计算了NaClO2/氨水溶液同时脱除SO2和NO这一化学反应过程的焓变、吉布斯自由能变、化学反应平衡常数等热力学参数。结果表明,温度的升高不利于SO2和NO的脱除,但在湿法烟气脱硫塔中,SO2和CaCO3的反应温度范围内利用NaClO2/氨水溶液来进行SO2和NO的同时脱除在热力学上是完全可行的,而且可以几乎100%的脱除烟气中的SO2和NO。
[1]高翔,吴祖良,杜 振,等.烟气中多种污染物协同脱除的研究[J].环境污染与防治,2009,33(12):84-90.
[2]DeshwalB R,Lee S H,Jung J H,et al.Study on the removal ofNOxfrom simulated flue gas using acid NaClO2solution[J].Journal of Environmental Sciences,2008,20(1):33-38.
[3]Hutson N D,Krzyzynska R,Srivastava R K.Simultaneous removal of SO2,NOxand Hg from coal flue gas using a NaClO2enhanced wet scrubber[J].Industrial and Engineering Chemistry Research,2008, 47(16):5825-5831.
[4]Chien TW,Chu H,Li Y.Absorption kinetics of nitrogen oxides using sodium chlorite solutions in twin spray columns[J].Water,Air and Soil Pollution,2005,166(1/4):237-250.
[5]Wei J,Yu P,Cai B,et al.Absorption of NO in aqueous NaClO2/ Na2CO3solutions[J].Chemical Engineering&Technology,2009,32 (1):114-119.
[6]Sada E,Kumazawa H,Hayakawa N,et al.Absorption of NO in aqueous solution of K MnO4[J].Chemical Engineering Science,1977, (32):1171-1175.
[7]Chu H,Chien TW,Li S Y.Simultaneous absorption of SO2and NO from flue gaswith K MnO4/NaOH solutions[J].The Science of the Total Environment,2001,275(1/3):127-135.
[8]白云峰,李永旺,吴树志,等.K MnO4/CaCO3协同脱硫脱硝实验研究[J].煤炭学报,2008,33(5):575-578.
[9]Brogren C,Karlsson H T,Bjerle I.Absorption of NO in an alkaline solution of K MnO4[J].Chemical Engineering&Technology,1997, 20(6):396-402.
[10]Lee H,DeshwalB R,Yoo K.Simultaneous removal of SO2and NO by odium chlorite solution in wetted-wall column[J].Korean Journal of Chemical Engineering,2005,22(2):208-213.
[11]赵毅,刘凤,赵音,等.亚氯酸钠溶液同时脱硫脱硝的热力学研究[J].化学学报,2008,66(15):1827-1832.
[12]Hsin Chu,Tsung-Wen,Chien,et al.Simultaneous absorption of SO2and NO in a stirred tank reactorwith NaClO2/NaOH solutions [J].Water,Air,and Soil Pollution,2003,(143):337-350.
[13]王琼,胡将军,邹鹏.NaClO2湿法烟气脱硫脱硝技术研究[J].电力环境保护,2005,21(2):4-6.
[14]高执棣.化学热力学[M].北京:北京大学出版社,2006.
[15]Dean J A.兰氏化学手册(第2版)[M].北京:科学出版社, 2003.
[16]陈绍敏.安装GGH对湿法脱硫系统的影响[J].电站辅机, 2007,101(2):26-29.
[17]李大珍.化学热力学基础[M].北京:北京师范大学出版社, 1982.
[18]郭瑞堂,潘卫国,任建兴,等.K MnO4/NaOH溶液同时脱硫脱硝的热力学研究[J].华东电力,2010,38(1):44-46.
X701.7
B
1674-8069(2010)04-15-03
2010-04-29;
2010-06-27
张晓波(1987-),男,山西黎城人,在读硕士研究生,研究方向为脱硫、脱硝技术。Email:zxb-317@163.com
上海市教委科研创新项目(10YZ155);上海高校选拔培养优秀青年教师专项基金项目(SD109008)
Abstract:Molar reaction Gibbs function change,molar reaction enthalpy change,equilibrium constant and the equilibrium partialpressure of SO2and NO for the reaction of s imultaneous removal of SO2and NO by using aqueous NaC lO2/ammonia solution were calculated based on the principle of chem ical thermodynam ics.As can be seen from the results,s imultaneous removalof SO2and NO by using NaC lO2/ammonia solution is available, and the removal efficiencies are nearly 100%.
Key words:NaC lO2/ammonia solut ion;s im ultaneous removalof SO2,NO;chem ical thermodynam ics
