诺氟沙星-钕金属配合物的合成,表征及其与DNA作用的研究
2010-09-12张宝秀周成勇
张宝秀,周成勇
(长治学院,山西 长治 046011)
诺氟沙星-钕金属配合物的合成,表征及其与DNA作用的研究
张宝秀,周成勇
(长治学院,山西 长治 046011)
首次合成了稀土金属钕与氟喹诺酮类药物-诺氟沙星的配合物,并应用荧光光谱法、DNA的热变性和黏度等方法,对该金属配合物与小牛胸腺DNA作用方式进行了研究。配合物与DNA作用时,荧光不发生淬灭,黏度减小;热变性温度基本保持不变;Scatchard图表明配合物对溴化乙锭(EB)与DNA的结合为非竞争性抑制。实验结果一致表明该金属配合物与DNA作用方式为静电结合。
诺氟沙星;钕;小牛胸腺DNA;静电结合
氟喹诺酮类药物是DNA拓扑异构酶II(TopoisomNbase II)的抑制剂,能够选择性地作用于原核生物的拓扑异构酶。DNA的回旋酶的两条链在解开之后,使得药物分子镶嵌在非配对碱基上,阻碍两条链进一步结合。诺氟沙星(Norfloxacin)是第三代喹诺酮类的代表药物之一[1,2],是喹啉的衍生物,具广谱抗菌作用,尤其对需氧革兰阴性杆菌的抗菌活性高,对肠杆菌科的大部分细菌,包括枸椽酸杆菌属、阴沟肠杆菌、产气肠杆菌等肠杆菌属、大肠埃希菌、克雷伯菌属、变形菌属、沙门菌属、志贺菌属、弧菌属、耶尔森菌等在体外具良好抗菌作用。诺氟沙星体外对多重耐药菌亦具抗菌活性。对青霉素耐药的淋病奈瑟菌、流感嗜血杆菌和卡他莫拉菌亦有良好抗菌作用。诺氟沙星作为杀菌剂,通过作用于细菌DNA螺旋酶的A亚单位,抑制DNA的合成和复制而导致细菌死亡。而金属离子对该类药物在体内的活性有重要影响,许多金属离子可与喹诺酮分子中的3位羧基和4位酮基配位形成配合物。对喹诺酮与金属离子配合物的合成和结构以及性质方面的研究已有不少文献报道,并有文献报道了部分配合物的抗菌活性[3-6],但该类配合物与DNA的作用及其抗肿瘤活性却鲜有报道[7]。生物学只有深入到分子水平,才能从本质上探讨生命体系活动的规律。目前,已有不少学者对氟喹诺酮与金属离子的配位化学进行了研究[8-16]。稀土配合物能否作为治疗肿瘤的药物是人们一直关心的问题,曾有一些探索性的研究报道,发现低剂量的稀土配合物对肿瘤细胞有抑制作用[17]。诺氟沙星,其化学名称为:1-乙基-6-氟-1,4-二氢-4-氧代-7-(1-哌嗪基)-3-喹啉羧酸,(其结构见图1),因其抗菌谱较广,过敏反应少,毒副作用轻,已被广泛应用于临床。因此本文合成了稀土钕离子与诺氟沙星的金属配合物(Norf-Nd),并从分子水平研究了该金属配合物与DNA的相互作用。文章旨在为进一步开发诺氟沙星的药用价值以及探索其金属配合物的抗肿瘤活性提供一定的理论基础。这对于了解喹诺酮类药物在人体内与DNA的结合方式及药理作用等具有现实意义。
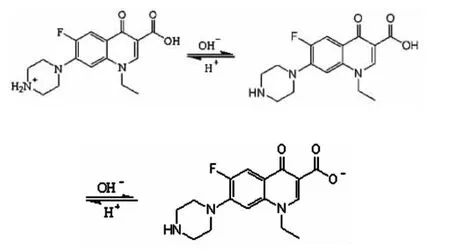
图1 诺氟沙星(Norfloxacin)的结构
1 实验部分
1.1 仪器和试剂
Themofinnigan Polaris质谱仪,Perkin-Elmer 2400型元素分析仪,Bruker DRX-300 MHz核磁共振仪,Shimadiu-FfIR-8300红外仪(KBr压片),Perkin-Elmer LS-50B型荧光光谱仪,Hewlett-Packard 8453型紫外分光光度计,BECKMANΦ50pH计,Ubbelodhe黏度计。
小牛胸腺DNA(华美生物工程公司),溶液纯度以A260 nm/A280 nm>1.8衡量,浓度以260 nm处的吸光度来确定(ε=6600 L.mol-1.cm-1),于4℃冰箱保存备用;缓冲液由0.1 MTris溶液和0.1 M盐酸配制(pH=7.2);诺氟沙星(中国药品生物制品检定所);溴化乙啶(EB)(舒伯韦公司);其他试剂均为国产分析纯试剂。
1.2 实验方法
1.2.1 荧光光谱
固定DNA浓度为12μM,EB浓度为5μM,然后以不同的R(cNd-Norf/cDNA)加入配合物。室温下反应30min,然后以激发波长 520 nm,狭缝Ex=Em=10 nm,在540 nm-720 nm范围内进行扫描。在作Scatchard图时,固定DNA浓度为2.5μM,配合物浓度依次增大,室温下反应30 min,用100μg/mLEB溶液滴定,激发波长520 nm,狭缝Ex=Em=10 nm。数据按Scatchard方程[18]处理,以r/c对r作图(r是与DNA分子中每个核苷酸成键的EB分子数,c是游离EB的浓度)。
1.2.2 黏度测定
小牛胸腺DNA浓度固定为5.0×10-5M,配合物浓度依次增大,温度恒定在(25士0.1)℃,反应30 min,然后用乌氏黏度计进行测量。数据以(η/η0)1/3对配合物浓度作图。η0代表DNA单独存在时的黏度,η代表DNA与配合物作用后黏度。
1.2.3 热变性研究
配制DNA-EB溶液(cDNA/cEB=20)和DNA-EB-Nd-Norf溶液(cDNA/cEB=20,cEB=cNd-Norf),用 Shimadzu循环水浴控制样品槽的温度从25-95℃,在波长260 nm处每隔5℃测定一次样品的紫外吸收。
1.3 配合物的合成
搅拌下,将NdCl3(0.5012 g,2.0 mmol)溶于10 mL水的溶液逐滴加入到诺氟沙星(1.277 g,4.0 mmol)溶于10 mL HCI(0.1 M)的溶液中,滴加完毕后,在反应混合液中加入10 mL甲醇和10mLNaOH(0.1 M)溶液,在室温下搅拌过夜,则生成白色沉淀,过滤后,固体用甲醇洗涤3次。最后再将所得固体用热甲醇-水(1:1)做溶剂进行重结晶,真空干燥,得到配合物的白色固体。
1.4 配合物的表征
1.4.1 一般性质分析
配合物在水中的溶解度大于诺氟沙星;配合物熔点>250℃(诺氟沙星熔点为228℃)。测定配合物的摩尔电导率为 139.2 s cm2mol-1,说明配合物是 1:2型的[19]。
1.4.2 IR图谱分析
配合物与诺氟沙星的主要IR吸收峰对比如表1所示。
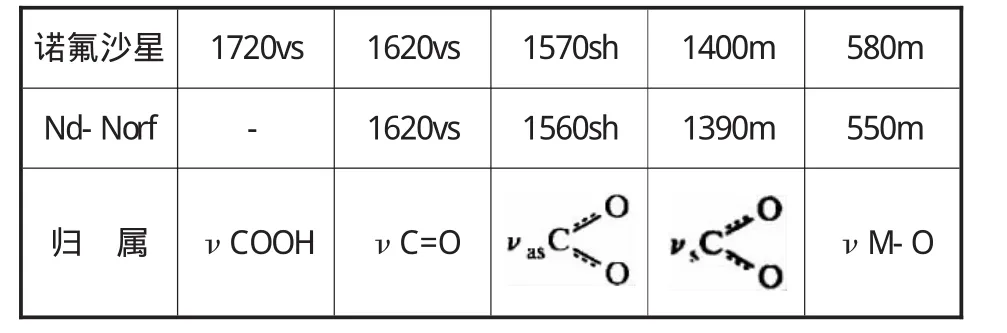
表1 配合物与诺氟沙星主要IR吸峰对比
比较二者的主要红外吸收峰,可以发现在诺氟沙星配体的IR谱图中有两个很强的吸收峰,即1720 cm-l(COOH)和1620 cm-l(C=O),而在配合物的IR谱中,1720 cm-l吸收峰消失,1620 cm-l处的强吸收峰并没有改变。另外,配合物在1560 cm-1和1390 cm-1处出现2个吸收峰。根据文献[20]我们知道羧基负离子-COO-在1610-1550 cm-l和1400 cm-1左右可出现2个吸收峰和。因此我们可以判断配体诺佛沙星和金属Nd3+是以双齿进行配位,这和1720 cm-l处强吸收峰的消失也是一致的。另外,由于羧基负离子-COO-中两个C-O键的共轭关系使得两个C-O键发生平均化,新的振动吸收峰在550 cm-l出现,因此我们可将其归属于Nd-O键。
1.4.3 H1NMR分析
诺氟沙星的 H1NMR中质子的 δ 值为[21]:1.51(3H,CH3),3.61(8H,哌 嗪 CH2),4.42(2H,CH2),7.02(1H,8-H),7.30(1H,5-H),8.58(1H,2-H),和 10.08(1H,COOH)。在配合物的H1 NMR谱中,除δ10.08的吸收峰消失外,其它吸收峰的δ值变化不大(<0.2 ppm.)。
1.4.4 元素分析和质谱分析
元素分析:理论值(%),C,45.09;N,9.86;H,4.49。测定值(%),C,45.06;N,9.82;H,4.52。 质 谱 分 析 MS(FAB)m/z(%):852.37(M+,100.0)。
1.4 配合物的结构
根据以上测定数据推断配合物Nd-Norf的可能结构为图2
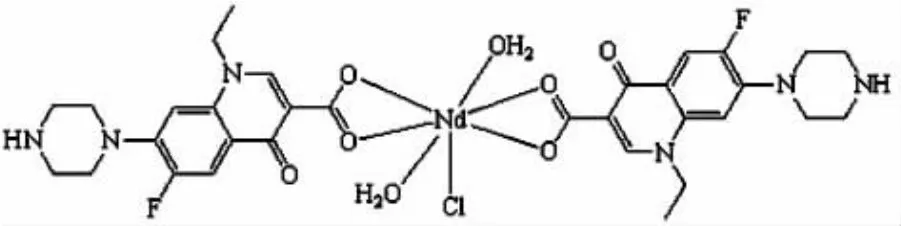
图2 配合物Nd-Norf的推断结构
2 结果与讨论
2.1 荧光光谱研究
2.1.1 配合物对DNA-EB荧光光谱的影响
溴化乙锭(EB)为一共扼平面分子,本身荧光很弱,但能专一性地插入DNA双螺旋或三螺旋内部的碱基对之间使荧光显著增强,当配合物以插入方式与DNA结合时,EB会从DNA碱基对中被挤出,荧光发生猝灭;若为静电结合,EB则不会被挤出,荧光不发生淬灭。因此EB可作为DNA的结构探针[22]。由图3可看出,在缓冲溶液中,随着Nd-Norf配合物浓度的不断增加,DNA-EB荧光基本不变,说明Nd-Norf配合物与DNA是以静电方式相互作用。
2.1.2 配合物对DNA-EB抑制作用类型分析
利用配合物存在下DNA与EB作用的Scatchard图可判别配合物的作用方式[23]。如图4,在不同浓度的配合物存在下,Scatchard图是几条平行线,表明随着配合物浓度的增大,DNA与EB的结合常数和键合位点数都没发生改变,证明配合物与EB在DNA上的结合位点是非竟争型的,从而表明Nd-Norf配合物与DNA是以静电方式相互作用。
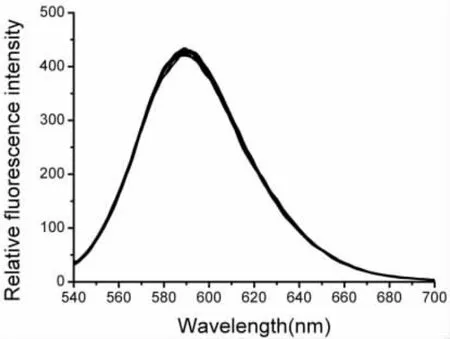
图3 EB-DNA复合物与Nd-Norf配合物作用的荧光光谱[Nd-Norf]/[DNA-EB]=0,0.2,0.4,0.6,0.8,1.0 。
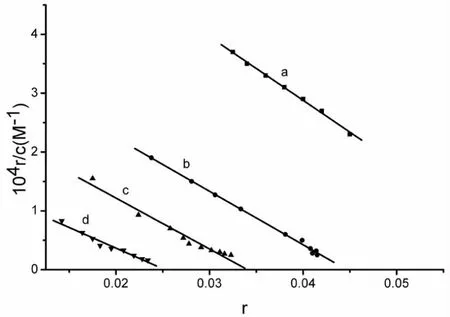
图4 不同浓度的[Nd-Norf]存在下DNA与EB作用的Scatchard图[DNA]=2.5μM从上到下[Nd-Norf]/[DNA]=0,0.25,0.5,1.0.
2.2 黏度研究
具有光学活性的光物理探针对于探讨键合模式一般可提供必要但不是充分的证据[24]。在缺乏晶体数据的情况下,黏度测定一般被认为是确定键合模式最有力的证据之一[25]。
黏度对分子长度变化非常敏感。当小分子配合物以经典插入方式与DNA相互作用时,DNA相邻碱基对的距离会增大以容纳插入的配合物分子,导致DNA螺旋伸长,相应DNA黏度增加。DNA本身是一多聚阴离子,在溶液中,由于负电荷之间的相互静电排斥,使DNA大分子较为伸展。而当配合物阳离子与DNA带负电荷的磷酸氧基团以静电作用结合时,使得DNA的负电荷被部分中和,导致DNA螺旋收缩,分子长度变小,相应DNA黏度降低。从图5可以看出,DNA与Nd-Norf配合物相互作用后,DNA黏度值随配合物浓度的增加而降低,因此进一步确定了Nd-Norf配合物是以静电方式与DNA相互作用。
2.3 配合物与CT-DNA作用的热变性实验
通过测定DNA的热变性温度(tm)可以判断配合物与DNA的作用模式。配合物与DNA发生插入作用时,将稳定DNA的双螺旋结构,并使tm急剧上升;而配合物仅与DNA通过静电作用发生外部键合时,则tm上升幅度较小(一般<0.6℃)或不上升[26]。如图6所示,在本实验条件下,DNA的tm为80℃(a),而当DNA与配合物Nd-Norf作用后,其tm仍为80℃(b),其热变性温度(tm)并未发生改变。这一现象又进一步表明Nd-Norf配合物是通过静电方式和DNA相互作用。
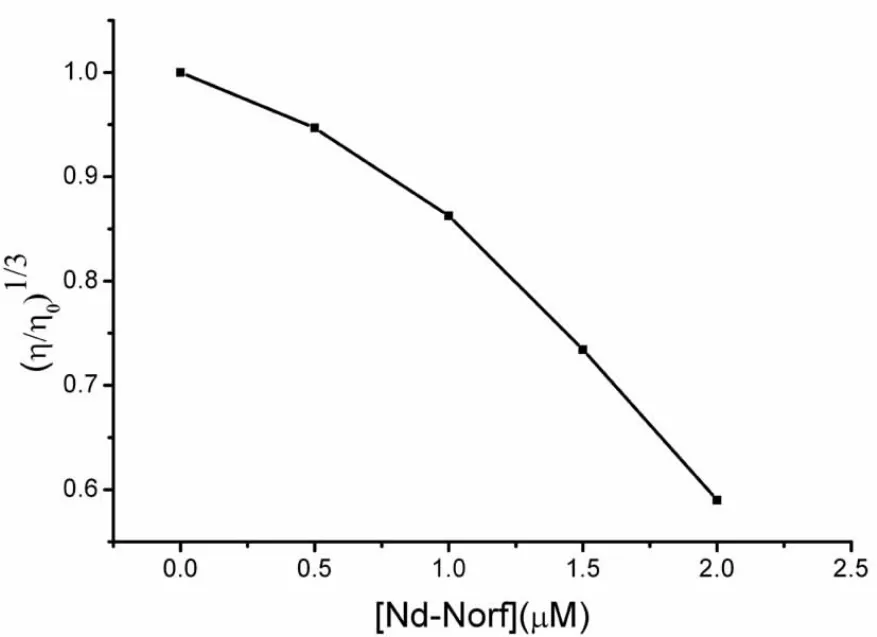
图5 随配合物浓度增加DNA的黏度变化图[Nd-Norf]=0,0.5,1.0,1.5,2.0μM
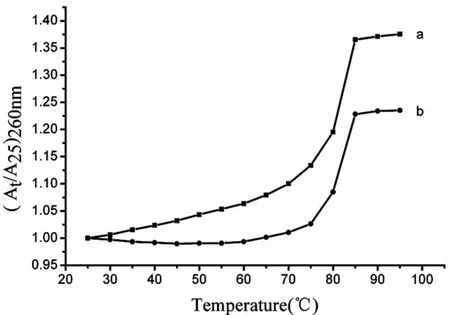
图6 DNA热变性曲线图
3 结论
综上所述,文章合成了新的诺氟沙星-钕金属配合物,并应用荧光光谱法、DNA的热变性和黏度等方法,对该金属配合物与小牛胸腺DNA作用方式进行了研究。配合物与DNA作用时,荧光不发生淬灭,DNA的热变性温度不变,黏度降低,Scatchard图表明配合物对溴化乙锭(EB)与DNA的结合为非竞争性抑制。这些实验结果都一致表明,诺氟沙星-钕金属配合物与DNA作用方式为静电结合,即配合物通过其金属离子所带的正电荷与DNA磷酸骨架上磷酸基所带的负电荷相互作用。本研究从分子水平为进一步开发诺氟沙星的药用价值以及探索其金属配合物的抗肿瘤活性提供了一定的理论基础。
[1]Buckton G,Russel S J,Beezer A E.On the Curracy of Results forMMicrocalorimetric Measurements on Cellular systems[J].ThermochiMActa,1991,6(22):193-195.
[2]Hao Li-xia,Li Bao-xin,Zhang zhu-jun.Interaction of Norfloxacin with Bovine SeruMAlbumin[J].Journal of Shaanxi Normal University (Natural Science Eition),2002,30(2):73-75(Ch).
[3]RUIZ M, PERELLOL,ORTIZ R,et a1.Synthesis,characterization, and crystal structure of [Cu(cinoxacinate)2]·2H2O complex:A square-planar CuO4 chromophore.antibacterial studies[J].J.lnorg.Bioehem.,1995,(59):801-810.
[4]GAO Fei, YANG Pin, XIE Jun, et a1.Synthesis,characterization and antibacterial activity of novel Fe(Ⅲ),Co(Ⅱ),and Zn(Ⅱ)complexes with norfloxacin[J].J.lnorg.Biochem.,1995,(60):61-67.
[5]TUREL I,LEBAN I,KLINTSCHAR G,et a1.Synthesis,crystal structure,and characterization of two metalquinolone compounds[J].J.lnorg.Biochem., 1997,(66):77-82.
[6]TUREL I,LEBAN I,BUKOVEC N.Crystal structure and characterization of the bismuth(Ⅲ)compound with quinolone familymember(ciprofloxacin)antibactrial study[J].J.lnorg.Bioehem.,1997,(66):24l-245.
[7]王国平,朱龙观,俞庆森.含氟喹诺酮双核铜(II)配合物的合成、晶体结构和生物活性[J].无机化学学报,2003,19(2):179-182.W ANGGuo-ping,ZHULong-guan,YU Qingsen. Synthesis, crystal structure, antibacterial and antitumor activities of a new binuclear copper(Ⅱ)complexcontaining fluoroquinolone[J].Chin J.Inorg.Chem.,2003,19(2):179-182.
[8]WALLIS S C,GAHAN L R,CHARLES B G,eI a1.Copper( Ⅱ) complexes of the fluoroquinolone antibacterial ciprofloxacin synthesis,X-ray structural characterization,and potentiometric study[J].J.Inorg.Biochem.,1996,6(2):1-16.
[9]YANG Pin,LI Jia-bin,TIAN Yan-ni,et a.Synthesis and crystal structure of rare earth complex with ciprofloxacin[J].Chin Chem.Lett.,1999,10(10):879-880.
[10]TUREL I,GOLIC L,BUKOVEC P,et a1.Antibacterial tests of bismuth (II) -qinolone (ciprofloxacin, cf)compounds against helicobacter pylori and some other bacteria crystal structure of (cfH2)2[Bi2C1l0]·4H2O[J].J.Inorg.Biochem.,1998,(71):53-60.
[11]PRASANNA MD, GURU R T.Hydrogen bonded networks in hydrophilic channels:crystal structure of hydrated ciprofloxacin lactate and comparison with structurally similar compounds [J]. J. Molecular Structure,2001,559:255-261.
[12]TUREL I,GOLIC,RAMIREZ O L R.Crystal structure and characterization of a new copper(Ⅱ)-ciprofloxacin(cf)complex[Cu(cf)(H2O)3]SO4·2H2O[J].Acta ChiMSlov,199,46(2):203-211.
[13]WANG Guo-pin,ZHU Long-guan.Synthesis and crystal structure of a new copper(Ⅱ)complex containing fluoroquinolone [A].Frontiers of Solid State Chemistry[C].Singapore:World Scientific Press,2002,327-331.
[14]TUREL I,BUKOVEC N,FARKASE.Complex formation between some metals and quinolone family member(ciprofloxacin) [J].Polyhedron,1996,15 (2):269-275.
[15]王国平,雷群芳.氟哌酸铜配合物的合成、电子顺磁共振波谱与抗菌活性[J].浙江大学学报(理学版),2003,30(2):92-96.W ANG Guo-ping,LEIQun-fang.Synthesis,electron paramagnetic resonance properties and antibacterial studies of copper(Ⅱ)complex containing norfloxacin [J]. Journal of Zhejiang University(Science Edition),2003,30(2):92-96.
[16]王国平,蔡国强,朱龙观.具二维网格的氟喹诺酮类配合物的合成和晶体结构[J]. 无机化学学报,2000,16(6):987-990.WANG Guo-ping, CAI Guo-qiang, ZHU Longgua.Synthesis and crystal structure of fluroquinolone complex of copperwith two-dimension network[J].China J.Inorg.Chem.,200,16(6):987-990.
[17]王宗惠,苏英,庞新民.混合硝酸稀土对人正常细胞及癌细胞生长作用的体外观察[J].卫生毒理学杂志,1994,8(3):197-199.WANG Zong-hui,SU Yin,PANG Xinmin.In vitro examination of inhibitory activity of mixed nitrate of rare earth compounds against human normal celland cancer cell Lines[J].J.Health Toxicology,1994,8(3):197-199.
[18]YANG P,GUO ML.Interaction of some non-platinuMmetal anticancer complexeswith nucleotides and DNA and Two-Pole Complementary Principle (TPCP) arising therefrom[J].Metal Based Drugs 1998,(5):41-58.
[19]Geary WJ.The use of conductivity measurements in organic solvents for the characterisation of coordination compounds:[J]Coord.Chem.Rev.1971,7(1):81-122.
[20]NakashiK,Solomon PH.Infrared Adsorption Spectroscopy,translated into Chinese by C.Wang[J]Chinese Academic Press,Peking,1984,Ch.2.
[21]Kaga H,Itoh A,Murayama S,Suzue S,Irikura T.Structure-activity relationships of antibacterial 6,7-and 7,8-disubstituted1-alkyl-1,4-dihydro-4-oxoquinoline-3-carboxylicacids.J.Med.Chem.1980,23(12):1358-1363.
[22]Mulqueen,P.,Tingey,J.M.;Horrocks,W.D..[J] Biochemistry 1985,(24):6639-6645.
[23]M.F.Tweedle,L.J.Wilson[J].J.Am.Chem.Soc.1976,(98):4824-4833.
[24]Sigman,D.S.;Mazumder,A;Perrin,D.M..[J]Chem.Rev.1993,(93):2295-2316.
[25]Satyanarayana,S.;Dabrowiak,J.C.;Chaires,J.B..[J]Biochemistry 1992,31(39):9319-9324.
[26]靳兰,杨频,李青山.荧光法研究手性金属配合物与DNA 的作用机理[J]. 高等学校化学学报,1996,(17):1345-1348.
Abstract:A new Nd(Ⅲ)complex of Nd-Norf(here,Norf=Norfloxacin)have been synthesized and characterization.Its interaction with calf thymus DNA has been firstly investigated using fluorescent spectra,thermal denaturation and viscosity measurements.The experimental results show conformably that the mode of binding of the complex Nd-Norf to DNA is unclassical electrostatic action.
Keywords:DNA-binding;neodymium;Norfloxacin;calf thymus DNA
(责任编辑 王璟琳)
Synthesis,Characterization and Studieson DNA-binding of a New Nd(Ⅲ)Complex with Norfloxacin
ZHANG Bao-xiu,ZHOU Cheng-yong
(Changzhi University,Changzhi,Shanxi046011)
R914
A
1673-2014(2010)05-0008-05
2010—06—27
张宝秀(1964— ),女,山西陵川人,高级工程师,主要从事药物化学方面的研究。
