卵巢催乳素受体mRNA在小鼠卵泡发育及排卵过程中的表达
2010-09-11罗爱月杨书红赖志文卢运萍王世宣
罗爱月 杨书红 沈 薇 丁 婷 赖志文 王 毅 卢运萍 王世宣
(华中科技大学附属同济医院妇产科,武汉430030)
卵巢催乳素受体mRNA在小鼠卵泡发育及排卵过程中的表达
罗爱月 杨书红 沈 薇 丁 婷 赖志文 王 毅 卢运萍 王世宣*
(华中科技大学附属同济医院妇产科,武汉430030)
目的 探讨卵巢催乳素受体(Prolactin receptor,PRLR)mRNA在小鼠不同发育阶段及排卵过程中的表达情况。方法 选择不同发育时期的昆明小鼠,以及性未成熟昆明小鼠予以PMSG-HCG(Pregnancy Mare Serum Gonadotrophin- Humane chorionic gonadotrophin,孕马血清促性腺激素-人绒毛膜促性腺激素)序贯处理,采用实时定量聚合酶链反应(Real-Time Polymerase Chain Reaction,Real-Time PCR)检测小鼠卵巢中PRLR mRNA的表达。结果 PRLR mRNA的表达水平随小鼠的不断发育而显著性升高,PRLR在6周龄小鼠卵巢中的表达量是3周龄小鼠的3.86倍(P<0.01),11周龄与33周龄小鼠的表达水平分别是3周龄小鼠的19.67倍、19.81倍(P<0.01);PMSG处理后12h,PRLR表达水平是对照组的1.44倍(P<0.05),24h、48h后分别达到5.48倍和7.14倍(P<0.01),HCG处理后4h、8h、12h,PRLR表达水平有所下降,但仍高于对照组(P<0.01),24h、48h后其表达水平再次升高,分别是对照组的5.64倍和6.04倍。结论 PRLR对小鼠卵泡的生长、发育及其黄体形成与维持发挥重要作用。
催乳素受体;卵泡发育;排卵;Real-Time PCR
卵泡的募集、生长、成熟、排卵及排卵后黄体形成,以及绝大部分卵泡在不同发育阶段的闭锁等一系列过程,受到各种因素的复杂调控。下丘脑-垂体-卵巢轴(Hypothalamus-Pituitary-Ovary axis,H-P-O axis)分泌的激素是其中重要的调节因素之一,而卵巢本身表达的各种细胞因子对卵泡的正常发育不可或缺。催乳素受体(Prolactin Receptor,PRLR)是一个跨膜蛋白,属于细胞因子受体超家族,因其不同的剪切方式,存在长形和短形两种形式[1]。这两种形式的受体其生物学功能在不同的组织中有所差别。如乳腺组织中主要为长形PRLR,其通过JA K/STAT信号转导及转录激活途径介导乳蛋白基因的表达[2-3];而肝脏组织中大量表达的短形PRLR可能与肝脏本身的受体调节及肝细胞功能调控有关[4]。在生殖系统中长短型受体均有表达。PRLR与大鼠的动情周期及动物的繁殖能力密切相关[5-7];其表达受到性腺激素的调节[8];且在卵巢早衰的发生发展中起重要作用[9]。本文在mRNA水平检测PRLR前体在不同发育阶段小鼠卵巢及排卵过程中的表达情况,旨在为PRLR在卵泡发育过程及卵巢功能中的进一步研究奠定基础。
材料和方法
1 实验动物
昆明小鼠购自华中科技大学同济医学院动物中心。选择3、7、11、33周龄小鼠各10只。另3周龄小鼠50只予以 PMSG(杭州动物药品厂产品) 10U/只腹腔注射,其中25只小鼠在PMSG注射48h后再给予 HCG(丽珠制药集团产品)10U/只腹腔注射;设 PMSG注射后4、8、12、24、48h组,及HCG注射后4、8、12、24、48h组,每组各5只;另取5只3周龄小鼠不予PMSG-HCG处理,设为对照组。颈椎脱臼法处死小鼠后,迅速取出双侧卵巢置入-80℃保存,以供提取总RNA。
2 实时定量聚合酶链反应(Real-Time Polymerase Chain Reaction,Real-Time PCR)
2.1 RNA提取和检测
采用 Trizol法提取总RNA。取出储存于-80℃的卵巢组织加入 1ml Trizol研磨至碎;再加入200μl氯仿剧烈震荡15s,室温静置10min,4℃离心(12000rpm ×8min),吸取上层水相;加入等体积预冷的异丙醇,置于-20℃30min以上,4℃离心(12000rpm×12min),留取沉淀;75%乙醇(无RNase三蒸水配制)漂洗,干燥后以20μl无RNase三蒸水溶解 RNA沉淀;并测定所提取RNA的浓度和纯度。
2.2 Real-Time PCR反应引物
在 NCBI(http://www.ncbi.nlm.nih.gov)中搜索小鼠PRLR核苷酸序列号NM_011169,委托 Takara公司设计Sub Green荧光嵌合法的Real-Time PCR反应引物,由上海 Sangon公司合成。PRLR引物序列(5’-3’):上游引物AACATGCCATCTGCACTTGCTTAC,下 游 引 物 TCCATCTGACCCAGGA TTCCA。同时以3-磷酸-甘油脱氧酶(GAPDH)作为内参。GAPDH引物序列(5’-3’):上游引物 TGTGTCCGTCGTGGATCTGA,下游引物TTGCTGTTGAAGTCGCAGGAG。
2.3 Real-Time PCR反应体系、条件及mRNA表达量计算
反应体系含2×SYBR Premix Ex Taq混合物10μl,引物前后链各0.5μl,cDNA 1μl,加灭菌双蒸水至20μl。置DNA Engine Opticon 2连续荧光检测系统扩增,条件为95℃2min,95℃10s,退火温度20s,72℃20 s,共40个循环。反应完毕后从95℃-55℃,每下降0.4℃记录一次荧光强度作溶解曲线。同一样本在同一批反应中包括GAPDH和目的基因,每一反应设3个复孔。每一样本重复检测2次。检测样本中目的基因mRNA的相对表达量:待测基因cDNA进入PCR指数增长期的起始点即为循环阈值(Cycle threshold,Ct)。以每个样本在同一批反应中的 GAPDH为内参照,计算样本△Ct值,再以对照组的△Ct值为参照,计算实验组△△Ct值,根据公式计算mRNA相对表达量[10]:

3 统计学处理
数据分析采用SPSS13.0计算机统计软件,进行T-检验分析。以 P值小于0.05为有统计学意义。
结 果
1 PRLR在不同周龄小鼠卵巢中的表达情况
PRLR mRNA的表达水平与小鼠的周龄密切相关。以3周龄组为参照,其余各组与之相比较,计算各组mRNA相对表达水平。6周龄组与3周龄组相比较其表达水平明显增高(P<0.01);11周龄组和33周龄组均分别与3周龄组、6周龄组相比,其表达水平均具有显著性差异(P<0.01),但11周龄组与33周龄组相比表达水平无统计学差异(P>0.05),见图1。
2 PRLR在小鼠排卵过程中的表达情况
采用PMSG-HCG处理性成熟前小鼠,建立小鼠排卵模型。检测排卵过程中小鼠卵巢 PRLR mRNA的表达。在PMSG处理后12h,PRLR表达水平升高,是对照组(未处理组)的1.44倍,有显著性差异(P<0.05),24h、48h后其表达水平分别为对照组的5.48倍和7.14倍(P<0.01);HCG处理后4h、8h、12h,PRLR表达水平有所下降,但与对照组相比仍有显著性差异(P<0.01),在HCG处理后24h、48h,其表达水平再次升高,分别达5.64倍和6.04倍(P<0.01),见图2。
讨 论
多项研究结果认为,PRLR在生殖系统中扮演重要角色。PRLR缺失的雌性小鼠其繁殖能力下降,且可能出现植入前胚胎发育的完全停滞[11]。Kang B[7]与Liu W[6]等分别报道 PRLR与家禽的产卵数和哺乳动物的繁殖性能直接相关。本研究显示PRLR的表达水平随小鼠卵巢的发育而不断增高。在性成熟期前(3周龄)的小鼠卵巢中PRLR呈相对低水平表达,进入性成熟期(6周龄)后其表达量明显增加,而在繁殖适龄期(11周龄、33周龄)的小鼠其表达量更高,是性成熟前的近20倍,性成熟期的5倍之多。这一结果从另一角度说明了PRLR与卵巢功能及生殖能力的关系。
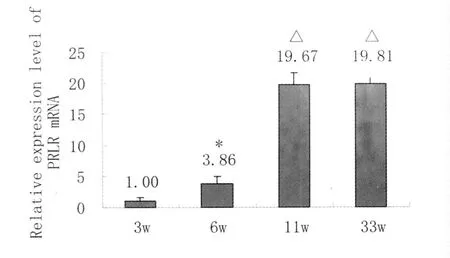
Fig.1 PRLR expression of the mouse ovary in different developmental stages注:*与3周龄组相比有显著性差异(compared with 3Wand 6W)P<0.01。△分别与3周龄组、6周龄组相比,有显著性差异(compared with 3W)P<0.01。

Fig.2 PRLR expression during the process of mouse ovulation注:*与对照组相比有显著性差异(compared with the control),P<0.05。△与对照组相比(compared with the control)P<0.01。
此外,PRLR表达水平随大鼠的不同动情周期而改变。在动情前期其表达量最高,在动情期随即下降,而在动情后期又恢复高水平表达[5]。本文采用尚未建立动情周期且不含有成熟卵泡的性成熟期前小鼠进行PMSG-HCG序贯注射,建立小鼠排卵模型,使各组内实验标本的同质性更高;同时模拟成熟小鼠的动情周期,并且能够更精确的掌握动情周期的每个时间点。PMSG、HCG分别模拟体内FSH(Follicle-Stimulating Hormone,促卵泡激素)、LH(Luteinizing Hormone,促黄体激素)在排卵过程中的表达及效应发挥。PMSG促进卵泡的发育和募集,本实验中 PMSG注射后12h, PRLR表达出现上升趋势,有学者报道 PRLR能够通过促进卵泡细胞的增殖影响卵泡的发育和成熟[12],本研究结果与之相吻合。而在 PMSG注射后24h直至48h后,相当于动情前期阶段即优势卵泡募集阶段,PRLR呈高水平表达。优势卵泡的募集必然伴随FSH的高表达,而颗粒细胞中的FSH能够诱导 PRLR的合成[12]。序贯的 HCG表达高峰使得排卵成为可能,通常在 HCG注射后10-12h发生排卵。本研究中,HCG注射后PRLR表达水平显著下降,直到24h才恢复高水平表达并持续到注射后的48h。在排卵时间点 PRLR表达量降低,与Clarke等[5]的 PRLR在动情期低表达这一研究结果相一致。排卵后的黄体形成时期,本研究中PRLR再度升高,新近研究表明 PRLR的表达能够直接导致LH受体的生成,从而满足黄体形成及维持的需要,并且协同LH调控卵巢黄体的功能[13]。
综上,PRLR在卵泡的募集、发育、成熟以致排卵及排卵后的黄体形成等一系列过程中发挥着重要作用,但该作用究竟通过何种信号途径,其中有哪些相关因子参与,值得我们更进一步的研究。
[1]Walker AM.Prolactin receptor antagonists.Curr Opin Investig Drugs,2005,6:378-385
[2]García-Martínez JM,Calcabrini A,González L,et al.A non-catalytic function of the Src family tyrosine kinases controls prolactin-induced Jak2 signaling.Cell Signal, 2010,22(3):415-426
[3]Bratthauer GL,Stamatakos MD,Vinh TN.Cells with minimal expression of the JAK/STAT pathway related proteins STAT5a and the prolactin receptor:evidence of an alternate prolactin receptor isoform in breast disease.Protein Pept Lett,2010,17(1):104-108
[4]Simon-Holtorf J,Mönig H,Klomp HJ,et al.Expression and distribution of prolactin receptor in normal,fibrotic,and cirrhotic human liver.Exp Clin Endocrinol Diabetes,2006,114:584-589
[5]Clarke DL,Arey BJ,Linzer DI.Prolactin receptor messenger ribonucleic acid expression in the ovary during the rat estrous cycle.Endocrinology,1993,133:2594-2603
[6]Liu W,Wang J,Li Q,et al.Correlation analysis between three novel SNPs of the Src gene in bovine and milk production traits.Mol Biol Rep,2010 Mar 9.[Epub ahead of print]
[7]Kang B,Guo JR,Yang HM,et al.Differential expression profiling of ovarian genes in prelaying and laying geese.Poult Sci,2009,88(9):1975-1983
[8]Shao R,Nutu M,Weigdegard B,et al.Differences in prolactin receptor(PRLR)in mouse and human fallopian tubes:evidence for multiple regulatory mechanisms controlling PRLR isoform expression in mice.Biol Reprod,2008,79(4):748-757
[9]Halperin J,Devi SY,Elizur S,et al.Prolactin signaling through the short form of its receptor represses forkhead transcription factor FOXO3 and its target gene galt causing a severe ovarian defect.Mol Endocrinol,2008,22(2):513-522
[10]Aerts JLE,Vandekerckhove P.Quantification of mRNA expression for human TGF-β1,TNF-α,TNFR1, TNFR2 and fas using real-time quantitative reverse transcriptase PCR.Biotechnol Lett,2002,24:47-52
[11]Kelly PA,Binart N,Lucas B,et al.Implications of multiple phenotypes observed in prolactin receptor knockout mice.FrontNeuroendocrinol,2001,22: 140-145
[12]Binart N,Bachelot A,Bouilly J.Impact of prolactin receptor isoforms on reproduction.Trends Endocrinol Metab,2010,21(6):362-368
[13]Bachelot A,Beaufaron J,Servel N,et al.Prolactin independent rescue of mouse corpus luteum life span:identification of prolactin and luteinizing hormone target genes.Am J Physiol Endocrinol Metab,2009,297: E676-684
EXPRESSION OF OVARIAN PROLACTIN RECEPTOR mRNA DURING FOLLICULARDEVELOPMENT AND OVULATION IN THE MOUSE
Luo Aiyue,Yang Shuhong,Shen Wei,Ding Ting,Lai Zhiwen,Wang Yi,Lu Yunping,Wang Shixuan
(Department of Obstetrics and Gynecology,Tongji Hospital,Huazhong University of Science and Technology,Wuhan430030,China)
Objective To explore the expression of prolactin receptor(PRLR)mRNA in the different developmental stages of the mouse ovary and the procedure of ovulation.Methods Mouse ovaries of different developmental stages were collected.The immature mice were chosen to be treated with PMSG and HCG sequentially and the ovaries were collected at various time.The expression of PRLR was detected by real time polymerase chain reaction(Real-Time PCR).Results The expression of PRLR was increased with the development of the mouse.PRLR expression of 6-week-old mice was 3.84 fold of 3-weekolds(P<0.01).The expression levels of 11 and 33-week-olds were 19.67 and 19.81 fold respectively of 3-week-olds(P<0.01).The expression of PRLR was increased after 12h of PMSG treatment(P<0.05) and 5.48 and 7.14 fold respectively of the control after 24h and 48h(P<0.01).After the sequential treatment of HCG,the expression level was significantly decreased but still higher than that of the control until 24h(P<0.01).PRLR expression at 24h and 48h post-HCG treatment was 5.48 and 7.14 fold of the control respectively(P<0.01).Conclusion PRLR may be involved in folliculogenesis and play an important role in the formation and maintenance of corpus luteum in the mouse ovary.
Prolactin receptor;Folliculogenesis;Ovulation;Real-time PCR
R711.7
A
10.3870/zgzzhx.2010.04.017
2010-03-08
2010-04-26
罗爱月,女(1978年),汉族,博士研究生
*通讯作者(To whom correspondence should be addressed)
