二氢叶酸还原酶基因在斑马鱼神经系统发育过程中的作用
2010-09-09孙淑娜桂永浩蒋璆钱林溪宋后燕
孙淑娜,桂永浩,蒋璆,钱林溪,宋后燕
研究报告
二氢叶酸还原酶基因在斑马鱼神经系统发育过程中的作用
孙淑娜1,桂永浩1,蒋璆2,钱林溪2,宋后燕2
(1.复旦大学附属儿科医院,上海 201102;2.复旦大学分子医学教育部重点实验室,上海 200032)
目的观察二氢叶酸还原酶基因(DHFR)功能阻抑斑马鱼胚胎的颅脑部发育情况,初步探讨二氢叶酸还原酶基因在斑马鱼神经系统发育过程中的作用。方法采用显微注射吗啡啉修饰的反义核苷酸(MO)的方法进行DHFR表达阻抑。胚胎发育至受精后48 hpf观察胚胎的颅部发育情况,在60 hpf时经石蜡切片进一步观察胚胎的脑发育状况。利用胚胎整体原位杂交的方法检测影响神经系统发育的关键因子ngn1和huc的表达情况。结果显微注射MO可成功的进行DHFR表达阻抑。DHFR表达阻抑组胚胎存在颅脑部发育明显异常和ngn1、huc的表达强度明显减弱,且与显微注射的MO剂量呈正相关。结论DHFR在斑马鱼颅脑发育中有重要作用;其功能阻抑可导致胚胎颅脑部发育异常,其机理与ngn1和huc的的表达减弱有关。
二氢叶酸还原酶基因;神经系统;斑马鱼
叶酸是一种十分重要的维生素,其可通过转运一碳单位而对嘌呤、嘧啶、核酸、蛋白质的合成以及细胞的分裂和生长有重要作用。如果孕早期妇女体内叶酸生物学活性发挥受抑制,会影响胎儿大脑和神经系统的正常发育,并导致神经管缺陷[1]。神经管是胎儿中枢神经系统的前身,可分化为脑和脊髓;神经管缺陷是一组累及颅骨、脑和脊椎的常见而严重的先天异常,是导致围生儿死亡的主要原因之一。近年来研究显示叶酸对于胚胎神经系统发育十分重要[2,3],孕妇在胚胎发育早期补充叶酸能有效预防胎儿发生神经管畸形[4,5]。二氢叶酸还原酶(DHFR)是叶酸发挥生物学作用过程中的重要因子,其功能被阻抑可造成生物体内叶酸缺乏的模式[6]。本实验在新兴模式生物斑马鱼中开展;观察二氢叶酸还原酶基因(DHFR)功能阻抑对颅脑发育以及对神经系统发育重要因子ngn1和huc表达的影响;为探寻DHFR在神经系统发育过程中的作用提供依据,也期望为临床上治疗和预防叶酸缺乏导致的胎儿神经管发育缺陷提供线索。
1 材料和方法
1.1 实验动物
野生型斑马鱼(AB系)购自美国Oregon大学,养殖系统从美国Aquatic Habitats公司引进[7]。受精卵置于孵化液(60 μg/m L海盐)28°C孵化,出绒毛膜后在胚胎培养液内养育,每天更换胚胎培养液。受精卵按照Kimmel等[8,9]描述对发育阶段分期,用于原位杂交的胚胎受精后24 hpf(24 hours post fertilization)始用0.003%苯硫脲(PTU)处理以防止黑色素的形成。
1.2 主要实验试剂
构建基因探针及原位杂交所用试剂主要购自Promega公司、美国罗氏公司、Takara公司。Realtime PCR所用SYBR Green荧光染料购自美国罗氏公司。
1.3 DHFR表达阻抑以及阻抑效率验证
阻抑DHFR表达的MO(morpholino oligonucleotides,吗啡啉修饰的反义核苷酸)以及Con MO由美国GENE TOOLS公司设计以及合成。共设计并合成两个阻抑DHFR表达的MO,每个MO都可特异性的作用于翻译起始位点ATG附近,阻断DHFR的翻译(图1 A)。将MO1与MO2(两个不同的吗啡啉修饰的反义核苷酸)同时进行显微注射以增加DHFR表达阻抑的可靠性。DHFR MO1:5’-ACGGTCTCGCCTTCTTCCCGCCAAG-3’,DHFR MO2:5’-CAGTTAACAAGTCACGCTGGCTACT-3’;对照MO:5’-CCTCTTACCTCAGTTACAATTTATA-3’,DHFR MO以及对照MO溶解于30%的Danieau溶液中。注射剂量为MO I(MO1 2.5 ng+MO2 2.5 ng),MO II(MO1 5 ng+MO2 5 ng),每组注射50枚胚胎,实验重复3次。
在验证显微注射DHFR MO可使DHFR表达阻抑,我们构建了pT7TS-DHFR-GFP(绿色荧光蛋白基因)融合质粒,其在胚胎体内可转录DHFR-GFP融合蛋白(图1 B)。DHFR-GFP融合质粒被稀释液稀释为60 μg/m L(溶液:0.1%酚红,0.2 mol KCl,pH= 7.0)。将1~2个细胞期的受精卵分为3组,每组50枚胚胎,分别显微注射8 nL DHFR-GFP(绿色荧光蛋白)融合质粒、8 nL DHFR-GFP融合质粒+6 nL DHFR MO I以及8nL DHFR-GFP融合质粒+6nL DHFR MO II。在8 hpf于荧光显微镜下观察各组胚胎的GFP表达情况。若DHFR MO成功阻抑DHFR表达,GFP(绿色荧光蛋白)的生成将明显减少(图1 C)。每组注射50枚胚胎,每组重复3次实验。
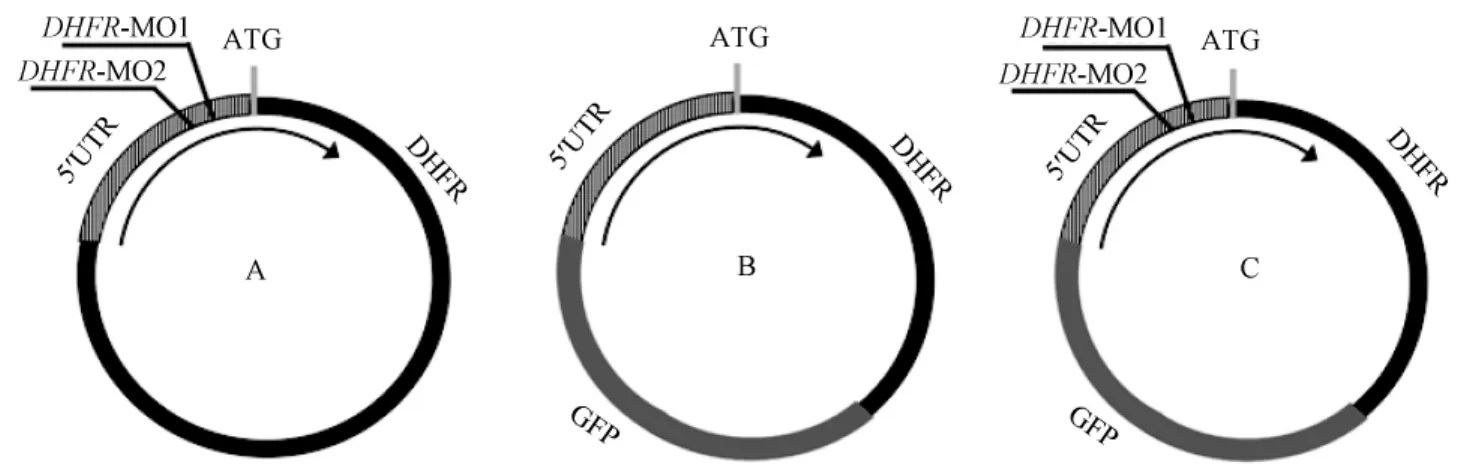
图1 DHFR功能阻抑以及阻抑效率验证的示意图Fig.1 The sketch maps of DHFR inhibition and verification of the inhibition effects.
1.4 基因探针制备及胚胎整体原位杂交
抽提斑马鱼胚胎48hpf总RNA后,经RT-PCR逆转录获得cDNA。以逆转录获得的cDNA为模板进行PCR扩增特异性基因序列作为原位杂交的探针片段。将PCR产物切胶回收,连接入PGEM-T载体中,经测序验证后,获得含有ngn1以及huc cDNA片段的质粒。利用内切酶将其线性化后,体外转录反义RNA探针(地高辛标记)。胚胎的固定及原位杂交按照已完善的步骤进行[10,11]。进行原位杂交时每组20枚胚胎,实验重复3次。
1.5 数据处理
所有数据以均数±标准差表示,数据统计应用spss11.5软件,均值之间的差异显著性用双侧t检验。
2 结果
2.1 显微注射DHFR MO可阻抑DHFR的表达
8 hp f时荧光显微镜下进行观察的结果发现,DHFR-GFP融合质粒注射组胚胎有较强的GFP表达(图2 A,D),DHFR-GFP融合质粒+DHFR MO I注射组胚胎(44.6±4.16)(图2 B,E)以及DHFRGFP融合质粒+DHFR MO II注射组胚胎(45.0± 2.00)(图2 C,F)的GFP表达明显减弱。此结果说明显微注射DHFR MO可使DHFR表达阻抑。图2见彩插6。
2.2 叶酸缺乏对脑发育影响的形态学观察
光镜下对各组胚胎48 hpf头颅部发育的观察结果发现,Con MO注射组胚胎的头颅部发育正常(图3 A),各DHFR MO注射组存在两种头颅发育异常表型,分别为头颅增大水肿(图3 B)以及头颅发育不良,体积减小(图3 C)。对各DHFR MO注射组胚胎进行头颅部发育状况进行统计的结果表明,随MO注射剂量的增加,头颅发育异常的发生率增加,头颅增大水肿表型的比例下降而头颅发育不良的比例上升。图3见彩插6。
2.3 叶酸缺乏对脑发育影响的石蜡切片观察
将Con MO注射组胚胎、DHFR MO注射组头颅增大水肿胚胎以及头颅发育不良胚胎在60 hpf进行固定后制作成蜡块。进行切片后显微镜下对脑组织结构进行观察结果发现,头颅增大水肿胚胎的脑体积较Con MO注射组胚胎(图3 D)减小,且脑细胞排列稀疏(图3 E);头颅发育不良胚胎的脑体积较头颅增大水肿胚胎进一步缩小,脑细胞不仅排列稀疏,且细胞体积亦减小(图3 F)。图3见彩插6。
2.4 叶酸缺乏对ngn1以及huc表达的影响
利用胚胎整体原位杂交的方法对ngn1以及huc表达情况检测的结果表明,在Con MO中,ngn1以及huc在脑部和脊髓有较强表达(图4 A,D;图5 A,D)。与Con MO组相比,ngn1以及huc在DHFR MO I注射组胚胎的脑部和脊髓的表达强度下降(图 4 B,E;图5 B,E);ngn1以及huc在DHFR MO II注射组中的表达强度较DHFR MO I注射组进一步减弱(图4 C,F;图5 C,F)。图4,5见彩插7。
3 讨论
在本实验中,我们采用显微注射吗啡啉修饰的反义核苷酸(MO)的方法进行基因表达阻抑。显微注射MO已被证实是一种简单、有效的阻抑目的基因功能的方法[12-14]。如图1中A所示,实验中所用于使DHFR表达阻抑的DHFR MO I以及DHFR MO II可特异的作用于靶基因的翻译起始位点ATG附近的5’-UTR区,阻断DHFR的翻译从而达到阻抑DHFR表达的目的。如图1中B所示,含有5’-UTR序列的DHFR-GFP质粒可同时表达DHFR以及GFP,而DHFR MO I以及DHFR MO II可作用于5’-UTR区阻断DHFR-GFP融合质粒的翻译(如图1C所示)。因此在荧光显微镜下所观察到的GFP表达情况与DHFR的表达水平一致。在我们的实验中我们利用此点进行了DHFR表达阻抑的效率验证。我们发现DHFR-GFP融合质粒注射组胚胎有较强的GFP表达,而DHFR-GFP融合质粒+DHFR MO I以及DHFR-GFP融合质粒+DHFR MO II注射组中GFP表达明显减弱,说明显微注射DHFR MO可有效的使DHFR表达阻抑。
在光镜下以及进行石蜡切片观察DHFR MO I以及DHFR MO II注射组胚胎的颅脑部发育情况,发现胚胎的颅脑部发育严重程度与显微注射的MO剂量正相关;显微注射的剂量越大,颅脑部发育不良以及脑细胞数量和体积减少胚胎的比例越高。为了初步探寻DHFR功能阻抑导致神经系统发育异常的机理,我们检测了DHFR功能阻抑胚胎中ngn1以及huc的表达情况。ngn1属于bHLH转录因子家族,是表达于脑以及脊髓的重要神经系统发育调节因子之一[15,16]。在脊椎动物神经系统发育过程中,ngn1对于中胚层细胞向神经细胞分化[17]、神经系统细胞的形成和成熟[18]、大脑皮层的发育[19]等十分关键。huc属于RNA结合蛋白家族,对于神经系统早期发育十分重要,在神经分化和成熟过程中扮演重要角色[20,21],其可通过增加mRNA的稳定性而对神经细胞的功能有维持作用[22]。通过原位杂交的方法对ngn1以及huc表达情况检测的结果表明,DHFR MO注射组胚胎中ngn1以及huc的表达强度明显减弱,且其减弱程度与DHFR MO注射剂量呈正相关。
本实验研究表明,DHFR功能阻抑可导致胚胎颅脑发育明显异常,并造成ngn1以及huc的表达强度明显减弱。DHFR可能通过影响ngn1以及huc的表达而对神经系统的发育有调节作用。
(本文图2、3见彩插6,图4、5见彩插7。)
[1]De Marco P,Calevo MG,Moroni A,et al.Polymorphisms in genes involved in folate metabolism as risk factors for NTDs[J]. Eur J Pediatr Surg,2001,11(Suppl 1):S14-17.
[2]Black MM.Effects of vitamin B12 and folate deficiency on brain development in children.Food Nutr Bull[J],2008,29(Suppl 2):S126-131.
[3]Bagnyukova TV,Powell CL,Pavliv O,et al.Induction of oxidative stress and DNA damage in rat brain by a folate/methyldeficient diet[J].Brain Res,2008,1237:44-51.
[4]Czeizel AE.Periconceptional folic acid and multivitamin supplementation for the prevention of neural tube defects and other congenital abnormalities[J].Birth Defects Res A Clin Mol Teratol,2009,85(4):260-268.
[5]Bower C,D'Antoine H,Stanley FJ.Neural tube defects in Australia:trends in encephaloceles and other neural tube defects before and after promotion of folic acid supp lementation and voluntary food fortification[J].Birth Defects Res A Clin Mol Teratol,2009,85(4):269-273.
[6]Sun SN,Gui YH,Wang YX,et al.Effects of methotrexate on the development of heart and vessel in zebrafish.Acta Biochim Biophys Sinica[J],2009,41(1):86-96.
[7]张立凤,钟涛,桂永浩.外源性视黄酸对斑马鱼心血管系统发育的影响[J].中国实验动物学报,2006,14(2):84-88.
[8]Westerfield M.A Guide for the Laboratory Use of Zebrafish (Danio rerio)[M].The Zebrafish Book.Eugene OR:Univ.of Oregon Press,3.1,3.26,3.1-4.6.
[9]Kimmel CB,Ballard WW,Kimmel SR,et al.Stages of embryonic development of the zebrafish[J].Dev Dyn,1995,203(3):253-310.
[10]Berdougo Coleman EH,Lee DH,et al.Mutation of weak atrium/ atrial myosin heavy chain disrupts atrial function and influences ventricular morphogenesis in zebrafish[J].Development,2003,130:6121-6129.
[11]侯佳,桂永浩,等,视黄酸缺乏对斑马鱼心脏房室分化的影响[J].中国实验动物学报,2007,15(5):365-368.
[12]Sun SN,Gui YH,Wang YX,et al.Effect of dihydrofolate reductase gene knock-down on the expression of heart and neural crest derivatives expressed transcript 2 in zebrafish cardiac development[J].Chin Med J(Engl).2007,120(13):1166-1171.
[13]Heasman J.Morpholino oligos:making sense of antisense?[J]Dev Biol,2002,243(2):209-214.
[14]孙淑娜,桂永浩,钱林溪,等.叶酸缺乏对斑马鱼背主动脉发育影响的实验研究[J].中国实验动物学报,2008,16 (5):321-324.
[15]Nieber F,Pieler T,Henningfeld KA.Comparative expression analysis of the neurogenins in Xenopus tropicalis and Xenopus laevis[J].Dev Dyn,2009,238(2):451-458.
[16]Nakada Y,Parab P,Simmons A,et al.Separable enhancer sequences regulate the expression of the neural bHLH transcription factor neurogenin 1[J].Dev Biol,2004,271(2): 479-487.
[17]Kim SS,Yoo SW,Park TS,et al.Neural induction with neurogenin1 increases the therapeutic effects of mesenchymal stem cells in the ischemic brain.Stem Cells[J].2008,26(9): 2217-2228.
[18]Raft S,Koundakjian EJ,Quinones H,et al.Cross-regulation of Ngn1 and Math1 coordinates the production of neurons and sensory hair cells during inner ear development[J]. Development,2007,134(24):4405-4415.
[19]Wang L,Zhang ZG,Zhang RL,et al.Neurogenin 1 mediates erythropoietin enhanced differentiation of adult neural progenitor cells[J].J Cereb Blood Flow Metab,2006,26(4):556-564.
[20]Hinman MN,Lou H.Diverse molecular functions of Hu proteins[J].Cell Mol Life Sci,2008,65(20):3168-3181.
[21]Diks SH,Bink RJ,van de Water S,et al.The novel gene asb11:a regulator of the size of the neural progenitor compartment[J].J Cell Biol,2006,174(4):581-592.
[22]Zhu H,Hasman RA,Barron VA,et al.A nuclear function of Hu proteins as neuron-specific alternative RNA processing regulators[J].Mol Biol Cell,2006,17(12):5105-5114.
Effects of Dihydrofolate Reductase Gene on the Developm ent of Nervous System in Zebrafish
SUN Shu-na1,GUI Yong-hao1,JIANG Qiu2,QIAN Lin-xi2,SONG Hou-yan2
(1.Children’s Hospital,Fudan University,Shanghai 200032,China; 2.Department of Molecular Genetics,Shanghai Medical College and Key Laboratory of Molecular Medicine,Ministry of Education,Fudan University,Shanghai 200032)
Objective To observe the development of cranium and brain in dihydrofolate reductase gene-inhibited zebrafish embryos and to investigate the mechanism of action of dihydrofolate reductase gene(DHFR)in this process.MethodsDHFR was inhibited by microinjecting morpholino oligonucleotides(MO).The development of heads at 48 hours post fertilization(48 hpf)was observed and the development of the brain at 60 hpf was exam ined by histopathology. Whole-mount in situ hybridization was performed to detect the expression of ngn1 and huc,which are two key factors in the developments of nervous system.ResultsDHFR was successfully inhibited by microinjecting MO.The abnormal developments of heads and brains were observed in DHFR-inhibited embryos.Compared with controls,the expressions of ngn1 and huc were reduced in DHFR-inhibited groups.With the increasing doses of MOs,the malformations were more severe and the reduction of ngn1 and huc expressions was more pronounced.ConlusionDHFR plays a major role in the development of nervous system in zebrafish.The malformation of cranium and brain induced by DHFR-inhibition was related with the decreasing expression of ngn1 and huc.
dihydrofolate reductase gene,nervous system,zebrafish
Q3,Q7
A
1005-4847(2010)02-0127-04
2009-05-06
国家教育部博士点基金资助(编号:200802461111)。
孙淑娜(1978-),女,医师,研究方向:先心病的发病机理研究。E-mail:shunasun@163.com
桂永浩。E-mail:yhgui@shmu.edu.cn
