系统表达 HB-EGF转基因小鼠的建立
2010-09-08张小娟袁树民张连峰
张 伟,冯 娟,陈 炜,张小娟,袁树民,廉 虹,张连峰
(中国医学科学院实验动物研究所北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021)
研究报告
系统表达 HB-EGF转基因小鼠的建立
张 伟,冯 娟,陈 炜,张小娟,袁树民,廉 虹,张连峰
(中国医学科学院实验动物研究所北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021)
目的建立系统表达肝素结合性表皮生长因子 (HB-EGF)的转基因动物模型,利用转基因动物模型研究 HB-EGF与组织纤维化的关系。方法RT-PCR法克隆小鼠 HB-EGF基因,将其插入 Chickenβ-actin启动子下游,构建 Chickenβ-actin-HB-EGF表达载体,利用显微注射的技术把表达载体注射到受精卵的雄原核中,建立 HBEGF转基因小鼠。利用特异引物 PCR的方法鉴定转基因的基因型,采用Western Blot方法鉴定 HB-EGF基因在全身组织的表达。分别取 HB-EGF转基因鼠与同窝阴性小鼠的肝、肾、肺及膀胱组织进行Massion染色。结果建立了系统表达 HB-EGF转基因小鼠,Western Blot发现其 HB-EGF在肝、肺、肾及膀胱的表达与同窝阴性对照小鼠相比明显增加。Massion染色结果表明转基因鼠肝、肺、肾及膀胱组织纤维化程度明显高于同窝阴性对照小鼠。结论成功建立了系统表达 HB-EGF转基因小鼠,HB-EGF的过度表可显著加重组织纤维化程度。
肝素结合性表皮生长因子;转基因;小鼠;纤维化
1991年,Higashiyama等[1]首先在巨噬细胞样 细胞 U-937中发现了肝素结合性表皮生长因子(HB-EGF)。HB-EGF属表皮生长因子 (EGF)家族成员之一,在全身不同的组织中均有表达,主要存在于肺、心脏、脑以及骨骼肌中。它参与许多生理过程,如伤口愈合、眼睑形成、胚泡的植入、肾收集管的形态建成以及癌变过程等[2-4]。HB-EGF具有强大的促有丝分裂、趋化因子、黏附分子等生物活性。2003年, Iwamoto等[5]建立了 HB-EGF基因敲除小鼠,小鼠表现出严重的心衰,并且伴有心室和心瓣膜扩张,影响了心肌正常的功能,这说明 HB-EGF对于心脏正常发育是十分重要的。HB-EGF活性异常会导致许多心血管病理过程,如心肌肥厚、平滑肌细胞增生以及肺性高血压[6-8]。器官纤维化 (organ fibrosis)一直是研究医学的热点问题之一,最近几年的研究表明,HB-EGF与多种组织器官纤维化过程密切相关。纤维化 (fibrosis)引起器官内纤维结缔组织增多,实质细胞减少,持续进展可导致器官结构破坏和功能减退,乃至器官衰竭,严重影响人类健康。纤维化是多种慢性病的病理和组织学基础。为了进一步的研究 HB-EGF在纤维化过程中的作用,我们建立了系统表达 HB-EGF基因转基因小鼠模型,旨在研究 HB-EGF与慢性肝病、慢性肾病等慢性疾病所引起的组织病理性纤维化的关系。
1 材料和方法
1.1 实验材料及仪器
pCAGGS-AD质粒为本实验室保存。Trizol提取液、SuperScript.First-Strand Synthesis System for RTPCR购自 Invitrogen公司。T4 DNA ligase购自 NEB公司。Q IAquick Gel Extraction Kit购自 Q IAGEN公司。引物合成及测序由上海英俊公司完成。HBEGF(M-18)多克隆抗体、Western blotting luminal reagent为 Santa Cruz公司产品。Prestained protein marker,broad range购自 Fer mentas。辣根酶标记兔抗山羊 IgG购自中杉金桥。3~4周龄Balb/c雌性小鼠购自维通利华。显微注射仪为 Nikon TE2000.U,倒置显微镜为Olympus产品。
1.2 实验方法
1.2.1 获得目的基因:Trizol法提取 C57BL/6小鼠肺脏的总 RNA,用 SuperScript.First.Strand Synthesis System for RT-PCR试剂盒逆转录获得肺脏总cDNA,通过高保真酶进行 PCR扩增获得带有 HindⅢ酶切位点的 HB-EGF cDNA,上游引物为:5′-CCAAGCTTATCCAAAGTGATCGCTGC CTC-3′;下游引物为:5′-CCAAGCTTAAGTAGCCTCTGAAGGTT CCTATAG-3′。目的条带为 709 bp。将其与 pMD18-TVector连接送去测序,发现无突变,以 HindⅢ酶切回收该片断。
1.2.2 转基因注射片段的制备:用于转基因的载体pCAGGS-AD含有全身组织表达的启动子 chickenβactin。将载体 pCAGGS-AD用 HindⅢ酶切,去磷酸化,胶回收载体。用 T4 DNA ligase将酶切后的载体和经测序正确的目的片段连接,构建成 pCAGGSAD-HB-EGF表达载体。然后经 PvuI酶切将表达载体线性化,Sephedex-G50柱纯化 DNA,通过凝胶电泳进行定量后用于显微注射。
1.2.3 转基因操作:用孕马血清和人绒毛膜促性腺激素对 3、4周龄的 C57BL/6小鼠进行超排后,从输卵管的壶腹部将受精卵取出,向受精卵雄原核中注入DNA溶液,在二氧化碳孵箱 (37℃)中培养过夜,将发育成两细胞的卵挑选出来,移植到 ICR假孕小鼠的输卵管中。
1.2.4 PCR法鉴定 HB-EGF转基因小鼠的基因型:本实验通过设计跨外显子的特异引物,采用 PCR扩增技术,确认小鼠中是否有转入的基因。转基因小鼠在出生 9~14 d用剪趾法标记,收集剪下的组织,用高盐法提取基因组DNA,利用特异引物进行 PCR检测。在 20μL体系中加入:10 ×PCR Buffer 2 μL,25 mmol/L MgCl 1μL,10 mmol/L dNTP 0.4 μL,上游引物 (50μmol/L)0.2μL,下游引物 (50 μmol/L)0.2μL,模板 DNA 1μL,Taq DNA polymerase(5 U/μL)1μL,ddH2O 15μL。反应条件为:94℃预变 4 min,循环参数为 94℃30 s,60℃30 s,72℃30 s,30个循环后 72℃延伸 7 min。上游引物为5′-GTCGGTGATGCTGAAGCTC-3′;下游引物为5′-CTACAGCCACCACAGCCAAG-3′,目的条带为491 bp。
1.2.5 Western Blot:分别提取两个首建鼠的 Fl代阳性转基因小鼠和同窝阴性对照小鼠的心、肝、脾、肺、肾、胃、脑、胰脏、小肠、骨骼肌、膀胱、睾丸、子宫组织的蛋白,进行 SDS-PAGE凝胶电泳,将蛋白条带转移到NC膜上,置于 5%脱脂奶粉封闭液中室温封闭 1 h;加入1∶200稀释的 HB-EGF(M.18)多克隆抗体,用杂交袋封住,4℃孵育过夜。倒掉一抗,用TBST洗膜 3次,每次 10 min。然后加入1∶10 000辣根过氧化酶标记兔抗山羊的二抗,置于摇床上摇动,室温下 1 h。弃去二抗,TBST洗膜 3次,每次 5 min,TBS洗膜 1次,10 min。将膜置于化学发光剂中,曝光、显影及定影,用 SynGene GeneTools软件分析所得的结果。
1.2.6 Masson染色:分别取 HB-EGF转基因鼠与同窝阴性小鼠的肝、肾、肺及膀胱组织,固定于 4%中性甲醛中,做石蜡切片,常规脱蜡至水。Masson复合染色 5 min,0.2%醋酸水溶液稍洗,5%磷钨酸5~10 min,0.2%醋酸水溶液浸洗 2次,脱水,二甲苯透明,中性树胶封片。光镜下观察,胶原纤维为绿色。
2 结果
2.1 获得转基因注射片断
得到的目的片断与 T载体连接后送去测序,测序结果经 Blast分析显示,709 bp的 HB-EGF cDNA与 Genebank中序列的同源性为 100%。由于线形DNA的整合效率高于环形的 DNA,将构建的环形pCAGGS-AD-HB-EGF表达载体用 PvuI酶切后,得到了线形的DNA片断(图 1),浓度为 3 ng/μL用于显微注射。
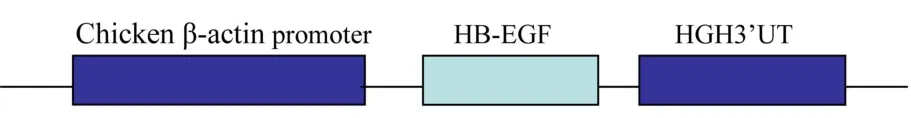
图 1 转基因注射片断的构建Fig.1 The construction of transgenic fragment
2.2 转基因小鼠基因表型的鉴定
用特异引物对 HB-EGF转基因小鼠的基因组进行 PCR扩增,结果的到两只阳性首建鼠(图 2)。
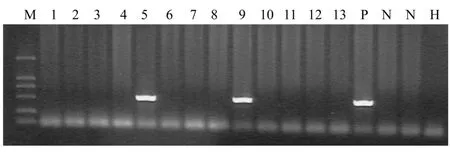
图 2 HB-EGF转基因小鼠基因表型分析Fig.2 Genotyping HB-EGF transgenic mice with PCR
2.3 HB-EGF基因的表达
用Western Blot方法检测 HB-EGF蛋白在心、肝、脾、肺、肾、胃、脑、胰脏、小肠、骨骼肌、膀胱、睾丸、卵巢、子宫组织的表达情况,结果表明,HB-EGF在心、肝、肺、肾、胃、胰脏、骨骼肌、膀胱、睾丸、卵巢、子宫组织均有表达;两只首建鼠的 F1代阳性转基因鼠的肝、肾、肺及膀胱组织中 HB-EGF蛋白的表达明显高于同窝阴性对照小鼠 (图 3)。

图 3 Western Blotting鉴定 HB-EGF蛋白在转基因鼠肝、肾、肺和膀胱组织的表达Fig.3 Western blotting analysis of HB-EGF expression in liver,kidney,lung,and bladder
2.4 Masson染色
光镜下观察,胶原纤维为绿色。结果发现阳性转基因鼠 F1代肝、肾、肺和膀胱组织细胞间的胶原纤维明显多于同窝阴性对照小鼠(图 4见彩插 5)。
3 讨论
近年大量研究结果表明,细胞因子通过作用于细胞表面的相应受体,在促进细胞增殖、细胞外基质(extracelluarmatrix,ECM)积聚和器官纤维化发生发展中起重要作用。参与器官纤维化常见的细胞因子有转化生长因子-β(transfor ming growth factor-β, TGF-β)、血小板源生长因子 (platelet-derived growthfactor,PDGF)、碱性成纤维细胞生长因子 (basic fibroblast growth factor,bFGF)、表皮生长因子(epider mal growth factor, EGF)、白 介 素-1 (interleukin-1, IL-1)、 IL-6、 IL-8、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、γ-干扰素 (interfer -γ, INF-γ)和胰岛素样生长因子 (insulin-like growth factor,IGF-1)等。在生理情况下,众多细胞因子构成的网络处于平衡状态,但在病理情况下,这一平衡被打破,正向调节纤维化的细胞因子增加,并发生级联反应,而负向调节细胞因子减少,从而导致细胞外基质过度沉积而形成纤维化。
越来越多的证据证明,在多种组织和器官的纤维化过程中,HB-EGF发挥着非常重要的作用。Means等[9]对胰腺特异表达的 HB-EGF转基因小鼠研究表明,HB-EGF转基因小鼠胰岛间质增多,随着年龄的增长胰腺内分泌室和外分泌室均发生纤维化,并进一步诱发高血糖和胰脏导管上皮细胞增生,提示 HB-EGF引起胰岛和间质的相互作用导致胰腺疾病的发生。鉴于成纤维细胞和胰岛的黏附需要生长因子受体 (EGFR)活性,这一信号通路可能参与胰腺疾病的纤维化部分。Ingram等[10]研究表明, HB-EGF与肾成纤维细胞增生有关,在钒诱导的肾成纤维细胞增生中 HB-EGF表达明显增加,且MAPK(ERK)信号通路参与这一过程。以往研究表明,在部分肝脏切除后的新生肝中,HB-EGF只在非实质细胞中表达,而不在肝细胞中表达。但 Kiso等[11]研究发现,在肝癌形成过程中,HB-EGF会在纤维变性的肝细胞中出现表达。Ushikoshi等[12]利用腺病毒转导心肌梗死 (M I)的兔子,除发现能够导致左心室肥厚外,还加速了细胞程序化凋亡和纤维化的水平,在M I部位出现成肌纤维细胞和巨噬细胞积聚。体外实验显示 HB-EGF主要表达于培养的成纤维细胞。表明 HB-EGF可能对心脏成纤维细胞的生长发挥调节作用,提示 HB-EGF很可能成为治疗心肌肥厚和纤维化的治疗靶点。
对本实验所构建的系统表达 HB-EGF转基因小鼠研究表明,随着肝、肾、肺和膀胱组织的 HB-EGF表达升高,其纤维化程度加重,提示 HB-EGF在这些组织纤维化的过程中发挥着重要作用,而其具体分子机制有待进一步研究。
[1] Higashiyama S,Abraham JA,MillerJ,et a1.A heparin-binding growth factor secreted bymacrophage-1ike cells that is related to EGF[J].Science,1991,251:936-939.
[2] MarikovskyM,Breuing K,Liu PY,et al.Appearance of heparin-binding EGF-like growth factor in wound fluid as a response to injury[J].Proc NatlAcad SciUSA,1993,90(9): 3889-3893.
[3] Takemura T,Hino S,Kuwajima H,et al.Induction of collecting ductmorphogenesis in vitro by heparin-binding epidermal growth factor-like growth factor[J].J Am Soc Nephrol,2001,12(5): 964-972.
[4] Fu S,Bottoli I,Goller M,et al.Heparin-binding epidermal growth factor-like growth factor,a v-Jun target gene,induces oncogenic transformation[J].Proc Natl Acad Sci USA,1999, 96(10):5716-5721.
[5] Iwamoto R,Yamazaki S,Asakura M et al.Heparin-binding EGF-like growth factor and ErbB signaling is essential for heart function[J].Proc NatlAcad SciUSA,2003,100(6):3221-3226.
[6] AsakuraM, Kitakaze M, Takashima S, etal. Cardiac hypertrophy is inhibited by antagonism ofADAM12 processing of HB-EGF:metalloproteinase inhibitors as a new therapy[J].Nat Med,2002,8(1):35-40.
[7] Miyagawa J,Higashiyama S,Kawata S,et al.Localization of heparin-binding EGF-like growth factor in the s mooth muscle cells and macrophages of human atherosclerotic plaques[J].J Clin Invest,1995,95(1):404-411.
[8] Lemjabbar H,Basbaum C.Platelet-activating factor receptor and ADAM10mediate responses to Staphylococcusaureus in epithelial cells[J].NatMed,2002,8(1):41-46.
[9] MeansAL,Ray KC,Singh AB,et al.Overexpression of heparin-binding EGF-like growth factor in mouse pancreas results in fibrosis and epithelialmetaplasia[J].Gastroenterology,2003, 124(4):1020-1036.
[10] Ingram JL,Rice AB,Santos J,et al.Vanadium-induced HBEGF expression in human lung fibroblasts is oxidant dependent and requires MAP kinases[J].Am J Physiol Lung Cell Mol Physiol,2003,284(5):L774-L782.
[11] Kiso S,Kawata S,Tamura S,et al.Expression of heparinbinding epidermalgrowth factor-like growth factorin the hepatocytes of fibrotic rat liver during hepatocarcinogenesis[J].J Gastroenterol Hepatol,1999,14(12):1203-1209.
[12] Ushikoshi H,Takahashi T,Chen X,et al.Local overexpression of HB-EGF exacerbates remodeling following myocardial infarction by activating noncardiomyocytes[J]. Lab Invest, 2005,85(7):862-873.
The Establishment of HB-EGF System ic Expression in Transgen icM ice
ZHANGWei,FENG Juan,CHEN Wei,ZHANG Xiao-juan,YUAN Shu-min,L IAN Hong,ZHANGLian-feng
(KeyLaboratory of Human Diseases ComparativeMedicine,Ministry of Health;Institute ofLaboratory Animal Science,Chinese Academy ofMedical Sciences(CAMS)&Comparative Medicine Centre,PekingUnionMedical Collage(PUMC),Beijing 100021,China)
ObjectiveTo construct heparin-binding epidermal growth factor-like growth factor(HB-EGF) transgenic mice in order to investigate the role of HB-EGF in the fibrosis of tissues.M ethod HB-EGF gene was cloned for m mouse with RT-PCR.The cloned HB-EGF gene was then inserted downstream of Chickenβ-actin promoter to construct the vector which could express HB-EGF gene in system.The transgenic mice were produced by microinjection method and the genotype was detected by PCR with specific primers.The expression profiles of HB-EGF in body tissues were illustrated by Western Blot.Massion staining of liver,lung,kidney and bladder from transgenic mice and nontransgenic control mice was carried out。ResultsTwo lines of HB-EGF transgenic mice were established.The expression levels of the HB-EGF gene in liver,lung,kidney and bladder from transgenic mice were obviously higher than those form controlmice.The extents of fibrosis in the liver,lung,kidney and bladder of transgenic mice were significantly enhanced by the expression of the transgene。ConclusionTwo lines of system-expressing HB-EGF transgenic mice were established successfully.The over-expression of HB-EGF can significantly aggravate tissues fibrosis degree.
Heparin-binding epidermal growth factor;Transgene;Mouse;Fibrosis
R349.83
A
1671-7856(2010)01-0032-04
2009-09-11
卫生部行业基金,实验动物和人类疾病动物模型资源扩展(200802036)和十一五新药专项支持(2009ZX09501-026)。
张伟(1980-),男,博士,主要研究方向:心肌病病理机制。
张连峰。E-mail:zhanglf@cnilas.org
