人宫颈癌细胞 Hela移植模型肿瘤生长的荧光分析和卡尺测量的比较
2010-09-08李小颖马春梅张连峰
李小颖,马春梅,张连峰
(中国医学科学院实验动物研究所北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021)
人宫颈癌细胞 Hela移植模型肿瘤生长的荧光分析和卡尺测量的比较
李小颖,马春梅,张连峰
(中国医学科学院实验动物研究所北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021)
目的建立稳定表达绿色荧光蛋白的人宫颈癌细胞系,建立移植瘤模型并比较移植模型肿瘤生长的荧光分析和卡尺测量的优缺点。方法以 Lipofectamine 2000介导 chickenβ-actin-GFP-NEO转染人宫颈癌细胞Hela,经梯度浓度 G418筛选获得稳定表达绿色荧光蛋白的细胞克隆并扩大培养。BALB/cA-nu裸鼠皮下接种 1× 106个发光细胞使其成瘤,利用活体荧光成像系统和游标卡尺观察肿瘤的生长情况。结果获得了稳定表达 GFP的人宫颈癌细胞株,将其接种到裸鼠体内可成瘤。活体荧光成像观察发现,1至 3周随着肿瘤体积逐渐增大,平均荧光光子数逐渐增加;4周时随着肿瘤出现明显坏死,平均荧光光子数呈现下降趋势,而游标卡尺测量结果显示肿瘤在 4至 5周仍然不断的增大。结论绿色荧光蛋白能够在人宫颈癌细胞 Hela中长期稳定表达,用绿色荧光蛋白标记的人宫颈癌细胞 Hela建立的裸鼠肿瘤模型可以为人宫颈癌研究提供理想的实验材料,应用小动物活体成像系统能够客观定量评价活的肿瘤细胞在动物体内的生长情况,而不是肿瘤体积的变化。
人宫颈癌细胞;裸小鼠;活体荧光成像系统;游标卡尺
Hela细胞源自一名美国妇女的子宫颈癌细胞,此细胞株是由正常子宫颈细胞被一种人类乳突状瘤病毒 (Human Papillomavirus 18或 HPV18)转型成癌细胞的,而且和正常子宫颈癌细胞有许多不同,此细胞显角蛋白免疫沉淀染色阳性,包含 HPV-18序列,有正常水平的 pRB表达和 p53的低水平表达。本实验旨在建立稳定表达绿色荧光蛋白的人宫颈癌Hela-GFP细胞系的基础上,应用活体成像技术动态观察细胞在体内生长及形成瘤体的过程,比较移植模型肿瘤生长的荧光分析和卡尺测量的优缺点,为肿瘤模型的测量和药物研究提供更方便的分析技术和实验材料。
1 材料和方法
1.1 材料
1.1.1 试剂与仪器:Hela癌细胞本实验室冻存,L-谷氨酰胺 (G IBCO公司)、双抗 (G IBCO公司)、DMEM(G IBCO公司)、胎牛血清 (G IBCO公司)、G418(AMRESCO公司)、Lipofectamine 2000 Reagent (I
NV ITROGENE公司)。Whole-body optical imaging system(I.C.E.,日本 Roper公司)、倒置荧光显微镜(OLY MPUS IX71)、倒置显微镜 (Nikon TS100)。细胞凋亡原位检测试剂盒 (in situ cell death detection kit,POD)为 ChemiconInternational公司产品。
1.1.2 实验动物:BALB/cA-nu裸小鼠购自北京维通利华实验动物技术有限公司 [XCXK(京)2007-0001],鼠龄 5周,体重 15~18 g,在本实验室无特定病原体 (specific-pathogen free,SPF)的饲养间饲养。所有实验操作程序均经过实验动物研究所实验动物使用管理委员会批准(批准号为 GC-09-2001)。
1.2 方法
1.2.1 细胞培养:用含 10%胎牛血清、100 IU/mL青霉素,100μg/mL链霉素的 DMEM培养基作为Hela细胞的培养液,于 5%CO2,37℃细胞培养箱内常规培养。
1.2.2 构建带有筛选标记的载体:chickenβ-actin-GFP由本实验室构建[1,2]。
1.2.3 细胞转染和筛选:采用 Lipofectamine 2000 Reagent转染 Hela细胞 (具体转染步骤参照Lipofectamine 2000 Reagent操作说明)。转染后 24 h,用含 500μg/mL G418的培养液筛选细胞 3周,获得稳定表达 GFP的细胞株,选择其中高表达的克隆株扩大培养。
1.2.4 肿瘤细胞的植入及活体荧光成像:收集处于生长对数期的转染细胞,稀释至 5×106/mL。各取三只BALB/cA-nu裸鼠进行皮下接种,1×106个细胞/只,每隔一周观察一次,饱和三溴乙醇 (0.18 mL/10g)麻醉后放入活体荧光影像系统摄像,Slide Book 4.0软件进行分析。
1.2.5 肿瘤体积的测定:在接种的 14、21、28和 35 d,分别用游标卡尺测量肿瘤块 3个互相垂直直径A、B、C,代入下式计算肿瘤块的体积 V∶V=1/ 6πABC(V为体积,A、B、C为瘤体的 3个互相垂直的直径),并绘制肿瘤的生长曲线。
1.2.6 肿瘤组织的 H-E和 TUNEL染色:肿瘤生长5周后,剥取出移植瘤,制成石蜡切片并进行 H-E和TUNEL染色。TUNEL染色步骤:(1)切片经二甲苯脱蜡,梯度乙醇水化;(2)20 mg/L蛋白酶 K消化液作用 15 min;(3)含 3%过氧化氢的 PBS,于室温反应 5 min;(4)TUNEL反应液,37℃孵育 60 min;(5)过氧化物酶连接的抗荧光素抗体,37℃孵育 30 min; (2)~(5)步后均以 10 mmol/L PBS(pH 7.4)振洗 3次,每次 5 min;(6)DAB显色,苏木素复染,脱水透明,封片。
2 结果
2.1 稳定高表达 GFP的单克隆细胞株
稳定高表达 GFP的细胞,在荧光显微镜下均呈强荧光,并且荧光较均匀的分布于整个细胞内。单克隆 GFP细胞在无 G418筛选压力下,传代数次后仍能稳定高水平表达 GFP(图 1见彩插 2)。细胞形态和未转染细胞无明显区别。
2.2 GFP荧光标记 Hela异种移植瘤模型的动态观察
将对数生长期的 GFP标记的 Hela肿瘤细胞皮下接种于 3只 BALB/cA-nu,1×106/只。在接种的7、14、21、28和 35d观察肿瘤的生长情况 (图 2见彩插 2)。1周时肿瘤大小不能用游标卡尺测量,2周时肿瘤进入对数生长期,至 5周时移植瘤体积可达474.08 mm3,3周时动物皮肤表面都出现了不同程度的坏死。应用小动物活体荧光成像系统可监测到绿色荧光蛋白在裸小鼠皮下的稳定表达,从第 1周至第 3周,随着肿瘤移植时间的增加,表达绿色荧光蛋白的面积逐渐增大,荧光光子数也逐渐增加,移植瘤体积与荧光光子数成正相关。4周后,由于动物的皮下肿瘤出现了坏死,因此尽管肿瘤体积仍在增加但平均荧光光子数反而呈下降趋势,移植瘤体积与荧光光子数不再有相关性(图 3)。
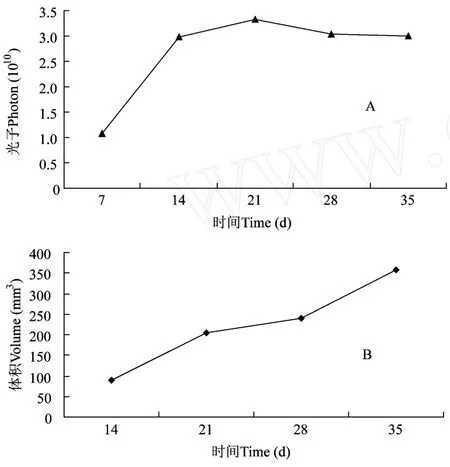
图 3 Hela移植模型肿瘤生长的荧光分析和卡尺测量的比较Fig.3 The comparison of the tumor growth in implanted mouse model detected by optical imaging system and slide caliper
2.3 H-E和TUNEL染色结果
H-E染色可见部分肿瘤细胞核染色质匀细,核浆比例大,细胞结构完整,处于分裂期的细胞很少,肿瘤生长速度缓慢。另外,大部分细胞呈现核皱缩、浓染,胞质致密、嗜酸性染色增强(图 4A)。
肿瘤组织经 TUNEL染色,核呈棕黄色,核固缩,染色质凝集成块状或边集,呈现细胞凋亡的特征(图 4B)(图 4见彩插 3)。
3 讨论
子宫颈癌是妇科最常见的恶性肿瘤之一,在全球范围内,每年约有 20多万女性死于宫颈癌。目前宫颈癌的治疗方法主要是手术和放疗,手术疗法原则上限于早期患者,且手术后容易复发;放射治疗适用于各期浸润型宫颈癌,但放射线缺乏选择性,对人体正常细胞也会造成伤害,多次放化疗以后,患者免疫功能下降,抵抗力降低,容易转移。所以寻找理想的治疗方法是当务之急。目前国内外学者主要集中于各种抗癌药物的体外抗宫颈癌研究[3-7],由于缺少理想的肿瘤模型,在体抗宫颈癌报道很少。张晓茗[8]建立了 Hela细胞裸鼠移植模型,观察了大蒜素对裸鼠移植瘤的影响。肿瘤大小的测定采用的是传统的游标卡尺测量方法,此方法简单易行,但是早期不敏感,在接种后 2周或更长时间才能测量,并且人为的实验误差大,在肿瘤出现坏死后,肿瘤的体积不再代表肿瘤活细胞的多少和生长情况。活体生物荧光成像技术 (in vivo bioluminescence imaging)是近年来发展起来的一项分子、基因表达的分析检测系统,通过对同一组实验对象在不同时间点进行记录,跟踪同一观察目标 (标记细胞及基因)的移动及变化,所得的数据更加真实可信。因其操作极其简单、所得结果直观、灵敏度高等特点,在刚刚发展起来的几年时间内,已广泛应用于生命科学、医学研究及药物开发等方面[9-12]。
本实验在成功建立表达绿色荧光蛋白的人宫颈癌细胞系 Hela-GFP的基础上,将 Hela-GFP细胞接种于裸鼠,通过连续动态观察人宫颈癌细胞在裸小鼠体内的生长情况,发现成像系统在肿瘤皮下移植7 d时就可以检测到荧光的表达,此时按传统方法尚无法测量移植瘤体积。随着移植瘤体积的不断增加,成像系统可以通过肿瘤组织释放的平均光子数客观地描述肿瘤的生长,在肿瘤的早期,所得数据与游标卡尺测量的肿瘤体积相对应。至 4周后瘤体出现坏死以后,尽管游标卡尺测量的肿瘤体积仍在增加,但成像系统所测的荧光光子数反而呈现下降趋势,利用 HE染色和标记凋亡细胞的 TUNEL染色进一步证实,4周后,位于肿瘤组织中心部分已经坏死,与活体荧光成像系统观察结果一致,说明只有活的肿瘤细胞才能表达 GFP而产生荧光,利用活体成像系统可以只测量活肿瘤细胞的生长情况,从而更准确地反映肿瘤生长以及与机体的相互作用。
本实验成功建立了人宫颈癌细胞 Hela绿色荧光标记的肿瘤模型,此荧光蛋白癌症模型可应用于癌症体内用药的疗法中。利用无创伤活体荧光成像对癌细胞生长的检测,可对癌症实验治疗之前和过程中的癌细胞的变化进行实时观测和评估。这种方式提供一个早期、快速、动态观察癌细胞的治疗反应和复发评估的预诊断途径,为宫颈癌的研究和相关药物研究提供了更准确的、更方便的测量技术和相应的动物模型。
[1] 冯娟,高苒,全雄志,等.红色荧光和绿色荧光转基因小鼠模型的建立[J].中国实验动物学报,2007,15(4):267-270.
[2] 李小颖,高凯,刘学丽,等.人结肠腺癌细胞 HCT-8绿色荧光标记肿瘤模型的建立[J].中国比较医学杂志,2009,19(7): 19-22.
[3] 谭忠伟,江振友,岳磊,等.复方中药对人宫颈癌 Hela细胞生长和凋亡的影响[J].国际医药卫生导报,2009,15(9):5-8.
[4] 王惠兰,张贺玲,黄向华,等.米非司酮对人宫颈癌 Hela细胞体外作用的研究 [J].中国综合临床,2006,22(9):853-855.
[5] 刘芳,杨翠军,孙黎,等.五加皮多糖对人宫颈癌 Hela细胞凋亡作用的研究[J].时珍国医国药,2009,20(5):1178-1179.
[6] Bhutia SK,Mallick SK,Maiti S,et al.Abrus abrin derived peptides induce apoptosis by targetingmitochondria in HeLa cells [J].CellBiol Int,2009,33(7):720-727.
[7] Yan Q,Li Y,Jiang Z,et al.Antiproliferation and apoptosis of human tumor cell lines by a lectin(AMML)of Astragalus mongholicus Phytomedicine[J].Phytomedicine,2009,16(6): 586-593.
[8] 张晓茗.宫颈癌Hela细胞裸鼠移植瘤模型的建立及大蒜素对移植瘤的影响[D].中国学位论文全文数据库,2005.
[9] 储军,陈延平,熊涛,等.GFP标记的肿瘤生长和转移的整体荧光成像[J].激光生物学报,2004,13(6):433-438.
[10] 高苒,刘学丽,冯娟,等.荧光标记技术在肿瘤模型研究中的应用[J].中国比较医学杂志,2008,18(5):59-61.
[11] 王勇,冯敢生,田惠,等.原位肝肿瘤血管生成及自发转移的荧光成像[J].中华医学杂志,2007,87(46):3307-3309.
[12] 吴元东,谭万龙,谢毅,等.人膀胱肿瘤细胞的荧光标记及其移植模型的整体荧光成像[J].南方医科大学学报,2006,26 (4):436-440.
The Comparison of Tumor Growth in the I mplantedM ouseM odel Detected by Optical I maging System and a Slide Caliper
L IXiao-ying,MA Chun-mei,ZHANGLian-feng
(KeyLaboratory of Human Diseases ComparativeMedicine,Ministry of Health;Institute ofLaboratoryAnimal Science,Chinese Academy ofMedical Sciences(CAMS)&ComparativeMedicine Centre, PekingUnionMedical Collage(PUMC),Beijing 100021,China)
ObjectiveTo establish a human cervical carcinoma cell line with stable expression of green fluorescent protein and the fluorescent-labeled implanted tumormodel,and compare the detection methods of tumor growth by optical imaging system and slide caliper.M ethod Human cervical carcinoma cells were transfected with chickenβactin-GFP-NEO byLipofectamine 2000 reagent and screened with G418 to produce the stable GFP-expressing clone.Then the labeled Hela cellswere implanted into the subcutaneous tissue of nude mice and the growth of the implanted tumorwas observed and growth curve of the labeled Hela cellswas analyzed with the whole-body optical imaging system and the slide caliper.Result The stable GFP-expressing Hela cell lines were obtained,which can grow to tumor mass after subcutaneous transplantation.The in vivo fluorescence imaging analysis showed that the fluorescent intensity of tumormass increased with the increase in tumor volume in nude mice during first to third week.The fluorescent intensity tended todecline with the increasing necrosis at the fourth to fifth week,while the tumor volume was still increasing。ConclusionA GFP-labeled Hela cell line and a mouse tumormodel based on the cell linewere established,and the animalmodelprovides useful experimental materials for cervical cancer study. The in vivo fluorescence imaging system could be used to quantitatively evaluate the living tumor cell growth in vivo but not the size or volume of the tumor detected by slide caliper.
Human cervical carcinoma;Nude mouse;Whole-body optical imaging system;Slide caliper
R541
A
1671-7856(2010)01-0015-04
2009-09-15
卫生部行业基金,实验动物和人类疾病动物模型资源扩展(200802036)和十一五新药专项支持(2009ZX09501-026)。
李小颖,助理研究员,主要研究方向:人类疾病动物模型。
张连峰。E-mail:zhanglf@cnilas.org
