针对晚期氧化蛋白产物的抗体制备与应用①
2010-09-07田建伟刘北一侯晓睿侯凡凡富
卢 晓 田建伟刘北一侯晓睿 朱 平 侯凡凡富 宁
(南方医科大学免疫学教研室,广州510515)
针对晚期氧化蛋白产物的抗体制备与应用①
卢 晓 田建伟②刘北一③侯晓睿 朱 平 侯凡凡②富 宁
(南方医科大学免疫学教研室,广州510515)
目的:制备特异性识别晚期氧化蛋白产物(Advanced oxidation protein products,AOPP)的多克隆抗体,为研究AOPP的致病机理及与临床病情相关性提供有效工具。方法:用次氯酸氧化家兔血清白蛋白以获得AOPP-RSA,以此为免疫原免疫家兔,亲和层析纯化免疫血清,ELISA鉴定多克隆抗体的效价及特异性,Western blot检测慢性肾脏病(chronic kidney disease, CK D)患者血浆中AOPP,免疫组织化学方法检测肾组织中AOPP分布与定位。结果:获得效价达10-6的抗AOPP免疫血清,纯化抗体可特异地与不同种属来源的氧化修饰白蛋白结合,而与正常白蛋白及糖基化蛋白终产物无交叉反应。该抗体可识别人血浆中的AOPP,可特异地与大鼠CK D模型及各种炎症性CK D患者肾组织成份反应。结论:成功制备了可与不同种属AOPP结合的特异性多克隆抗体,并首次用于检测存在于CK D患者血浆、肾组织及模型动物肾组织中的AOPP,为深入研究AOPP的病理作用及其在组织定位提供了有效工具。
晚期氧化蛋白产物;多克隆抗体;慢性肾脏病
晚期氧化蛋白产物(Advanced oxidation protein products,AOPP)是体内氧化应激过程中生成的一类含双酪氨酸的蛋白质交联物,血浆AOPP主要由白蛋白携带。循环AOPP水平增高最先在慢性肾功能衰竭、腹膜透析的患者中被发现,随后在糖尿病、肥胖或代谢综合征、动脉粥样硬化等多种常见疾病中被证实[1-4]。AOPP潴留还见于类风湿性关节炎、溃疡性结肠炎等免疫炎症性疾病和恶性肿瘤(结肠、直肠癌、乳腺癌等),被认为是体内氧化应激的敏感生物学标志[1,4,5]。
近年不断增加的研究证据表明,血浆AOPP水平增高促使该分子在肾脏和血管等组织中沉积并与慢性肾脏病(Chronic kidney disease,CK D)及动脉粥样硬化病变的发生发展密切相关[6-8]。慢性AOPP负荷促进糖尿病动物肾脏的炎症反应和肾组织损伤,促使CK D模型的肾脏炎症和纤维化,并促使高脂血症动物发生动脉粥样硬化性病变[6-8]。这些研究结果均表明,AOPP潴留不仅是反映体内氧化应激的指标,其本身可能是一类促进组织炎症和纤维化的生物致病分子。深入探讨AOPP在组织中的分布及其与病变的关系对于阐明AOPP致病的分子基础至关重要,并有可能为上述疾病的发生发展提供新的生物学标志或干预靶标。
然而,检测组织中AOPP水平尚缺乏理想方法。基于AOPP结构含双酪氨酸,在酸性条件下于340 nm处有一特异吸收峰。故目前通常采用将待测血浆样本或组织标本制成匀浆,而后用分光光度计分析340 nm处吸光度值以反映标本中AOPP水平[6-9]。此法虽然简便,但存在以下缺点:①比色法受血脂、纤维蛋白的干扰而影响其准确性[10,11];②无法观察AOPP在病变组织(或细胞)中的定位;③分析所需组织量较多,临床活检标本难以达到要求。
为了克服以上缺点,我们采用体外次氯酸修饰的白蛋白作为抗原,成功制备了特异性识别AOPP的多克隆抗体,并通过免疫组织化学染色首次证实该抗体可有效识别AOPP在肾脏组织的沉积和分布,为深入研究AOPP这种内源性致病分子提供了有用的工具。
1 材料与方法
1.1 试剂及实验动物 兔血清白蛋白(Rabbit serum albumin,RSA)、人血清白蛋白(Human serum albumin, HSA)、鼠血清白蛋白(Mouse serum albumin,MSA)、弗氏完全佐剂、弗氏不完全佐剂及Carboxymethyl-HSA (CML-HSA)、glycolaldehyde-HSA(G A-HSA)均购自Sigma公司,Detoxi-Gel去内毒素凝胶柱购自 Pierce公司。CNBr活化的Sepharose 4B购自GE公司。其它试剂均为国产分析纯。新西兰家兔(2.5±0.25千克),购于南方医科大学实验动物中心。
1.2 无内毒素AOPP-RSA的制备及定量 参考Witko-Sarsat等[1]报道方法制备,将 RSA与次氯酸(HOCL)以1/140的摩尔比例混合室温反应30分钟, PBS透析24小时去除残留次氯酸,样品经Detoxi-Gel凝胶柱去除内毒素,所获样品内毒素水平低于0.025 EU/ml。同时按上述方法制备AOPP-MSA、AOPP-BSA、AOPP-HSA。
[Abstract]OPP的定量参照文献[8]进行,取10μl 1.16 mol/L KI、20μl醋酸,各加入到200μl氯胺T(0~100 μmol/L)溶液中,作为标准品。样品测量则取样品200μl置于96孔板,加入20μl醋酸,立即测340 nm的吸光度值。依此方法计算得AOPP-RSA中AOPP的含量为(4.3±0.6)nmol/mg蛋白,而未修饰的RSA中AOPP含量为(0.2±0.02)nmol/mg蛋白。
1.3 兔抗AOPP血清的制备 采用常规免疫方式,即取AOPP-RSA 2 g/L加等体积弗氏完全佐剂充分乳化后,于家兔背部皮下多点及脚垫免疫,间隔3周再以AOPP-RSA 2 g/L加等体积弗氏不完全佐剂乳化后皮下多点免疫。尔后每隔2周重复免疫,每次免疫后7天抽取少许静脉血分离血清,检测效价,至效价达10-5以上后,采血分离血清。
1.4 抗AOPP抗体的纯化 将AOPP-BSA 10 mg与CNBr活化的Sepharose 4B偶联,按常规方法制备亲和层析柱。4℃条件下,用0.01 mol/L PBS(含0.5 mol/L NaCl)溶液洗柱并平衡,加入PBS稀释的免疫血清,上样速度1 ml/min。PBS充分流洗后以0.1 mol/L(pH2.8)甘氨酸缓冲液洗脱。收集洗脱液,立即用1/20体积的1 mol/L Tris-HCl(pH9.0)中和并透析至PBS中,BCA法进行蛋白定量。
1.5 抗AOPP抗体的效价和特异性鉴定 以AOPPRSA 10 mg/L包被酶标板,酪蛋白封闭液(1L溶液中包含Tris 1.21 g、明胶2 g、蔗糖20 g、硫柳汞0.2 g、酪蛋白2.5 g)封闭后,加入以1∶1 000起始倍比稀释的免疫血清,37℃孵育30分钟后加入HRP-羊抗兔多抗(1∶5 000稀释,北京鼎国生物公司),37℃30分钟TMB底物显色,2 mol/L H2SO4终止反应。测定OD 450值。
分别将 HOCL氧化的人血清白蛋白(AOPPHSA)、鼠血清白蛋白(AOPP-MSA)、兔血清白蛋白(AOPP-RSA)(同时以各种属非氧化白蛋白为阴性对照)、晚期糖基化终产物(Advanced glycation end product,AGE)CML-HSA和G A-HSA以10 mg/L 4℃过夜包被酶标板,酪蛋白封闭液封闭后,依次加入纯化的抗AOPP多克隆抗体5 mg/L、HRP-羊抗兔多抗,反应条件均为37℃30分钟,TMB底物显色,2 mol/L H2SO4终止反应。测定OD 450值。
1.6 非变性聚丙烯酰胺凝胶电泳以及Western blot
配制3.9%积层胶、7.5%分离胶(试剂中不含SDS、β-巯基乙醇),将HSA(Sigma)、正常人(年龄20~30岁,n=4)及慢性肾功能衰竭患者血浆(n=4)样品加入泳道(每孔加入20μg蛋白),100 V电泳6小时后,转膜,以10%脱脂奶封闭PVDF膜,4℃过夜,依次加入兔抗AOPP多抗(10 mg/L)、HRP-羊抗兔多抗,ECL鉴定。
1.7 免疫组织化学 将CK D模型大鼠肾(以正常大鼠肾脏为对照)、不同肾脏疾病患者肾活检组织行石蜡切片,常规脱蜡,置 0.01 mol/L枸橼酸盐缓冲液(pH6.0)中微波抗原修复,分别滴加0.3%H2O2-甲醇溶液,室温避光孵育20分钟,正常山羊IgG封闭(100 mg/L,4℃过夜),抗AOPP多抗(10 mg/L,室温30分钟)、HRP-羊抗兔多抗(室温,30分钟),显微镜下控制DAB显色,苏木素复染,中性树胶封固。免疫组化染色过程中,每例均以正常兔IgG作为阴性对照。
1.8 统计学处理 上述所有实验重复三次以上,实验数据表示为±s,用SPSS10.0软件进行随机方差分析(one-way ANOVA)。
2 结果
2.1 免疫血清效价及其识别AOPP的特异性 如图1所示抗血清与AOPP-RSA结合的效价为1.0× 10-6;与AOPP-HSA结合效价达2.56×10-5,与非氧化型HSA无交叉反应。初步确定免疫血清特异性识别AOPP-RSA和AOPP-HSA。

图1 免疫血清效价测定Fig.1 Titers of anti-AOPP sera

图2 抗AOPP多抗与不同种属来源的氧化白蛋白特异性结合Fig.2 Indirect ELISA showing the reactivity of the polyclonal antibodies to AOPP-albumin from different genus
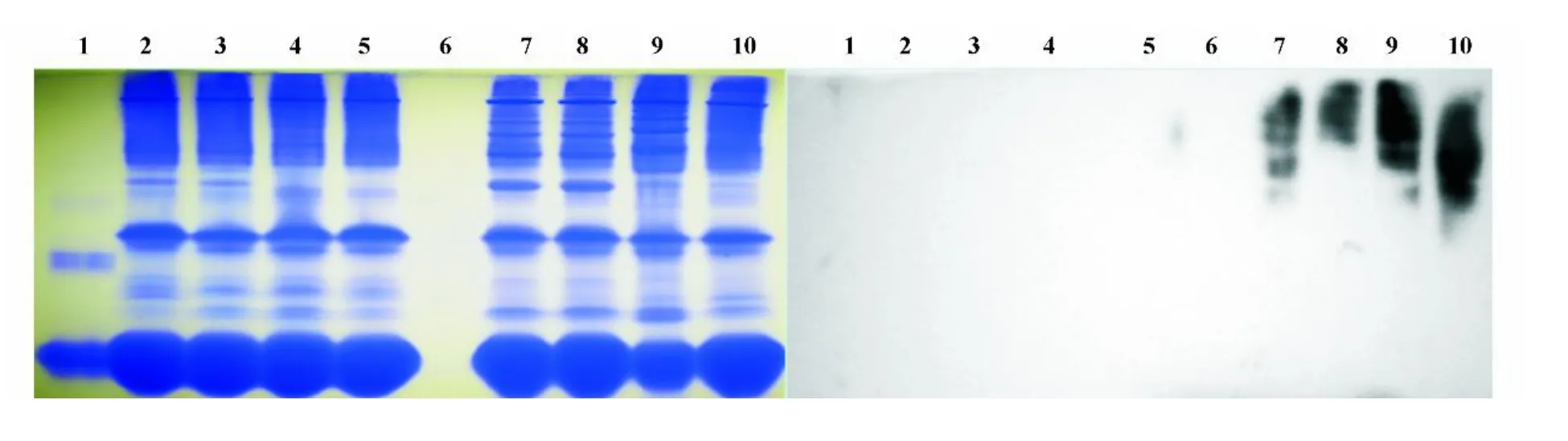
图3 基于非变性电泳的Western blot鉴定健康者及CK D患者血浆中AOPPFig.3 Detection of plasma AOPP from healthy donors and CK D patients by Western blot based on native PAGE
为进一步鉴定制备的抗体可特异性识别HOCL氧化的基团,我们以亲和层析纯化兔抗AOPP多抗,间接ELISA结果显示:纯化的多抗与AOPP-MSA、AOPP-RSA、AOPP-BSA和AOPP-HSA都能结合,而与各种正常白蛋白及糖化修饰白蛋白(CML-HSA,G AHSA)均无交叉反应(P<0.001)(图2)。提示我们所获得的抗体针对各种氧化型蛋白的共同氧化基团。鉴于AOPP结构以双酪氨酸为主形成的白蛋白聚体,如果在变性与还原条件下进行PAGE及后续的Western blot则可能导致制备的多抗无法识别氧化基团,因此我们采用基于Native PAGE的Western blot,结果显示该多抗仅与CK D患者血浆蛋白高分子量聚集区域结合(非单一条带),而与商品人血浆白蛋白及健康者血浆成分无交叉反应(图3)。
2.2 CK D大鼠肾组织及CK D患者肾组织免疫组织化学染色 CK D大鼠肾组织切片:免疫组化染色可见AOPP沉积,主要分布于肾小管(图4A箭头所示)。非免疫IgG不能识别CK D大鼠肾组织中沉积的AOPP(图4B)。正常大鼠肾组织抗AOPP抗体染色阴性(图4C)。

图4 抗AOPP多抗免疫组化染色CK D大鼠肾组织Fig.4 The deposition of AOPP in renal tissues of CK D rat detected by immunohistochemistry using anti-AOPP antibody

图5 免疫组织化学法检测AOPP在不同CK D患者肾组织中沉积部位不同Fig.5 The deposition of AOPP in in renal tissues of CK D patients detected by immunohistochemistry using anti-AOPP antibody
对各种CK D患者肾活检组织切片进行抗AOPP抗体免疫组化染色。结果显示:①糖尿病肾病伴大量蛋白尿者肾小管上皮细胞间可见明显的AOPP沉积,肾小管管腔中可见含AOPP的蛋白管型(图5A箭头所示);而非免疫的兔IgG不能与肾组织(来自于糖尿病肾病患者)反应(图5B)。②在炎症和增生性肾小球疾病,如过敏性紫癜肾炎、IgA肾病慢性肾脏病中,AOPP沉积主要见于肾小球,也可见于肾小管(图5C、D箭头所示)。非炎症性肾小球疾病如微小病变,肾组织中未见AOPP沉积(图5E)。上述结果表明在针对氧化代谢紊乱的肾组织,抗AOPP抗体阳性染色是特异性的。
3 讨论
本项研究应用免疫学方法成功制备了抗AOPP多克隆抗体。应用该抗体证实了血浆AOPP的存在,并用免疫组化证明了AOPP在大鼠和人类CK D肾组织中的沉积及定位。这些结果尚属首次报道。
已知动脉粥样硬化、慢性肾功能不全等存在AOPP潴留的疾病往往同时伴有高脂血症。高甘油三酯导致样本浊度增加,从而过高估计AOPP水平[10]。Anderstam等[12]利用硫酸葡聚糖沉淀样本中的甘油三酯以克服这一缺点,但该法需要特殊的试剂盒并使AOPP测定值也降低38%。此外,反复冻融后致样本浊度增高也影响AOPP检测。因此目前尚无能够准确而简便地判断AOPP水平的临床检测方法。基于特异性抗原抗体反应的检测方法可有效避免非抗原因素的干扰,我们制备了高效价的兔抗AOPP多克隆抗体。实验证实,该抗体可识别被HOCL氧化修饰的不同种属的白蛋白,而与非氧化白蛋白不反应(图1);此外,该抗体也可与次氯酸氧化的球蛋白、人低密度脂蛋白(Low-density lipoprotein,LDL)反应,但不与非氧化型球蛋白及Cu2+氧化修饰的LDL反应(上述数据未在图中显示)。CK D患者体内除AOPP外还存在其他形式的白蛋白修饰,其中最主要的是蛋白质糖基化修饰产物——晚期糖基化修饰蛋白(AGE)。近期的研究表明,AOPP和AGE的受体都是人晚期糖基化终产物受体(human receptor for advanced glycation end product,RAGE)[13],说明在结构上AOPP和AGE具有相似性,实验结果显示该抗体与AGE主要成分CML-白蛋白和G A-白蛋白无交叉反应(图2),证实我们制备的抗体特异性识别被HOCL修饰白蛋白的氧化基团。Western blot的结果显示纯化的抗AOPP抗体能特异地与慢性肾衰患者血浆中蛋白高分子聚合物结合,但并非单一条带,推测由于患者血浆中可能存在不同程度的氧化蛋白所致的蛋白聚合体,而我们制备的多抗可以识别氧化程度和聚合程度各异的蛋白(图3)。尽管抗AOPP抗体针对的抗原决定簇尚有待确定,但上述资料提示,这是一种特异性识别AOPP特定结构的抗体,可以用于下一步建立免疫学方法去检测循环和组织中的AOPP水平。
以往研究已证实,AOPP修饰的白蛋白对组织细胞具有炎症介质作用[14-16]。郭志坚等[13]的工作显示我们制备的多抗在体外实验中拮抗AOPP引起的人内皮细胞氧化应激,提示它具有中和活性,可用于进一步研究AOPP的病理生物学作用和干预。
本研究首次报道用特异性针对蛋白质氧化基团的多克隆抗体,通过免疫组化染色,清楚显示了在实验性CK D和CK D患者肾组织中AOPP的沉积及其分布。初步观察结果显示,AOPP沉积似乎只发生于某些特定的CK D,它与CK D发生、发展的关系是值得进一步研究的问题。
综上,我们制备了一种高效价、特异性针对白蛋白氧化修饰基因的多克隆抗体,采用这种抗体,我们首次观察了AOPP在实验性CK D和CK D患者肾组织的分布,为进一步研究AOPP的致肾病机制和临床病理诊断提供了新工具。
致谢:感谢南方医院肾内科周展眉老师、汪永平博士对免疫组化实验提供的帮助。
1 Witko-Sarsat V,Friedlander M,Capeillère-Blandin Cet al.Advancedoxidation protein products as a novel marker of oxidative stress in uremia[J]. K idney Int,1996;49(5):1304-1313.
2 KalousováM,Skrha J,Zima T.Advanced glycation end-products and advanced oxidation protein products in patients with diabetes mellitus[J]. Physiol Res,2002;51(6):597-604.
3 Atabek M E,Keskin M,Yazici Cet al.Protein oxidation in obesity and insulin resistance[J].Eur J Pediatr,2006;165(11):753-756.
4 Baskol M,Baskol G,K ocer Det al.Advanced oxidation protein products: a novel marker of oxidative stress in ulcerative colitis[J].J Clin Gastroenterol,2008;42(6):687-691.
5 Chandramathi S,Suresh K,Anita Z Bet al.Comparative assessment of urinaryoxidative indices in breast and colorectal cancer patients[J].J Cancer Res Clin Oncol,2009;135(2):319-323.
6 Shi X Y,Hou F F,Niu H Xet al.Advanced oxidation protein products promote inflammation in diabetic kidney through activation of renal nicotinamide adenine dinucleotide phosphate oxidase[J].Endocrinology,2008; 149(4):1829-1839.
7 Li H Y,Hou F F,Zhang Xet al.Advanced oxidation protein products accelerate renal fibrosis in a remnant kidney model[J].J Am Soc Nephrol, 2007;18(2):528-538.
8 Liu S X,Hou F F,Guo ZJet al.Advancedoxidation protein products accelerate atherosclerosis through promoting oxidative stress and inflammation[J].Arterioscler Thromb Vasc Biol,2006;26(5):1156-1162.
9 Capeillère-Blandin C,Gausson V,Descamps-Latscha Bet al.Biochemical and spectrophotometric significance of advanced oxidized protein products [J].Biochim Biophys Acta,2004;1689(2):91-102.
10 Valli A,Suliman M E,Meert Net al.Overestimation of advanced oxidation protein products in uremic plasma due to presence of triglycerides and other endogenous factors[J].Clinica Chimica Acta,2007;379:87-94.
11 Selmeci L,Szekely M,Soos Pet al.Human blood plasma advacnced oxidation protein products(AOPP)correleates woth fibrinogen levels[J]. Free Radic Res,2006;40(9):952-958.
12 AnderstamB,Ann-Christin B H,Valli Aet al.Modificationof the oxidative stress biomarker AOPP assay:Application in uremic samples[J]. Clinica Chimica Acta,2008;393(2):114-118.
13 Guo ZJ,Niu H X,Hou F Fet al.Advanced oxidation protein products activate vascular endothelial cells via a RAGE-mediated signaling pathway[J].Antioxid Redox Signal,2008;10(10):1699-1712.
14 Witko-Sarsat V,Friedlander M,Khoa TNet al.Advancedoxidation protein products as novel mediators of inflammation and monocyte activation in chronic renal failure[J].J Immunol,1998;161(1):2524-2532.
15 Witko-Sarsat V,Gausson V,Nguyen A Tet al.AOPP-induced activation of human neutrophil and monocyte oxidative metabolism:a potential target for N-acetylcysteine treatment in dialysis patients[J].K idney Int, 2003;64(1):82-91.
16 Wei X F,Zhou Q G,Hou F Fet al.Advancedoxidation protein products induce mesangial cells perturbation through PKC-dependent activation of NADPHoxidase[J].AmJ Physiol Renal Physiol,2009;296(2):F427-437.
[收稿2009-10-20 修回2009-11-20]
(编辑 倪 鹏)
Preparation and application of antibodies against advanced oxidation protein products
LU Xiao,TIAN Jian-Wei,LIU Bei-Yi,HOU Xiao-Rui,ZHU Ping,HOU Fan-Fan,FU Ning.Department of Immunology,Southern Medical University,Guangzhou510515,China
Objective:T o prepare the polyclonal antibodies against advanced oxidation protein products(AOPP),and to provide an effective agent for research on the pathogenesis of AOPP and assess exactly the relationship between AOPP and relative diseases.Methods: AOPP-rabbit serum albumin(AOPP-RSA)was prepared by treating RSA with hypochloric acid.The rabbit anti-AOPP-RSA polyclonal antibodies were generated and purified by affinity chromatography.The titers and the specificityof the antibodieswere measured by ELISA.The plasma AOPP and the localizationof AOPP in nephridial tissuesof some patientswith chronic kidney disease(CK D)were determined using rabbit anti-AOPP-RSA.Results:Titers of the antibodies were 10-6.Purified antibodies reacted specifically with oxidized albumin from different genus,but could not react with normal albumin and glycosylated albumin.The high level of AOPP in plasma from CK D patients was confirmed by Western blot.The antibodies could be used to immunostain AOPP deposition in different regions of kidney tissues from both CK D patients and CK D rat models.Conclusion:We successfully generate rabbit anti-AOPP polyclonal antibodies with high titers and striking specificity.The presence of plasma AOPP and localizations of AOPP in kidney tissues of CK D patients can be demonstrated using the antibodies.The development of anti-AOPP polyclonal antibodies may provide a new tool to explore the pathogensis of AOPP and assess exactly the relationship between AOPP and relative diseases.
Advanced oxidation protein products(AOPP);Polyclonal antibodies;Chronic kidney disease(CK D)
R392.33 文献标识码 A 文章编号 1000-484X(2010)02-0164-05
①本文受NSFC-广东省联合基金资助(No.U0932002)
②南方医科大学南方医院,广州510515
③通讯作者,E-mail:beiyi@fimmu.com
卢 晓(1977年-),男,硕士,实验师,主要从事天然免疫的研究。
