Toll样受体对睾丸Sertoli细胞免疫调节的初步研究①
2010-09-07刘秀芝席晔斌李荣平陈广洁王保国蒋黎华李伟毅
刘秀芝 席晔斌 李荣平 陈广洁 王保国 蒋黎华 李伟毅
(上海交通大学医学院免疫学教研室上海市免疫学研究所,上海200025)
·生殖免疫学·
Toll样受体对睾丸Sertoli细胞免疫调节的初步研究①
刘秀芝 席晔斌 李荣平 陈广洁 王保国 蒋黎华 李伟毅
(上海交通大学医学院免疫学教研室上海市免疫学研究所,上海200025)
目的:研究睾丸Sertoli细胞感染后,T LR发挥免疫调节功能的情况。方法:正常大鼠Sertoli细胞表达T oll样受体的情况以及用溶脲脲原体(Ureaplasma Urealyticum,UU)体外感染Sertoli细胞后,分别在12、24、36小时时间段比较感染组与对照组之间T oll样受体表达变化情况。结果:正常大鼠Sertoli细胞表达T LR2-8,低表达T LR9和10,未检出T LR1和5;与对照组相比,体外感染处理后T LR2、6表达增加。结论:T oll样受体的激活参与Sertoli细胞对炎症的免疫调节,两者具有一定的联系。
大鼠;T oll样受体;支持细胞;免疫调节
睾丸位于阴囊内,是雄性动物的主要生殖器官之一,具有生精和内分泌作用。Sertoli细胞(支持细胞)是睾丸的基质细胞,主要参与血-睾屏障的构建、分泌细胞因子,它是唯一与生精细胞接触的体细胞,以其独特的结构和功能为精子发生提供适宜的微环境,对精子的发生、成熟、获能等起到重要作用[1]。此外,Sertoli细胞还是一种重要的免疫调节细胞[2,3],在睾丸局部抗感染免疫中发挥重要的调节作用,其Fas-FasL系统参与维持大鼠睾丸的免疫豁免作用[4,5]。
[Abstract]oll样受体(T oll-like receptor T LR)是天然免疫系统中特异的I型跨膜受体和病原模式识别受体。T LR在急性炎症反应、细胞信号转导和细胞凋亡中起重要作用。迄今为止,已发现人类表达10种T oll样受体,小鼠表达13种[6]。大肠杆菌感染大鼠睾丸后能引起T LR4的表达变化,激活My-D88非依赖的信号转导途径,产生炎性因子[7]。本实验主要研究睾丸Sertoli细胞体外感染UU时,Sertoli细胞表达T LR的情况,探索其与睾丸免疫调节作用的关系。
1 材料与方法
1.1 实验动物及试剂15~18日龄雄性SD大鼠50只(Sprague Dawley,30~40克,此时睾丸未降至腹腔),购自上海交通大学医学院动科部。胶原酶Ⅱ型、透明质酸酶均购自Worthington公司。DMEM/F-12培养液购自Sigma公司。解脲支原体选择分离培养试剂盒(UU培养液)购自上海恩康生物科技公司。FITC标记的山羊抗兔-IgG抗体购自 KPL公司。Mouse IgG1 Isotype Controlo购自北京四正柏生物科技有限公司。兔抗T LR2(H-175)和T LR6(H-90)购自Santa Cruz公司。2×PCR Master Mix试剂盒(K0171)和MaximaTMSY BR Green QPCR Master Mix(2×)购自Fermentas公司。流式细胞仪(FACSCalibur)购自BD公司。
1.2 UU体外培养 血清8型标准菌株(T960)由加拿大Alberta大学医学微生物和传染病研究所Robeston博士惠赠,将UU标准株T960(冻干品)复苏,于无菌条件下接种于UU培养基中(该培养基是在GC培养基的基础上,添加血红蛋白、血清、酵母提取物、增菌剂、抑菌剂和盐类等制成),37℃孵育18~24小时,观察结果。若培养基颜色由黄色转变成为橙红色,且上清液清亮无混浊,表明UU生长良好无污染。将0.2 ml上述培养液接种至2 ml新鲜培养液内,如此反复接种2~3次,每次孵育16~18小时,培养液显示橙红色,此时UU处于对数生长期、繁殖速度最快、活力最强,作为试验用UU。
1.3 UU效价滴定 UU效价以颜色变化单位(Color-Changing Units,CCU/ml)表示。将上述培养的处于对数生长期的UU倍比稀释,接种于40孔培养板中,37℃孵育48小时,观察结果。颜色变红的最高稀释孔的稀释度即为UU效价。本实验所用效价为1×105CCU/ml。
1.4 方法
1.4.1 Sertoli细胞的分离 SD大鼠颈椎脱臼处死,无菌条件下取出睾丸组织,仔细剥离被膜和血管,用无菌PBS反复冲洗。剪碎为1 mm3,用0.75%Ⅱ型胶原酶和0.2%透明质酸酶消化30分钟,再用0.15%Ⅱ胶原酶和0.04%透明质酸酶消化45分钟,并经200目滤网过滤,用无血清DMEM/F-12培养液调整细胞数至5×105ml-1种于24孔培养板中,于37℃,5%CO2条件下培养。24小时后吸弃培养液,用50 mmol/L Tris-HCl缓冲液(pH7.4)低渗处理3~5分钟去除大部分精原细胞,用PBS冲洗后可获得高纯度Sertoli细胞(>95%)[8],加入培养液继续培养。
1.4.2 UU感染Sertoli细胞 达到实验效价要求的UU以200μl/孔的量分别加于实验组各孔中。空白对照组与已感染 UU的实验组 Sertoli细胞均在37℃,5%CO2条件下培养。
1.4.3 RT-PCR反应 细胞总RNA抽提按TRIzol试剂盒中的说明书进行操作,并经紫外分光光度仪测定浓度。逆转录反应按SuperscriptⅡ试剂盒中的说明书操作。Premier5引物设计软件设计的11种PCR引物见表1。取cDNA3μl(1μg),2×PCR Buffer 12.5μl,引物100 ng,加Water(nuclease-free)至25μl。循环条件:94℃预变性3分钟,94℃变性46秒,退火1分钟(T LR1-4,T LR6-10,β-actin 55℃,T LR5 58℃), 72℃延伸80秒,共30个循环,72℃共延伸10分钟。取PCR扩增产物25μl进行琼脂糖凝胶电泳(凝胶浓度15 g/L),用凝胶成像系统及分析系统进行条带分析,β-actin作为内参照,标准化各组 T LR mRNA含量。
1.4.4 Real-Time PCR检测T LR2和 T LR6表达MaximaTMSY BR Green qPCR Master Mix(2×)12.5μl,上下游引物各0.5μmol/L,cDNA<500 ng,Water(nuclease-free)至25μl。两步循环:50℃预处理2分钟,初变性95℃10分钟,95℃15秒变性,60℃60秒退火延伸40个循环。计算2-ΔΔCT值。
1.4.5 流式细胞术检测T LR2和T LR6表达 对照组和UU刺激12、24、36小时的实验组贴壁Sertoli细胞,先用0.25%胰酶消化,再按3×105细胞/管加入流式细胞管中,然后用预冷PBS(含1 000 mg/L BSA)洗涤,1∶500稀释的兔抗大鼠T LR2、T LR6及纯化的Mouse IgG1 Isotype Controlo各20μl/管37℃孵育1小时,加20μl FITC标记的山羊抗兔-IgG抗体,室温避光15~20分钟,2%多聚甲醛固定,用流式细胞仪检测T LR2和T LR6的表达情况。
1.5 统计学分析 采用两样本均数比较,t检验(t检验前先做两样本的方差齐性检测),分析软件为SPSS11.0.1。
2 结果
2.1 在倒置显微镜下观察Sertoli细胞可见有单个的细胞,亦有7~8个细胞形成的小细胞团,24小时后完全贴壁,以多角形展开,呈片状,胞质中含脂滴,在无血清DMEM/F-12培养液中培养两周,细胞仍贴壁,生长良好,与文献[9]报道一致。Sertoli细胞生长情况见图1(24小时贴壁情况)。分离培养两天后的细胞经透射显微镜分析、鉴定,可见细胞内有2~3个核仁,细胞间有紧密连接,为典型的Sertoli细胞,见图2。
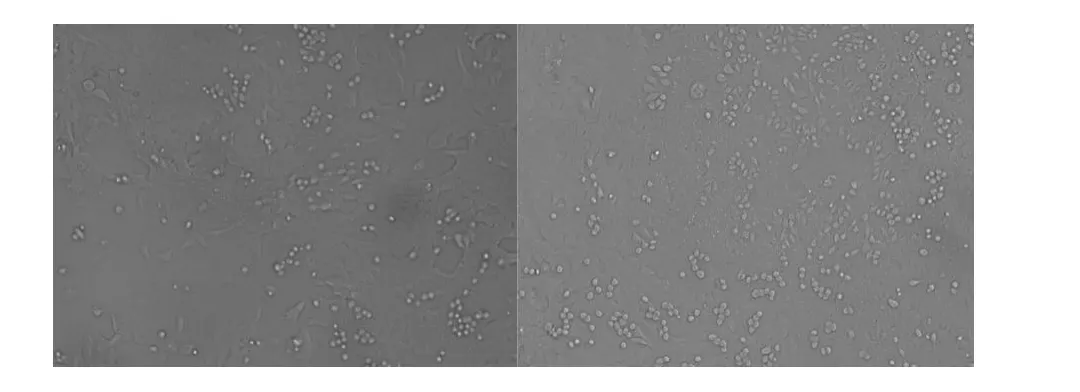
图1 倒置显微镜下观察到的Sertoli细胞(1∶100)Fig.1 Microscopy of isolated Sertoli cells(1∶100)
2.2 正常大鼠Sertoli细胞表达T LRs的情况 体外培养的Sertoli细胞经50 mmol/L Tris-HCl缓冲液纯化处理后,提取细胞总RNA,用RT-PCR检测细胞表达T LR的情况,得知正常Sertoli细胞高表达T LR2-8,低表达T LR9和10,未检出T LR1和5表达,见图3。
2.3 UU感染后 T LR mRNA表达情况 Real-time QPCR的实验结果显示UU感染Sertoli细胞12小时后,与对照组相比T LR2的mRNA含量显著增加并持续到24小时(P<0.05),而在36小时开始降低;与对照组相比T LR6的mRNA含量在12小时开始增加,24小时显著增多(P<0.01),而在36小时开始降低,见图4。 2.4 UU感染后T LR2和T LR6蛋白水平表达变化情况 流式检测结果说明UU感染24小时后,T LR2的表达显著增加至83.39%±6.65%,而在36小时降至39.81%±4.32%,与同时间段mRNA水平的变化情况一致;感染24小时后T LR6的水平也是显著增加,而在36小时表达降低,结果具有统计学意义,见图5,表2、3。
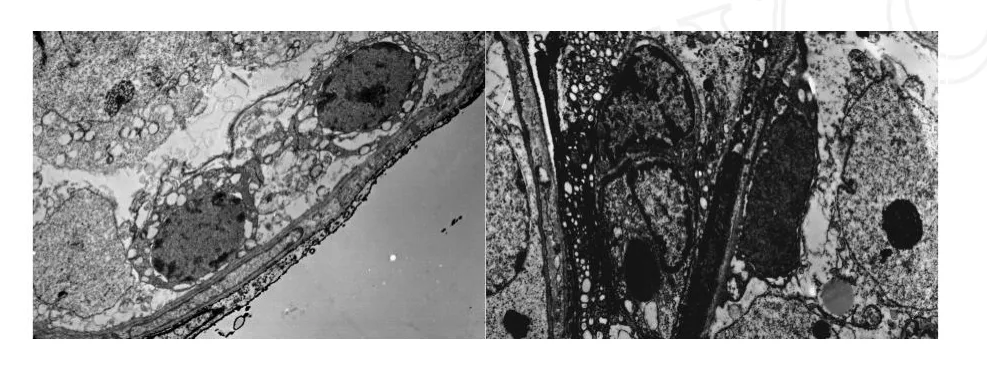
图2 电镜下观察到的Sertoli细胞Fig.2 Electron micrograph of cultured Sertoli cells
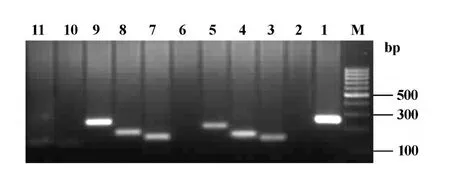
图3 正常大鼠Sertoli细胞TLR mRNA的表达情况Fig.3 The expression levels of TLRs mRNA in normal rat Sertoli cell
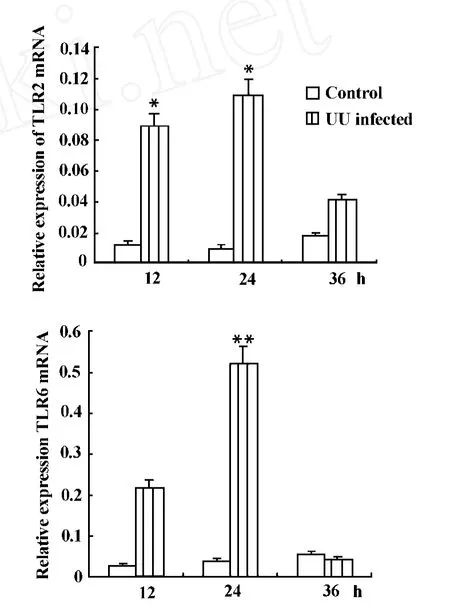
图4 不同时间段TLR2 mRNA和TLR6 mRNA在正常对照组与感染组的表达Fig.4 The expression levels of TLR2 mRNA and TLR6 mRNA in normal controls and infected group in different times

表1 RT-PCR及实时定量PCR使用的引物序列表Tab.1 The primers in RT-PCRand Real-time PCR
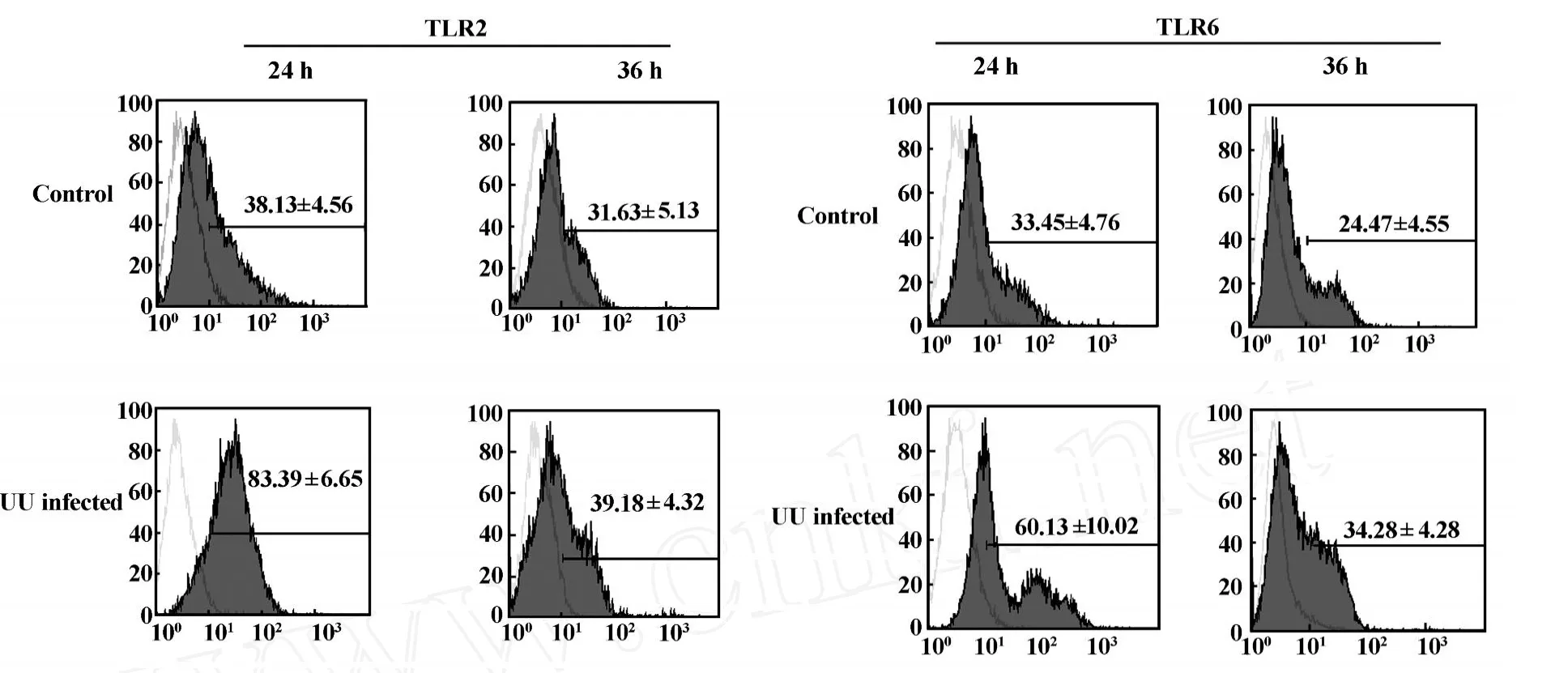
图5 UU感染Sertoli细胞后TLR2和TLR6的表达变化Fig.5 The expression levels of TLR2 and TLR6 in normal controls and infected group

表2 不同时间段UU感染对TLR2 mRNA及蛋白水平的影响Tab.2 The effect of UU on expression of TLR2 mRNA and protein in Sertoli cells

表3 不同时间段UU感染对TLR6 mRNA及蛋白水平的影响Tab.3 The effect of UU on expression of TLR6 mRNA and protein in Sertoli cells
3 讨论
[Abstract]LRs是一类诱导早期天然免疫,并与随后的适应性免疫应答一起调控细胞间相互作用的受体。T LRs最初是作为一种参与果蝇胚胎背腹轴形成的重要蛋白质被发现的。1997年人类T oll蛋白的氨基酸序列被报道,因其与果蝇T oll蛋白的结构同源性较高,故称之为 T oll样受体(T oll-like receptors, T LRs)[10]。目前在哺乳动物中发现十几种T LRs,其中T LR1-9是人和小鼠共有的。
哺乳动物的T LRs在结构上分为胞外区、跨膜区和胞内区、胞外区与其识别PAMPs功能相关,富含亮氨酸(故又称为LRR区,leucine rich repeat domain);胞内区与T LRs信号传导功能相关并与Z L.1、Z L.18受体胞内区高度保守,而称作TIR区(T oll interleukin 1 receptor domain)。大部分T LRs都参与识别病原相关分子模式(Pathogen associated molecular patterns,PAMPs)的高度保守的微生物成分,例如对肽聚糖及真菌类的酵母等的识别是通过T LR2介导的;对脂多糖(LPS)的识别是通过T LR4介导的[11]。T LRs是最重要的模式识别受体(Pattern recognition receptors,PRRs),哺乳动物免疫系统通过多种 T LRs与其各种配体的相互作用识别病原微生物的入侵,并激发体内免疫效应。
国内外众多研究发现不明原因不育男性精液中UU的检出率明显高于正常生育男性,提示UU感染与男性不育有密切关系[12]。它在大鼠生殖系统能长期寄生并迁移,造成睾丸组织广泛病理改变、生精细胞凋亡[13]。睾丸有两道防御屏障,一是睾丸巨噬细胞和Leydig细胞,二是管周平滑肌细胞和Sertoli细胞。TNF-α能激活MAPK途径和NF-κB途径,导致Sertoli细胞产生粘附分子ICAM-1和VCAM-1,引起IL-6的增加[14]。T LRs不仅可以通过固有免疫发挥防御作用,而且可启动特异性免疫。本实验中,我们用RT-PCR检测了大鼠睾丸Sertoli细胞表达T LRs mRNA的情况,结果表明其能组成性高表达T LR2-8,低表达T LR1、9、10,与文献报道的小鼠表达情况类似[15]。
[Abstract]ertoli细胞是生精上皮中唯一与精原细胞接触的体细胞,它参与维持免疫豁免,防御病原微生物入侵。T LR2和T LR6可联合识别革兰阳性菌的成分如肽多糖、脂肽、脂蛋白和霉浆菌的脂肽[16]。Shimizu等[17]证实UU的脂蛋白p75和p55等MB抗原能激活NF-κB信号途径,诱导T LR1、2、6的增加。本实验数据表明:UU感染Sertoli细胞12小时后,与对照组相比T LR2和T LR6的mRNA含量开始增加,24小时继续增多,36小时开始降低。同时,流式细胞仪检测T LR2和T LR6的蛋白水平表明,UU感染Sertoli细胞24小时时,T LR2明显增加,36小时T LR2和T LR6的表达下降,这与Real-Time QPCR的结果相符,说明在感染早期,T LRs发挥防御作用。
我们下一步研究中,将在蛋白水平检测UU感染Sertoli细胞后信号途径的激活情况,用T LR受体抑制剂抑制NF-κB、MAPK信号转导通路,观察信号转导通路被抑制后,哪些细胞因子的分泌会发生变化,从而说明细胞因子对应何种信号转导通路。同时会进一步深入研究ZNF265对T LR介导的信号转导的影响。
1 Fijak M,Menhardt A.The testis in immune privilege[J].Immunol Rev, 2006;213(10):66-81.
2 Restifo N P.Not so Fas:re-evaluating the mechanismsof immune privilege and tumor escape[J].Nat Med,2000;6(5):493-495.
3 Green D R,Ferguson TA.The role of Fas ligand in immune privilege[J]. Nat Rev Mol Cell Biol,2001;2(12):917-924.
4 陈广洁,李伟毅,席晔斌 et al.睾丸局部感染时Sertoli细胞IL-1、IL-6mRNA的表达[J].免疫学杂志,2002;18(1):41-43.
5 王 炜,严律南,赵永恒.睾丸支持细胞免疫豁免功能的研究[J].中国现代普通外科学进展,2004;7(1):23-25.
6 Takeda K,Akira S.T oll-like receptors in innate immuity[J].Int Immunol,2005;17:1-14.
7 Bhushan S,Tchatalbachev S,K lugJet al.Uropathogenic Escherichia coli block MyD88-dependent and activate MyD88-independent signaling pathways in rat testicular cells[J].Immunol,2008;180(8):5537-5547.
8 李宝国,徐群渊,高福禄.大鼠睾丸细胞与精原细胞的分离及共培养[J].解剖学报,2007;38(1):118-120.
9 黄东晖,赵 虎,田永红 et al.大鼠睾丸支持细胞的分离、纯化和鉴定[J].解剖学报,2007;38(2):246-249.
10 Medzhitoy R,Preston-Hurlburt P,Janeway C A.A human homologene of the drosophila toll protein signals activation of adaptive immunity[J]. Nature,1997;388(6640):394-397.
11 Eckert M,Wittmann I,Rollinghoff Met al.Endotoxin-induced expression of murine bacteridal permeabilityor increasingprotein is mediated exclusively by T oll/IL-1 receptor domain-containing adaptor inducing IFN-beta-dependent pathways[J].Immunol,2006;176(1):522-528.
12 Xu C,Wang Y F.Localization of Ureaplasma umalyticum on human sperm atozoa[J].Reprod Contracept,1994;5(3):8-18.
13 Shang XJ,Huang Y F,Xiong C Let al.Ureaplasma umalyticum infection and apoptosis of spermatogenic cells[J].Asian J Androl,1999;1 (3):127-129.
14 Ricciooli A,Starace D,Alessio A Det al.TNF-αand IFN-γregulate expression on andfunctionof the Fas syetem in the seminiferous epithelium [J].Immunol,2000;165(2):743-749.
15 Wu H,Wang H,Xiong Wet al.Expression patterns and functions of T oll-like receptors in mouse Sertoli cells[J].Endocrinology,2008;149 (9):4402-4412.
16 Akeuchi O,Hoshino K,Kawai Tet al.Differential roles of T LR2 and T LR4 in recognitionof gramnegative and gram-positive bacterial cell wall components[J].Immunity,1999;11(3):443-451.
17 Shimizu T,K ida Y,Kuwano K.Ureaplasm parvum lipoproteins,including MB antigen,activate NF-κB through T LR1,T LR2 and T LR6[J].Microbiology,2008;154(5):1318-1325.
[收稿2009-07-22 修回2009-12-07]
(编辑 许四平)
The preliminary research of relationship between Toll-like receptor and the immunoloregulation of Sertoli cell
LIU Xiu-Zhi,XI Ye-Bin,LI Rong-Ping,CHENG Guang-Jie,WANG Bao-Guo,JIANG Li-Hua,LI Wei-Yi.Department of Immunology,Shanghai Jiaotong University Medical School,Shanghai Institute of Immunology,Shanghai200025,China
Objective:T o investigate the relationship between T oll-like receptor and the immune regulation about inflammation by Sertoli cell in vitro.Methods:Here we examined the expression and potential functions of T LRfamily in rat Sertoli cells.Usingour well-characterized urealyticum(UU)induced model we tested the expression changes of T LR2 and T LR6 at12th,24th,36thhours after UU infection in vitro. Results:We demonstrated that T LR2-8 are highly expressed;T LR9 and T LR10 are expressed at relatively low level;the expression of T LR1 and T LR5 are not detected in normal rat Sertoli cells.Comparing with control group,Sertoli cells express more T LR2 and T LR6 after infected by UU.Conclusion:There is some relationship between the activation of T LRs and the immune regulation about inflammation by Sertoli cell.
Rat;T oll-like receptor;Sertoli cell;Immunoloregulation
R392.12 文献标识码 A 文章编号 1000-484X(2010)02-0155-05
①本文受上海市教育委员会科研创新项目-重点项目(No.09ZZ117)和上海市免疫学研究所科研项目资助(08A05)
刘秀芝(1983年-),女,硕士,主要从事生殖免疫、免疫调节研究,E-mail:xiuzhiliu1028@163.com;
及指导教师:李伟毅(1953年-),男,教授,主要从事生殖免疫调节的研究,E-mail:liweiyi@sjtu.edu.cn。
