IL-7对胸腺T细胞及树突状细胞体外分化发育的影响①
2010-09-07许云云李毅平徐小霞朱守兵张学光
许云云 王 泳 李毅平 李 芳 徐小霞 朱守兵 张学光
(苏州大学医学生物技术研究所,苏州215007)
IL-7对胸腺T细胞及树突状细胞体外分化发育的影响①
许云云 王 泳 李毅平 李 芳 徐小霞 朱守兵 张学光
(苏州大学医学生物技术研究所,苏州215007)
目的:探讨IL-7对胸腺T细胞及胸腺树突状细胞分化的影响。方法:摘取15~16日龄胎鼠胸腺进行体外器官培养(胚胎胸腺器官培养-FTOC),分别将细胞因子IL-7和培养基滴加在胸腺小叶上,12天后收集不同条件下经FTOC培养获得的胸腺细胞,流式细胞仪检测细胞表面分子CD4、CD8、CD11c、B220、Ia等的表达,通过光学显微镜观察细胞形态,通过细胞计数检测细胞数目的变化。再将经FTOC培养获得的胸腺细胞和异源的T细胞进行混合淋巴细胞反应,通过MTT法检测T细胞的增殖情况。结果:细胞计数结果表明添加外源性IL-7组的胸腺细胞数目明显减少,流式细胞仪检测结果显示其中胸腺CD4-CD8-双阴性细胞及CD8+单阳性细胞比例有所增加,而CD4+CD8+双阳性细胞比例显著下降,CD4+单阳性细胞比例没有明显变化;此外,B细胞和树突状细胞、NK细胞数量均有不同程度的增加。结论:IL-7在胸腺T细胞及胸腺树突状细胞的分化发育中发挥重要的调节作用。
胚胎胸腺器官培养;IL-7;胸腺T细胞;胸腺树突状细胞
胸腺是T细胞分化、成熟的中枢免疫器官,也是驯化和选择T细胞的场所。在T细胞分化、成熟过程中,发生选择作用,即阳性选择和阴性选择[1,2]。胸腺输出T细胞数量与质量直接影响免疫系统整体功能。胸腺微环境是不可替代的,不但提供胸腺细胞发育所需一系列细胞因子,胸腺细胞与胸腺基质细胞之间的接触也至关重要。
IL-7在胸腺的分化发育过程中是一种必需的细胞因子[3-5]。目前,许多体外实验已经证明 IL-7影响胸腺前体细胞的分化发育[6-9]。Varas等[10]发现,在大鼠的胚胎胸腺器官培养(FTOC)中加入IL-7,能促进胸腺树突状细胞的生成。
本文中,我们运用胚胎胸腺器官培养体系,发现IL-7在小鼠胸腺细胞分化、发育以及胸腺中的树突状细胞生成具有重要的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 8~12周龄雌、雄性C57BL/6小鼠和SCID小鼠购自中国科学院实验动物中心,不同日期的孕鼠由本室负责交配。
1.1.2 实验试剂RPMI1640基础培养基、胎牛血清(FCS)、小牛血清(CS)、丙酮酸钠、非必需氨基酸, 2-巯基乙醇(2-ME)、维生素和HEPES购自美国 G ibco公司;rmIL-7购自美国R&D公司;磷酸盐缓冲液(PBS),Ficoll淋巴细胞分离液购自上海生化试剂二厂;荧光标记抗体:FITC或PE标记的CD4、CD8、CD11c、CD11b、B220、NK1.1、Ia大鼠抗小鼠的标识抗体购自美国eBioscience公司。
1.1.3 实验仪器MACS设备(德国Miltenyi公司);0.8μm微孔滤膜(英国Whatman公司);组织器官培养皿(美国BD falcon公司);Terasaki培养板(日本Sumitomo Bakelite公司);70μm尼龙滤器(美国BD公司);实体显微镜(日本Nikon公司);倒置显微镜(日本Olympus公司);流式细胞仪(美国Beckman-Coulter公司)。
1.2 实验方法
1.2.1 孕鼠交配与鉴定 性成熟雌性小鼠2~3只和雄性小鼠1~2只于前一天下午五点左右合笼,隔日晨九时左右取出雌性小鼠,以见到阴栓形成为确认怀孕日期,并计算为0.5 dpc(Day postcoitus),将其单独饲养,在12天时观察小鼠腹部确认是否怀孕, 15.5~16.5 dpc解剖孕鼠,摘取胎鼠的胸腺小叶用于实验。
实验分为两组:对照组和 IL-7组,对照组为FTOC完全培养基,IL-7组为含 IL-7(20 ng/ml)的FTOC完全培养基。
1.2.2 胎鼠胸腺的获取及胎鼠的胸腺器官培养取孕龄15.5~16.5天的雌鼠,颈椎脱臼处死,70%酒精浸泡10分钟左右,打开其腹腔取出胎鼠,置于含2%~3%小牛血清无钙镁PBS的平皿中,于实体显微镜下解剖胎鼠,取出胸腺小叶,置于组织器官培养皿中培养。培养皿的中心槽内预先加入1.7~2.0 ml的FTOC培养基(RPMI1640,含20%胎牛血清、1 mmol/L丙酮酸钠、1×MEM非必需氨基酸、50μmol/ L 2-ME、1×MEM维生素、20 mmol/L HEPES),中心槽上方放置金属滤网,滤膜置于滤网的中央,胸腺小叶位于滤膜之上,5~6对/皿。培养皿的周围槽内加入2 ml无菌蒸馏水,以保持整个培养环境的湿度。于37℃、5%CO2中培养,每2天更换培养液。
1.2.3 细胞计数及流式细胞仪检测 制备胸腺细胞悬液,即先在培养皿中加入含小牛血清的PBS,将尼龙滤器置入其中,取出FTOC中的胸腺小叶,于滤器中研磨,经PBS洗涤之后,计数,弃上清,加入各FITC/PE标记抗体,混匀,于4℃中孵育20~30分钟,PBS洗两次后,用500μl PBS重悬细胞,经流式细胞仪(FCM)检测细胞表型。
1.2.4 混合淋巴细胞反应 取6~8周BALB/c小鼠的新鲜脾脏,研磨后经淋巴细胞分离液分离(细胞悬液∶分离液=1.5~2∶1),2 200 r/min、20℃离心20分钟,得BALB/c小鼠脾脏单个核细胞。将所得细胞以2×106~3×106ml-1种于6孔板中,贴壁2小时后,轻轻吸取未贴壁细胞,计数,所得经初步纯化的单个核细胞作为反应细胞。将FTOC体系培养,并IL-7处理12天,获得的胸腺细胞为刺激细胞。将反应细胞和刺激细胞按比例混合,种于96孔细胞培养板中。分6个组:培养基对照组(含10%CS的RPMI 1640);实验对照组,即反应细胞组,仅含BALB/c小鼠来源的单个核细胞(105/孔);A、B、C、D组为实验组,含按比例混合的反应细胞和刺激细胞,A组反应细胞∶刺激细胞=300∶1;B组反应细胞:刺激细胞= 100∶1;C组反应细胞∶刺激细胞=30∶1;D组反应细胞∶刺激细胞=10∶1。于37℃、5%CO2中孵育4天后,用MTT法检测T细胞增殖情况。
1.2.5 光学显微镜形态学方法 经FTOC体系培养12天后,同流式细胞仪检测步骤分别收集IL-7组和对照组的细胞,在光学显微镜下观察拍照。
1.2.6 统计学方法 以 x—±s表示。以SPSS Version10.0软件处理,P<0.05为有显著性差异。
2 结果
2.1 IL-7促进CD8+胸腺细胞及双阴性细胞的生成
在胎鼠胸腺器官培养体系中,摘取胎龄为15.5~16.5 dpc胎鼠的胸腺小叶,加入IL-7体外培养12天后,经双色荧光标记后流式细胞仪分析显示:CD4+CD8+胸腺细胞比例下调,CD4-CD8+胸腺细胞及CD4-CD8-双阴细胞的比例上调(图1)。由细胞计数结果可见,在IL-7作用下,体外胸腺器官培养的胸腺细胞总数减少,但是CD8+胸腺细胞及CD4-CD8-双阴细胞绝对数量明显增加(表1)。
2.2 IL-7促进胸腺中其他免疫细胞的生成 胸腺小叶经胎鼠胸腺器官培养体系培养12天后,FCM检测结果显示(图2):IL-7组MHCⅡ、CD11c、B220、CD11b、NK1.1的表达明显上调,分别由36.2%、7.5%、3.6%、7.4%、2.3%增加至44.9%、70.7%、16%、21%、12.7%。其中,髓系树突状细胞(B220-CD11c+,conventional dendritic cells,cDC)和浆细胞样树突状细胞(B220+CD11c+,plasmacytoid dendritic cells,pDC)的表达明显高于对照组。由此提示,IL-7可友效促进胸腺内其他免疫细胞:B、NK、DC细胞的生成。
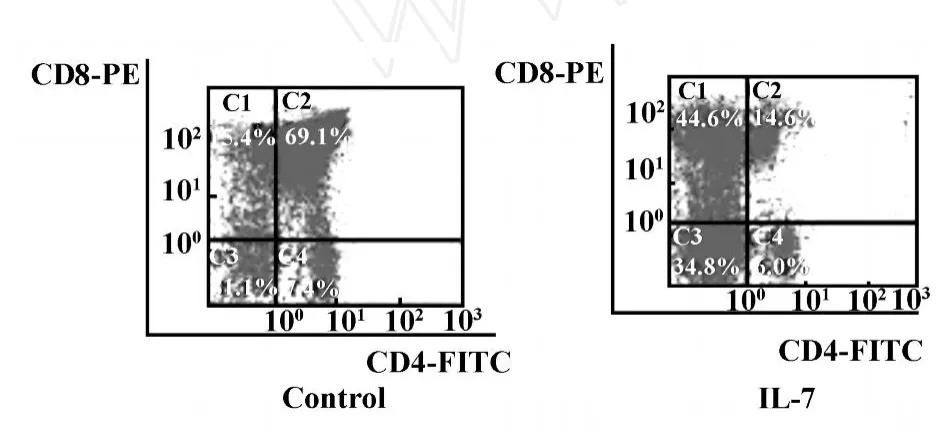
图1 IL-7对FTOC体系中的胸腺T细胞表型影响的FCM分析结果Fig.1 Effect on the phenotype of thymic T cells from FTOC treated with IL-7
2.3 IL-7能促进胸腺树突状细胞的生成和分化发育 为了避免成熟的胸腺T细胞可能对IL-7组DC分化发育产生影响,我们选取SCID鼠作为我们的实验对象。经FTOC培养12天后,较之于对照组,IL-7组胸腺细胞总数增加了3倍,且加入IL-7可增加DC的比例,与对照组相比较,DC数量增加了7倍(表2)。流式细胞仪分析上述胸腺细胞表型,对照组的CD11c表达百分数为23.3%,IL-7组的CD11c上调为36.9%。此外,CD8-CD11c+和CD8-Ia+细胞的比例明显升高,分别由对照组的8.2%和29%上升到了22.8%和43.6%(图3)。由此表明:IL-7能促进胸腺树突状细胞的分化发育。
通过对IL-7组和对照组的胸腺细胞形态分析显示,IL-7组的胸腺细胞中可见有些带有树突状突起的形态不规则的细胞,而对照组的胸腺细胞中大部分为圆形的胸腺T细胞(图4)。
2.4 IL-7诱导的DC具有激发 T细胞作用 在SCID鼠FTOC体系中,IL-7能诱导胸腺树突状细胞的生成。为了证明IL-7组是否能产生功能性树突状细胞,我们用纯化的T细胞作为反应细胞,与IL-7组培养12天的胸腺细胞进行混合淋巴细胞反应。如图5所示,这群细胞具有刺激异源T细胞增殖的能力。由此提示:来自IL-7组的胸腺细胞中的部分细胞不仅具有类似树突状细胞的形态和表达树突状细胞表面特异分子,而且也具有激发T细胞的作用。

表1 FTOC体系中IL-7对胸腺T细胞的影响Tab.1 Effect of IL-7 on thymic T-lymphocytes from mouse FTOC
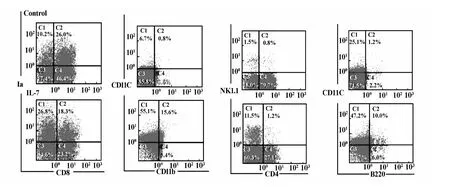
图2 IL-7对FTOC体系中的胸腺内其他细胞表型影响的FCM分析结果Fig.2 Effect on phenotype of other thymic immunocytes recovered from FTOC treated with IL-7

表2 SCID小鼠FTOC体系中IL-7对胸腺细胞的影响Tab.2 Effect of IL-7 on thymocytes from SCID mouse FTOC
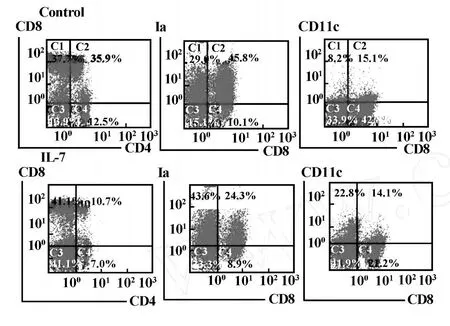
图3 IL-7对SCID小鼠FTOC培养的胸腺细胞表型影响的FCM分析结果Fig.3 Phenotypic analysis of thymocytes raised from SCID mouse FTOC
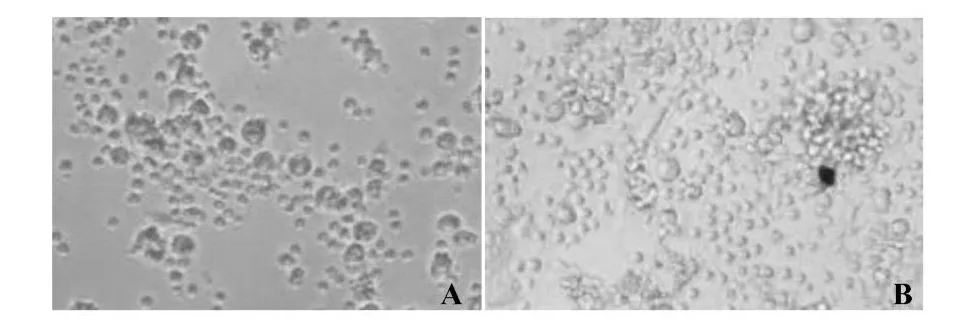
图4 SCID小鼠FTOC培养的胸腺细胞形态学分析Fig.4 Morphology of thymocytes from SCID mouse FTOC
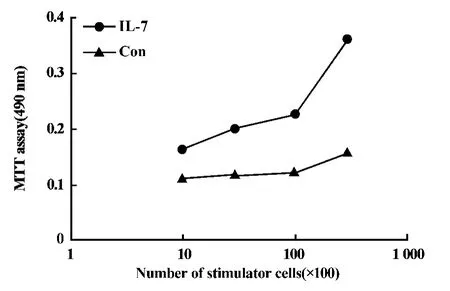
图5 SCID小鼠FTOC培养的胸腺细胞对异源T细胞刺激增殖能力的检测结果Fig.5 MLR-stimulatory capacity of thymocytes generated in SCID mouse FTOC
3 讨论
曾有研究报道,IL-7不仅可以介导B细胞的生成、分化及成熟,而且对T细胞的分化发育有着重要的影响,并且IL-7与胸腺的成熟、老化之间有着重要的联系[11,12]。IL-7是T细胞分化发育以及外周T细胞归巢中至关重要的细胞因子[13,14]。Li等[15]发现,前体T细胞核成熟T细胞的存活均需IL-7的参与。IL-7维持T细胞的存活主要是通过诱导凋亡蛋白Bcl-2的产生以及抑制凋亡前体蛋白Bax、Bad的作用。Van小组[16]研究发现,IL-7在人T细胞的分化发育中发挥重要作用,且是T细胞归巢中的重要一员。Vogt等[17]实验证明IL-7在树突状细胞的分化发育中发挥着重要作用。Varas等[10]在大鼠的FTOC体系中加入IL-7,抑制胸腺细胞总数的增殖,却能够促进前体细胞向CD8阳性胸腺细胞分化发育,同时可以有效地促进胸腺树突状细胞的生成。但有关小鼠FTOC体系中IL-7对胸腺前体细胞向各个群体细胞分化发育的影响的研究,尚无相关报道。
本研究借助小鼠的FTOC体系,发现IL-7在胸腺细胞的分化发育过程中发挥作用,较之于Control组,IL-7组 CD4+CD8+双阳性细胞明显减少,而CD4-CD8-双阴细胞显著增加,此外在一定程度上诱导胸腺树突状细胞及胸腺内其他免疫细胞的生成。
为了避免成熟的胸腺细胞可能对IL-7组DC分化发育的影响,我们选取SCID鼠的作为我们的实验对象。在SCID鼠的胸腺器官培养体系中加入IL-7,会使树突状细胞的数量大量增加,这说明IL-7诱导的树突状细胞的成熟并不依赖于成熟胸腺细胞所分泌的细胞因子。且IL-7受体在树突状细胞上的表达已经被证实[18]。其他因子,如IL-1和TNF-α已经被证实在体外胸腺内前祖细胞分化发育成树突状细胞发挥重要作用[19]。但是,胸腺树突状细胞的最高比例最早在基因学发现的,IL-7高表达,而TNF-α或IL-1在胸腺中没有检测到有表达。由此进一步提示IL-7在胸腺DC分化发育中发挥重要作用。
在体外培养髓系的树突状细胞[20,21],一般来源于外周血或骨髓的CD34+造血前祖细胞或血单核细胞,主要由G M-CSF诱导,通常也可与其他因子如TNF-α、IL-4、SCF联合使用[19,20]。与此相反,淋系的树突状细胞来自早期的胸腺内前祖细胞亚群CD44+CD25-和CD44+CD25+,无需 G M-CSF的诱导。另外,也有研究表明,通过选用过表达G M-CSF的转基因鼠,或体外施加G M-CSF或G M-CSF和IL-4,均不会使脾脏和胸腺中的树突状细胞的数目发生明显的变化。同样的,缺失G M-CSF受体的小鼠以及G M-CSF敲除小鼠中树突状细胞的数目也没有减少[22]。这些结果表明G M-CSF并不是已知树突状细胞亚群分化发育的一个主要的生长因子,由此推知,其他细胞因子将在此过程中发挥作用。近年不断有相关的文献报道,如细胞因子Flt3L能诱导浆细胞样树突状细胞(pDC)的生成,G-CSF诱导外周血单个核细胞的生成,TNF-α诱导树突状细胞的生成[23-25]。
我们的初步结果显示:IL-7可影响胸腺T细胞及树突状细胞的分化发育,IL-7是一系列影响胸腺树突状细胞分化的生长因子中的一种细胞因子,为研究胸腺树突状细胞及其亚群的功能开拓新的思路。
12 Aspinall R.Age-associated thymic atrophy in the mouse is due to a deficiency affecting rearrangement of the TCR during intrathymic T cell development[J].J Immunol,1997;158:3037-3045.
13 Lu N,Wang YH,Arima Ket al.TSLP and IL-7 use two different mechanisms to regulate human CD4+T cell homeostasis[J].J Exp Med, 2009;206:2111-2119.
14 Saini M,Pearson C,Seddon B.Regulation of T cell-dendritic cell interactions by IL-7 governs T-cell activation and homeostasis[J].Blood, 2009;113:5793-5800.
15 Li W Q,Guszczynski T,Hixon J Aet al.Interleukin(IL)-7 regulates Bim pro-apoptotic activity in peripheral T cell survival[J].Mol Cell Biol,2009[published online].
16 Van Lent A U,Dontje W,Nagasawa Met al.IL-7 enhances thymic human T cell development in“human immune system”Rag2-/-IL-2R {gamma}c-/-mice without affecting peripheral T cell homeostasis[J].J Immunol,2009;183:7645-7655.
17 Vogt T K,LinK A,Perrin Jet al.Novel function for interleukin-7 in dendritic cell development[J].Blood,2009;113:3961-3968.
18 Larregina A T,Morelli A E,K olkowski Eet al.Pattern of cytokine receptors expressed by human dendritic cells migratedfrom dermal explants [J].Immunology,1997;91:303-313.
19 Saunders D,Lucas K,Ismaili Jet al.Dendritic cell development in culture from thymic precursor cells in the absence of granulocyte/ macrophage colony stimulating factor[J].J Exp Med,1996;184:2185-2196.
20 Cella M,Sallusto F,Lanzavecchia A.Origin,maturation and antigen presentingfunction oof dendritic cells[J].Curr Opin Immunol,1996;9:10-16.
21 Steinman R M,Pack M,Inaba K.Dendritic cells in the T-cell areas of lymphoid organs[J].Immunol Rev,1997;156:25-37.
22 Vermec D,Lieschke GJ,Dunn A Ret al.The influence of granulocyte/ macrophage colony stimulating factor on dendritic cell levels in mouse lymphoid organs[J].Eur J Immunol,1997;27:40-44.
23 Chen W,Antonenko S,SederstromJ Met al.Thrombopoietin cooperates with FLT3-ligand in the generationof plasmacytoid dendritic cell precursors from human hematopoietic progenitors[J].Blood,2004;103:2547-53.
24 Prasad S,K ireta S,Leedhamet al.Propagation and characterisation of dendritic cells from G-CSF mobilised peripheral blood monocytes and stem cells in common marmoset monkeys[J].J Immunol Methods,2010; 352:59-70.
25 Leplina O Y,Tikhonova M A,Sakchno L Vet al.Effect of dehydroepiandrosterone sulfate on maturation and functional properties of interferon-alpha-induced dendritic cells[J].Bull Exp Biol Med,2009; 148:68-71.
1 Janeway C A.Thymic selection:two pathyways to life and two to death [J].Immunity,1994;1:3-4.
2 Weissman I L.Developemental switches in the immune system[J].Cell, 1994;76:207-208.
3 Von Freeden-Jeffry U,Solvason N,Howard Met al.The earliest T lineage-committed cells depend on IL-7 for Bcl-2 expression and normal cell cycle progression[J].Immunity,1997;7:147-154.
4 Von Freeden-Jeffry U,Vieira P,Lucian L Aet al.Lymphopenia in interleukin IL-7 gene-deleted mice identities IL-7 as a nonredundant cytokine [J].J Exp Med,1995;181:1519-1526.
5 PeschonJ J,Morrissey PJ,Grabstein K Het al.Early lymphocyte expansion is severely impaired in interleukin-7 receptor-deficient mice[J].J Exp Med,1994;180:1955-1960.
6 Suda T,Zlotnik A.IL-7 maintains the T-cell precursor potential of CD3-CD4-CD8-thymocytes[J].J Immunol,1991;146:3068-3073.
7 PlumJ,Desmedt M,Leclercq G.Exogenous IL-7 promotes the growth of CD3-CD4-CD8-CD44+CD25+/-precursor cells and blocks the differatiation pathway of TCR-alpha-beta cells in fetal thymus organ culture [J].J Immunol,1993;150:2706-2716.
8 Moore T A,Zlotnik A.T-cell lineage commitment and cytokine responses of thymic progenitors[J].Blood,1995;86:1850-1860.
9 Varas A,Vicente A,Jimenez Eet al.Interleukin-7 treatment promotes the differatiation pathywayof T-cell-receptor-alpha beta cells selectively to the CD8+cell lineage[J].Immunology,1997;92:457-464.
10 Varas A,Vicente A,Sacedon Ret al.Interleukin-7 influences the development of thymic dendritic cells[J].Blood,1998;92:93-100.
11 Ma′rquez C,Trigueros C,Ferna′ndez Eet al.The development of T and non-T cell lineages from CD34+human thymic precursors can be traced by the differential expression of CD44[J].J Exp Med,1995;181:475-483.
[收稿2009-03-20 修回2009-12-01]
(编辑 张晓舟)
Interleukin-7 influences the development of thymic T lymphocytes and thymic dendritic cells
XU Yun-Yun,WANG Yong,LI Yi-Ping,LI Fang,XU Xiao-Xia,ZHU Shou-Bing,ZHANG Xue-Guang.Medical Biotechnology Institute of Soochow University,Suzhou215007,China
Objective:T o investigate the effect of IL-7 on differentiation of thymic Tlymphocytes and dendritic cells’differentiation in vitro.Methods:Thymic lobes were apspectically removed from 15-day-old or 16-day-old mouse fetueses and were cultured by the way of fetal thymus organ cultures(FTOC)in vitro.Lobes were cultured in the dishes with or without Interleukin-7(IL-7),then collected the cultured cells respectively.The expressionof CD4,CD8,CD11c,B220,Ia,and CD11b was detected byflow cytometry,and the morphologywasobserved under the ligt microscope.The proliferation of these cells was determined by cell counting.The cultured cells were used as stimulatorsfor allogeneic T cells,whose proliferation were detected later by MTT method.Results:The result of cell counting indicated that the total amount of the thymocytes was decresed obviously after being cultured with IL-7,while the proportion of CD4+CD8+thymocytes decreased,the proportion of CD4-CD8-,and CD4-CD8+thymocytes increased,and no much difference in the amount of CD4+CD8-thymocytes was found.In addition,the amount of B lymphocytes,natural killer cells,and dendritic cells increased in different degree.Conclusion:IL-7 participates in differentiation and development of thymic T lymphocytes and dendritic cells.
Fetal thymus organ cultures;Interleukin-7;Thymic T lymphocytes;Thymic dendritic cells
R392.1 文献标识码 A 文章编号 1000-484X(2010)02-0108-05
①本文为国家自然科学基金资助项目(30400395)和国家教育部留学回国人员科研基金资助项目(K5120506)
许云云(1984年-),女,在读硕士,主要从事细胞免疫的研究;
及指导教师:王 泳(1971年-),女,硕士生导师,主要从事小鼠树突状细胞和干细胞的研究,E-mail: yongwangnet@126.com。
