8味中药提取物对MC3T3-E1细胞增殖及碱性磷酸酶活性的影响
2010-09-06冯淑华
冯淑华, 陈 虹, 刘 薇
(1.北京联合大学生物化工学院,北京 100023;2.武警医学院,天津 300162)
现代医学研究证明,骨质疏松是一种多因素引起的骨代谢病。近年的研究报道,补肾中药对骨代谢有综合的、整体调节作用,具有防治骨质疏松的功效,且副作用小,具有良好的应用前景。本文选择具有补肾功能的八种中药进行初步研究,测试它们的不同提取物对成骨样细胞MC3T3-E1增殖和细胞内外碱性磷酸酶的影响[1],为进一步研究其对骨形成的作用和为临床有效利用这些药物提供参依据。
1 材料与方法[1,2]
1.1 材料
成骨细胞MC3T3-E1购自中国协和医科大学细胞中心;3-(4,5-二甲基噻唑-2)-2,5-二苯基-四唑氢溴酸盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium Bromide,MTT)为Sigma公司产品。DMEM(Dulbecco's Modified Eagles Medium,改良Eagles)培养基及胰蛋白酶为Gibeco公司产品。胎牛血清(FBS)购自北京鼎国生物技术责任有限公司。碱性磷酸酶试剂盒购自中生北控生物科技股份有限公司;对硝基苯酚磷酸钠(PNPP)为Sigma分装。氨苄青霉素(Ampicilin sodium salt)、链霉素(Streptomysin)均为美国Amresco公司产品;
SW-LZ-ZFO型超净工作台(中国苏州);Forma 3111型CO2培养箱(美国);Bio-Rad 550型酶标仪(美国);微量振荡仪(中国姜堰市医疗器械有限公司)。
1.2 方法
1.2.1 药物制备 取药材粗粉适量,70%乙醇回流提取2次(2 h/次),减压回收乙醇得浸膏。分别依次用石油醚、氯仿、乙酸乙酯进行萃取,减压回收溶剂,分别得到不同的提取部位,各部分的收率和代号见表1。将各部分溶于适量DMSO,配置成初浓度为250 mg/mL的溶液,超声溶解,待药物完全溶解后保存待用。
1.2.2 细胞培养 将成骨细胞MC3T3-E1接种于含15%胎牛血清、100 μg/mL 青霉素、100 μg/mL链霉素的 MEM 培养基中,置于37℃、5%CO2培养箱中培养。当细胞生长到足以覆盖瓶底壁的大部分表面时,用0.25%胰蛋白酶消化,传代。
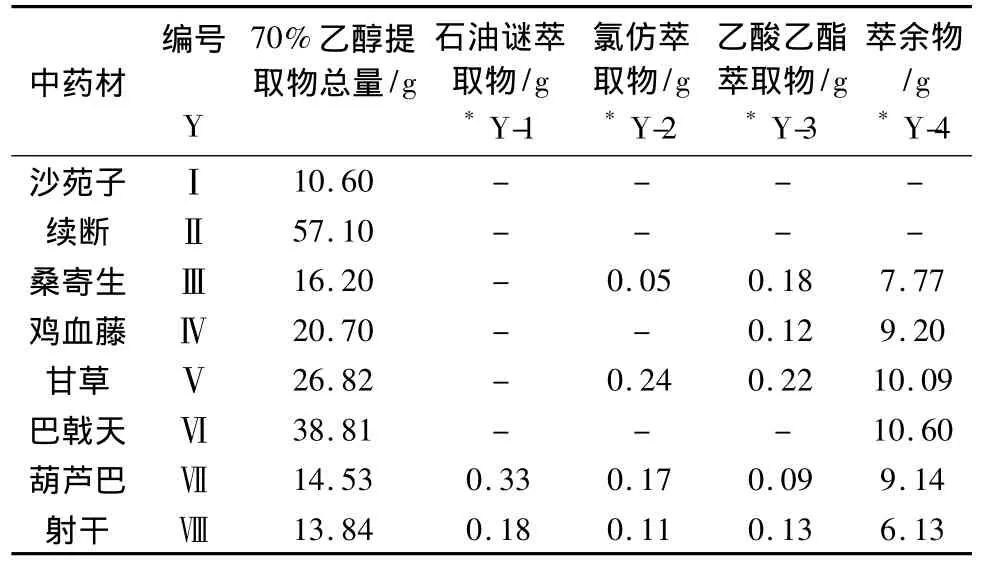
表1 8种中药的提取结果
1.2.3 药物对MC3T3-E1细胞增殖的影响 取对数生长期生长状态良好的MC3T3-E1细胞,消化后,用含10%胎牛血清的DMEM培养基配成活细胞浓度为2×104个/mL,接种于96孔培养板中,0.1 mL/孔,培养24 h,细胞完全贴壁后,分为对照组只加等体积的溶剂;实验组加入浓度分别为250、25、2.5 μg/mL 的药物;阳性药物组加入浓度为 10-7mol/L的雌酚酮;另设一空白组不加细胞只加培养基;每组设8个复孔。
继续培养96 h后每孔加MTT(5 mg/mL)20 μL,37℃、5%CO2培养箱中孵育4 h后倒掉培养基,将板晾干,每孔加入150 μL二甲基亚砜(DMSO),在摇板机上震荡20 min,用酶标仪,于490 nm处测定各孔光密度值(OD)。
1.2.4 药物对MC3T3-E1细胞内ALP活性的影响 调整细胞浓度为4×104个/mL,各取0.1 mL接种于96孔培养板,置37℃,5%CO2温箱中培养。待24 h细胞完全贴壁后,按上述空白对照组、对照组、雌酚酮阳性对照组和药物组的浓度加入相应的药物。每个浓度设8个复孔。加药72 h后,将细胞用PBS缓冲液冲洗3次,最后一次吸干PBS,每孔加入工作液150 μL(50 mmol/L 的 DEA 100 μL,2.5 mmol/L 的PNPP 50 μL),37℃恒温箱反应 30 min,取出。加入 0.1 mol/L NaOH 100 μL终止反应。每孔取150 μL加入96孔酶标板中,用酶标仪于405 nm处测量各孔光密度值(OD)。
1.2.5 药物对MC3T3-E1细胞外ALP活性的测定 同上法将细胞进行铺板和分组,加药72 h后,取培养液20 μL于96孔酶标板,加底物反应液(PNPP-DEA溶液:MgCl2·6H2O 101.7 mg,12 mol/L HCl 1.95 mL,DEA 10 mL 加蒸馏水至50 mL,临用前与3 mmol/L PNPP等量配制),37℃水浴中反应10 min,加0.1 mol/L NaOH 90μL终止反应,于405 nm处测量各孔光密度。用(90 μL反应液 +90 μL终止液 +20 μL培养液)调零。
2 结果
2.1 8种中药总提取物和不同溶剂萃取结果
每种药材的用量均为100 g,提取结果见表1。
2.2 药物对MC3T3-E1细胞增殖的影响
细胞经药材提取物处理72 h后,结果与对照组比较,具有不同的增值作用。桑寄生(Ⅲ)的氯仿萃取物、乙酸乙酯萃取物和萃取残余物、鸡血藤(Ⅳ)的乙酸乙酯萃取物和萃余物、巴戟天(Ⅵ)萃余物、葫芦巴(Ⅶ)的萃余物及射干(Ⅷ)的石油醚萃取物、乙酸乙酯萃取物在不同浓度时对MC3T3-E1细胞具有增殖作用(P﹤0.05),以上各部分对细胞增殖作用的强度均强于阳性对照雌酚酮,其中葫芦巴萃余物、射干石油醚萃取物的作用强度高于雌酚酮的3~4倍,见表2。
2.3 药物对MC3T3-E1细胞内外ALP活性的影响
经PNPP法检测,雌酚酮对细胞内ALP活性与对照组相比有显著性差异(P<0.05);细胞内ALP活性增加与对照组相比有显著性差异(P<0.01)的有:桑寄生萃余物(Ⅲ-4)的中高浓度组、鸡血藤乙酸乙酯萃取物(Ⅳ-3)和萃余物(Ⅳ-4)的低浓度组、巴戟天萃余物(Ⅵ-4)的中浓度组;与雌酚酮组相比,桑寄生(Ⅲ-3)、鸡血藤(Ⅳ-3、Ⅳ-4)的乙酸乙酯萃取物和萃余物部分对细胞内ALP活性相当或高于雌酚酮,其它药材对细胞内ALP活性的影响低于雌酚酮组见表2。
经PNPP法检测,雌酚酮对细胞外ALP活性与对照组相比有显著性差异(P<0.01),细胞外ALP活性增加与对照组相比有显著性差异(P<0.01),其有桑寄生的萃取物(Ⅲ-4)高浓度组、鸡血藤萃余物(Ⅳ-4)的高和中浓度组、巴戟天萃余物(Ⅵ-4)低浓度组、葫芦巴氯仿萃取物(Ⅶ-2)的高中低浓度组。与雌酚酮组相比,桑寄生的萃取物(Ⅲ-4)、鸡血藤乙酸乙酯萃取物(Ⅳ-3)和萃余物(Ⅳ-4)、葫芦巴石油醚(Ⅶ-1)、氯仿(Ⅶ-2)和乙酸乙酯萃取物(Ⅶ-3)和射干的萃余物(Ⅷ-4)均相当于或高于雌酚酮组,见表2。
3 讨论
MC3T3-E1细胞株是1981年日本学者Kadama等由新生C57BL/6小鼠颅顶骨中分离培养所建立的一株成骨细胞株,该细胞株具备体外培养成骨细胞的各种生物学特性,包括碱性磷酸酶活性、Ⅰ型胶原合成和基质矿化等,是一株良好的体外培养成骨细胞株,国际上常作为骨代谢研究的细胞模型[2]。其增殖在某种程度上可反映成骨细胞的增殖,而成骨细胞是骨代谢过程中的重要细胞,其增殖有利于骨形成。
碱性磷酸酶(ALP)是一种同源二聚体的糖蛋白,是成骨细胞分化成熟和功能的标志,是识别及评价成骨细胞分化程度的生化指标。ALP是成骨细胞分化的一个早期指标,其表达随着细胞分化的发展而增强[3],是骨形成所必须的酶,其活性反映了成骨细胞的活性,其活性高低也能代表成骨细胞功能强弱。ALP可分解有机磷酸释放无机磷,增加局部无机磷酸的浓度,促进矿化,所以ALP活性升高可为细胞间质改变做好准备,并且是启动矿化的必备条件。
本实验通过对8味中药对MC3T3-E1细胞的增殖作用及细胞内外ALP活性作用判断药物对骨形成、骨细胞分化成熟的影响,从而为药物的进一步开发打下基础。
实验结果表明中药桑寄生(Ⅲ)、鸡血藤(Ⅳ)、巴戟天(Ⅵ)、葫芦巴(Ⅶ)、射干(Ⅷ)不同萃取物对MC3T3-E1细胞增殖和细胞内外ALP活性有促进作用,提示这些中药具有促进成骨细胞增殖和分化的作用。
表2 药物对MC3T3-E1细胞增殖、细胞内外ALP活性的影响结果(±s,n=8)

表2 药物对MC3T3-E1细胞增殖、细胞内外ALP活性的影响结果(±s,n=8)
注:与对照组相比,*P<0.05,与对照组相比,**P<0.01。
药物 药物浓度/(μg/mL)细胞增殖OD值 增殖率/%细胞内ALP OD值细胞外ALP OD 值对照00.376±0.012 0.104±0.031 0.183±0.001雌酚酮 1×10-7mol/L 0.418±0.016 11.17 0.236±0.029* 0.205±0.002*Ⅲ-2 2.5×10-2 0.490±0.049* 30.32# 0.112±0.009 0.188±0.011 2.5×10-1 0.442±0.036 17.55 0.239±0.023* 0.189±0.010 2.5 0.432±0.046 14.90 0.246±0.022* 0.210±0.010*Ⅲ-3 2.5×10-2 0.493±0.018* 31.11# 0.298±0.018** 0.210±0.020*2.5×10-1 0.489±0.021* 30.05# 0.284±0.016* 0.193±0.020 2.5 0.568±0.019* 51.06# 0.278±0.028* 0.198±0.003Ⅲ-4 2.5×10-2 0.469±0.041* 24.73 0.272±0.002* 0.243±0.021*2.5×10-1 0.487±0.013* 29.52 0.320±0.003** 0.241±0.018*2.5 0.499±0.001* 32.71# 0.320±0.004** 0.252±0.032**Ⅳ-3 2.5×10-2 0.490±0.028* 30.32 0.324±0.004** 0.203±0.021 2.5×10-1 0.515±0.032* 36.97# 0.255±0.032* 0.228±0.018*2.5 0.438±0.017 16.45 0.242±0.022* 0.218±0.022*Ⅳ-4 2.5×10-2 0.499±0.006* 32.71# 0.282±0.031* 0.245±0.003**2.5×10-1 0.487±0.002* 29.52 0.295±0.031** 0.243±0.002**2.5 0.452±0.001 20.21 0.287±0.030* 0.243±0.009**Ⅵ-4 2.5×10-2 0.431±0.009 14.63 0.207±0.005* 0.248±0.011**2.5×10-1 0.442±0.031 17.55 0.238±0.004* 0.236±0.011*2.5 0.463±0.022 23.12 0.231±0.002* 0.235±0.012*Ⅶ-1 2.5×10-2 0.463±0.056 23.13 0.237±0.002* 0.188±0.012 2.5×10-1 0.385±0.023 2.39 0.212±0.012* 0.233±0.001*2.5 0.380±0.009 1.06 0.203±0.002* 0.227±0.002*Ⅶ-2 2.5×10-2 0.383±0.016 1.78 0.223±0.010* 0.240±0.002**2.5×10-1 0.381±0.076 1.33 0.220±0.010* 0.241±0.001**2.5 0.406±0.008 7.98 0.218±0.010* 0.242±0.003**Ⅶ-3 2.5×10-2 0.388±0.056 3.11 0.162±0.034* 0.218±0.003 2.5×10-1 0.370±0.032 -1.67 0.153±0.030* 0.226±0.012*2.5 0.414±0.061 10.11 0.157±0.032* 0.228±0.005*Ⅶ-4 2.5×10-2 0.620±0.032* 64.89# 0.097±0.004 0.163±0.012 2.5×10-1 0.477±0.006* 26.86 0.160±0.020* 0.163±0.020 2.5 0.531±0.056* 41.22# 0.178±0.012* 0.168±0.020Ⅷ-1 2.5×10-2 0.560±0.007* 48.94# 0.194±0.010* 0.178±0.010 2.5×10-1 0.587±0.032* 56.12# 0.188±0.018* 0.155±0.010 2.5 0.652±0.012* 73.40# 0.172±0.016* 0.172±0.002Ⅷ-2 2.5×10-2 0.406±0.022 7.97 0.204±0.007* 0.215±0.011*2.5×10-1 0.395±0.022 4.97 0.224±0.014* 0.207±0.009*2.5 0.438±0.016 16.50 0.215±0.013* 0.214±0.005*Ⅷ-3 2.5×10-2 0.564±0.001* 50.00# 0.214±0.024* 0.180±0.008 2.5×10-1 0.440±0.002 17.02 0.149±0.028* 0.199±0.021 2.5 0.402±0.004 6.91 0.194±0.008* 0.201±0.002Ⅷ-4 2.5×10-2 0.435±0.023 15.69 0.192±0.014* 0.217±0.002*2.5×10-1 0.391±0.026 3.91 0.192±0.011* 0.217±0.004*2.5 0.431±0.008 14.62 0.185±0.09* 0.214±0.003*
本实验结果初步证明:中药桑寄生、鸡血藤、巴戟天、葫芦巴、射干的不同提取物使MC3T3-E1细胞内外的ALP的活性增强,强度与雌酚酮相当,推测可能具有雌激素样促进成骨样细胞合成和分泌ALP的作用,将上述药材的提取物分离纯化及对MC3T3-E1细胞的作用活性尚在进一步研究中。
[1]唐 琪,陈莉丽,严 杰.骨碎补提取物促小鼠成骨细胞株MC3T3-E1细胞增殖、分化和钙化作用的研究[J].中国中药杂志,2004,29(2):164-168.
[2]王洪复主编.骨细胞图谱与骨细胞体外培养技术[M].上海:上海科学技术出版社,2001:63-64.
[3]Enmark E,Pelto-Huikko M,Grandien K,et al.Human estrogen receptor β-gene structure,chromosomal localization,and expression pattern[J].J Clin Endocrinol Metab,1997,82:4258-4265.
