65%~75%最大强度的耐力运动对老龄小鼠骨骼肌线粒体氧化应激与膜电位的影响
2010-09-06漆正堂丁树哲
漆正堂,贺 杰,张 媛,丁树哲
65%~75%最大强度的耐力运动对老龄小鼠骨骼肌线粒体氧化应激与膜电位的影响
漆正堂,贺 杰,张 媛,丁树哲
目的:探讨线粒体氧化应激与增龄性骨骼肌流失之间的关系,进一步揭示耐力运动对增龄性骨骼肌流失的影响机制。方法:选用40只ICR小鼠建立2、4、6、8月龄增龄性骨骼肌流失模型;另选用40只ICR小鼠分为4组:青年对照组(YC)、青年运动组(YR)、老龄对照组(AC)和老龄运动组(AR);每组10只。对不同月龄小鼠采用递增负荷进行运动能力测试,YR、AR组小鼠按最大负荷的65%~75%进行耐力训练,每天训练1 h,持续4周。取腓肠肌、股四头肌称重,荧光探针法检测腓肠肌线粒体活性氧(ROS)产率与膜电位,ELISA法检测腓肠肌8-羟基-脱氧鸟苷(8-OH-dG)含量。结果:1)4月龄组腓肠肌、左右股四头肌湿重显著高于2、6、8月龄组(P<0.05);但耐力运动对AR、YR组小鼠骨骼肌湿重均无显著影响。2)8月龄组线粒体ROS产率显著高于2、4、6月龄组(P<0.01),6、8月龄组8-OH-dG含量显著高于2月龄、4月龄组(P<0.05)。AR组8-OH-dG含量显著高于AC组(P< 0.05)。3)与2月龄组比较,4、6、8月龄组线粒体膜电位显著下降(P<0.01);与4、6月龄组比较,8月龄组线粒体膜电位进一步显著下降(P<0.01)。AR组线粒体膜电位显著高于AC组(P<0.05)。结论:在增龄性骨骼肌流失的不同时期,先后出现线粒体膜电位下降、DNA氧化损伤加剧、ROS产率增加。65%~75%最大强度的耐力运动提高了老龄小鼠骨骼肌的线粒体膜电位,表明耐力运动对老龄小鼠维持线粒体功能、防止肌细胞凋亡有重要意义,但也可能加剧DNA氧化损伤。建议老年人有必要从事耐力运动但不宜采用过高的运动强度。
耐力运动;骨骼肌流失;活性氧;8-羟基-脱氧鸟苷;线粒体膜电位
骨骼肌质量减少的原因很多,肌营养不良、慢性消耗性疾病、神经损伤、肢体固定、肌肉减负、衰老等都能引起不同程度、不同病理进程的骨骼肌萎缩[21,24]。肌肉练习或运动只能预防或恢复某些原因引起的骨骼肌萎缩,神经损伤、肢体固定、肌肉减负引起的肌萎缩可在神经修复、肌肉负载后迅速恢复,具有较好的可复性;而肌营养不良、慢性消耗性疾病引起的肌萎缩运动后可复性较差[17,22]。介于二者之间的,是与衰老、年龄相关的骨骼肌萎缩是否可以通过运动得以延缓或矫正,如何运动才是有效的?学界一直有许多争议。争议的焦点在于骨骼肌衰老性萎缩的有关机制不明。衰老性肌萎缩的发生机制有两种观点:一是,肌肉蛋白质合成下降,分解增加[24],因此,应该通过肌肉力量练习增加蛋白质合成;二是,肌细胞凋亡增加[8],因此,加速细胞凋亡的耐力运动是不可取的。不仅如此,长期耐力运动通常还会减损力量练习辛苦积累起来的肌肉质量[2,19]。如何评价耐力运动与骨骼肌流失之间的关系?线粒体生物发生、体量增加是耐力运动最显著的效应之一[13],线粒体也是细胞凋亡的调控中心,大多数细胞凋亡是由线粒体介导的,线粒体氧化应激、DNA损伤、膜电位都与细胞凋亡密切相关[16]。本研究拟纵向观察衰老对骨骼肌质量与线粒体氧化应激的影响,分析骨骼肌丢失与线粒体氧化应激的关系;另一方面,本研究拟横向观察4周中等强度耐力运动对老龄小鼠骨骼肌线粒体氧化应激与膜电位的影响,分析耐力运动对增龄性骨骼肌丢失的影响机制,为运动延缓骨骼肌衰老提供实验依据。
1 材料与方法
1.1 实验动物分组及饲养
1月龄、6月龄清洁级ICR雄性小鼠购自上海斯莱克实验动物有限公司,1月龄体重18.0±1.1 g,6月龄体重43.2±2.7 g。实验动物生产许可证号:SCXK(沪)2007-0005。实验动物使用许可证号:SYXK(沪)2004-0001。国家标准啮齿类动物饲料(M01)及垫料(D01-F)由上海斯莱克实验动物有限公司提供,分笼饲养,自由饮食,每周更换垫料2~3次,环境温度20℃~23℃,相对湿度50%~70%,自然光照。每周称重1次。1月龄(20只)、6月龄(20只)小鼠在饲养不同时间后宰杀,建立增龄模型;另取1月龄(20只)、6月龄(20只)小鼠各均分为运动组和对照组,建立运动模型。本实验中,增龄模型的2月龄组与运动模型的青年对照组实为同一组小鼠(表1)。

表1 本研究ICR小鼠分组方案一览表Table 1 Animal Models of ICR Mice in Each G roup
1.2 运动方案
正式运动前,对不同月龄小鼠采用递增负荷进行运动能力测试,具体方法如下:跑台起始速度0.8 km/h,每分钟增加0.1 km/h,直至小鼠力竭。测试结果表明,1月龄、6月龄小鼠能承受的最大速度平均值分别为2.5 km/h和2.0 km/h,按最大负荷的65%~75%确定正式运动的负荷范围,1月龄、6月龄小鼠运动负荷范围分别是1.6~1.9 km/h和1.3~1.5 km/h[25]。YR、AR组小鼠按确定的运动负荷进行耐力训练,每天训练1 h,持续4周。
1.3 骨骼肌取材与线粒体纯化
最后一次训练后18 h,所有小鼠安静状态下断颈处死,迅速分离左右下肢腓肠肌、股四头肌,用生理盐水洗净,称重。右侧腓肠肌加入预冷的匀浆介质(0.075 M蔗糖、0.225 M山梨醇、1 mM EGTA、0.1%BSA,10 mM Tris-HCl,pH 7.4),剪碎后匀浆,采用差速离心法纯化线粒体,反复洗涤线粒体沉淀,纯化后重悬于匀浆介质[9]。
1.4 线粒体ROS与膜电位检测
采用DCFH-DA荧光探针检测线粒体的ROS水平。取100μl线粒体悬液加入0.2 ml PBS(0.1 M,pH 7.4)和5μl DCFH-DA(1 mM),总体积约0.3 ml。37℃孵育15 min,使探针充分进入线粒体;用荧光酶标仪在激发波长499 nm、发射波长521 nm下检测DCF生成,37℃检测2 min。空白对照管加入300μl PBS和5μl DCFH-DA,用于检测DCFH-DA自发荧光。蛋白定量采用考马斯亮蓝法,计算DCF的生成速率(pmol/min·mg)。
采用JC-1荧光探针检测线粒体膜电位。取适量JC-1 (200X)按照每50μl加入8 ml超纯水的比例稀释JC-1,充分溶解并混匀JC-1,然后再加入2 ml JC-1染色缓冲液(5X),混匀后即为JC-1染色工作液。取180μl JC-1染色工作液中加入20μl纯化的线粒体。混匀后直接用荧光酶标仪进行时间扫描(time scan),激发波长为485 nm,发射波长为590 nm。蛋白定量采用考马斯亮蓝法。
1.5 8-OH-dG检测
采用8-羟基-脱氧鸟苷(8-OH-dG)ELISA试剂盒(R&D公司)检测DNA氧化损伤。详细操作步骤按说明书进行,蛋白定量采用考马斯亮蓝法。
1.6 数据处理
各检测结果以M±SE表示,3组以上的多重比较用SPSS 15.0软件进行方差分析,两组之间的比较进行独立样本t检验。以P<0.05为差异显著性标准,以P<0.01为差异非常显著性标准。
2 结果
2.1 体重与骨骼肌湿重
表2显示,4月龄组小鼠体重显著高于2月龄组(P< 0.01),但显著低于8月龄组(P<0.01);4月龄组小鼠腓肠肌、左右股四头肌湿重显著高于2、6、8月龄组(P<0.05)。表3显示,YR组小鼠体重显著低于YC组(P<0.05),但耐力运动对老龄、青年小鼠骨骼肌湿重均无显著影响。

表2 本研究ICR小鼠骨骼肌湿重的增龄性变一览表Table 2 Changes in Muscle Wet Weight of ICR Mice during Ageing (n=10)
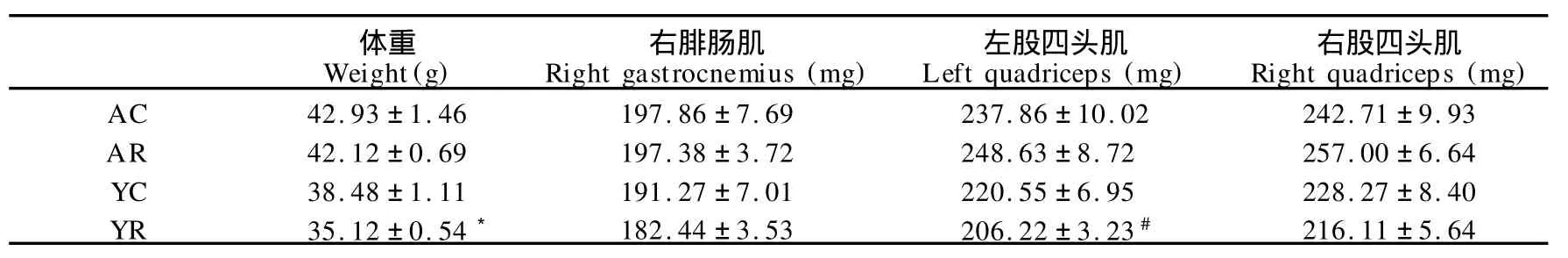
表3 本研究运动对ICR小鼠骨骼肌湿重的影响一览表T able 3 Effects of Endurance Training on Muscle Wet Weight of ICR Mice (n=8)
2.2 线粒体活性氧(ROS)产率与DNA氧化损伤
表4显示,8月龄组小鼠线粒体ROS产率显著高于2、4、6月龄组(P<0.01),6、8月龄组小鼠8-OH-dG含量显著高于2月龄、4月龄组(P<0.05)。表5显示,在YC与YR、AC与AR组之间,线粒体ROS产率无显著性差异, AR组小鼠8-OH-dG含量显著高于AC组(P<0.05),但YC组与YR组之间无显著性差异。

表4 本研究不同月龄ICR小鼠骨骼肌线粒体ROS产率与DNA氧化损伤一览表Table 4 Mitochondrial ROS Production and DNA Oxidative Damage in Skeletal Muscle of ICR Mice during Ageing(n=8)
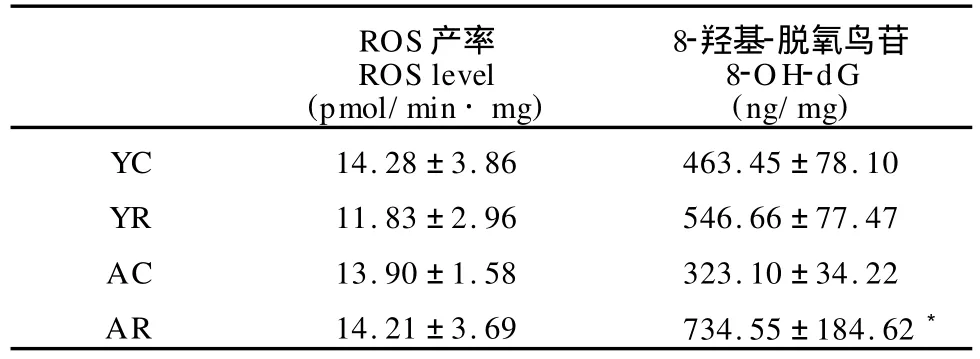
表5 本研究运动对骨骼肌线粒体ROS产率与DNA氧化损伤的影响一览表Table 5 Effects of Endurance Training on Mitochondrial ROS Production and DNA Oxidative Damage in Skeletal Muscle of ICR Mice(n=8)
2.3 线粒体膜电位(ΔΨ)
表6显示,与2月龄组小鼠比较,4、6、8月龄组线粒体膜电位显著下降(P<0.01);与4、6月龄小鼠比较,8月龄组线粒体膜电位进一步显著下降(P<0.01)。与AC组比较,AR组线粒体膜电位显著升高(P<0.05),YC与YR组之间无显著性差异。
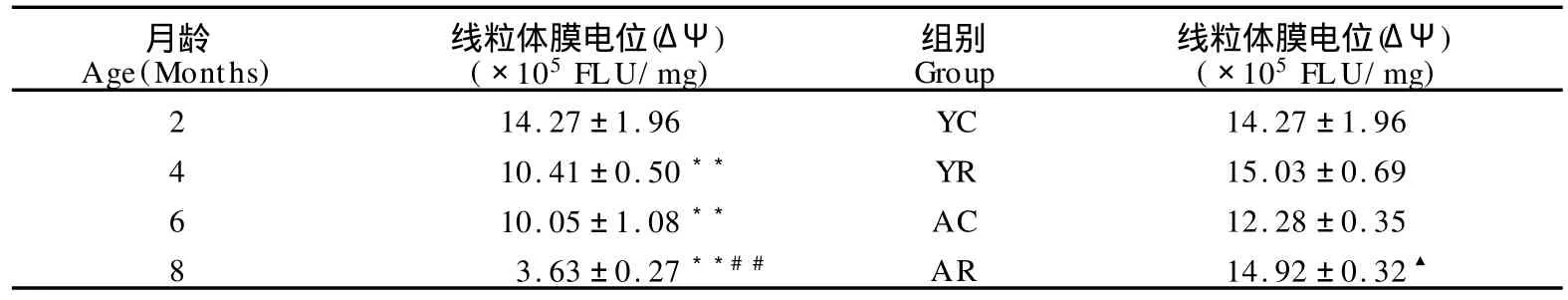
表6 本研究各组小鼠骨骼肌线粒体膜电位比较一览表Table 6 Mitochondrial Membrane Potential(ΔΨ)of Skeletal Muscle in Each G roup (n=8)
3 讨论
本实验结果显示,小鼠体重、腓肠肌、股四头肌湿重在2~4月龄快速增长,4月龄以后骨骼肌湿重呈下降趋势,但体重继续增长。不难推断,骨骼肌相对湿重(骨骼肌湿重/体重)在4月龄以后会急剧下降。从中不难发现ICR小鼠的生长规律,4月龄是ICR小鼠生长的巅峰时期,肌肉流失在6~8月龄已非常显著,本实验较好地模拟了增龄性骨骼肌流失。本实验也发现,耐力运动对老龄、青年小鼠骨骼肌湿重均无显著影响,但对青年小鼠的体重增长有显著抑制作用。表明耐力运动对骨骼肌质量并无显著减损,甚至对青年小鼠的骨骼肌质量还有相对增加的作用。
骨骼肌流失、细胞凋亡的诸多机制都与线粒体ROS产率、膜电位崩溃、DNA氧化损伤增加有关。线粒体ROS是线粒体在有氧呼吸过程中,电子传递“落单”时产生的超氧自由基及其衍生物。在衰老、敲除CuZn-SOD基因、脊髓侧索硬化症(ALS)引起的肌萎缩模型中,线粒体ROS产率都急剧增加;线粒体ROS产率与肌萎缩程度呈高度正相关[15,23]。Muller FL(2007)研究发现,去神经支配后7天骨骼肌线粒体ROS产率增加30倍,表明线粒体ROS产率增加是神经损伤性肌萎缩的发生机制之一[18]。本实验也发现类似规律,在8月龄骨骼肌流失模型中,线粒体ROS产率相对4月龄增加了近200%,相对2月龄增加了100%;但在6月龄肌萎缩模型中未见有线粒体ROS产率显著增加。线粒体ROS产率与运动时相有密切关系,运动能迅速激活ROS产率增加,并随运动时间持续而加速,运动后恢复期逐渐下降[3]。耐力运动诱导骨骼肌细胞凋亡与ROS产率增加有关[7]。运动性ROS与静息状态下线粒体ROS不仅产率差异巨大,而且生理效应也迥然不同。静息状态下线粒体ROS水平一般较低,对线粒体及基因组损伤较小;静息状态下线粒体ROS产率增加,意味着氧化应激加剧,基因损伤加重,这对于细胞存活极为不利[6]。运动性ROS产生能诱导细胞凋亡,但运动造成的一过性ROS增加也能刺激线粒体生物发生[14]。适度的ROS刺激对线粒体生物发生是十分必要的。有报道显示,过度补充抗氧化剂维生素C能抑制骨骼肌线粒体生物发生[11],但不能抑制运动诱导的线粒体生物发生[28]。原因可能是运动导致了ROS产率一过性增加,这对启动线粒体生物发生至关重要。本实验发现,在6~8月龄期间,线粒体ROS产率有显著激增,骨骼肌流失现象却在6月龄已显现,表明线粒体ROS产率增加有滞后性,线粒体ROS产率与骨骼肌流失之间的因果关系值得推敲。本实验中,耐力运动并没有影响小鼠骨骼肌静息状态下的线粒体ROS产率,也没有影响骨骼肌质量。耐力运动可一过性增加线粒体ROS产率甚至氧化损伤,但不会影响静息状态下线粒体ROS产率,这对于减少骨骼肌静息态氧化损伤、维持骨骼肌质量才是重要的,对骨骼肌线粒体生物发生也是必要的。因此,为防止骨骼肌流失,限制老年人从事耐力运动是没有必要的。
8-OH-dG是ROS氧化损伤细胞核DNA或线粒体DNA后形成的产物。8-OH-dG在体内稳定存在,一旦形成不再被进一步代谢。由于8-OH-dG不能由细胞内外的dG通过非DNA氧化途径形成,因此,机体内8-OH-dG含量可以较好地反映体内DNA氧化损伤[12]。研究早已发现,随着年龄增长,细胞核DNA、线粒体DNA、骨骼肌中8-OH-dG含量呈渐进性增高,而线粒体DNA中8-OH-dG增高的比例更为显著[20]。表明线粒体DNA氧化损伤随年龄增长更突出。本实验结果显示,6月龄、8月龄组小鼠骨骼肌8-OH-dG含量超出4月龄组2.5倍,约是2月龄组的1.8倍。表明骨骼肌随年龄增长DNA氧化损伤加剧,这与8月龄组线粒体ROS产率增加可能紧密相关。6月龄组与4月龄组比较,未见线粒体ROS产率增加,但DNA氧化损伤已凸显,反映出骨骼肌DNA抗氧化能力随衰老而下降。运动实验结果显示,耐力运动对青年小鼠8-OH-dG含量影响不显著,但显著增加了老龄小鼠8-OH-dG含量。运动产生的ROS对骨骼肌DNA也有氧化损伤[1],AR组8-OH-dG含量增高表明,老龄小鼠对运动性氧化损伤的抵抗能力不如青年小鼠。研究结果暗示,65%~75%最大强度耐力运动对老龄小鼠骨骼肌DNA的氧化损伤还是非常显著的,这可能提示老年人从事耐力运动不适宜采用过高强度。
线粒体膜电位是线粒体膜内外离子梯度形成的电位差,膜电位是线粒体进行氧化磷酸化和质子跨膜转运、合成ATP的基础条件,反映线粒体的功能状况。线粒体膜电位下降是细胞凋亡的前兆[27]。在心肌衰老模型中,可观察到线粒体膜受损、膜电位降低,还可观察到ATP合成降低、质子漏增加、ROS产率增加、呼吸链抑制等一系列伴随性线粒体功能下降[10,26]。本实验结果显示,随着年龄增长,ICR小鼠骨骼肌线粒体膜电位递减,2月龄最高,其次是4~6月龄,8月龄最低,反映出骨骼肌细胞凋亡随年龄增长可能不断增加,从而诱发骨骼肌流失。本实验也显示,耐力运动对青年小鼠线粒体膜电位没有显著影响,但显著提高了老龄小鼠线粒体膜电位。这对维持老龄小鼠骨骼肌线粒体功能、防止细胞凋亡是比较有利的适应。从骨骼肌湿重的绝对值看,尽管本实验没有观察到耐力运动增加骨骼肌质量,但耐力运动对线粒体膜电位的提高,对维持骨骼肌功能和正常能量代谢显然是有利的。也有一种相反的观点认为,由于蛋白质合成能耗较高,对老年人来说是一种负担,过多的肌肉蛋白质合成或周转(turnover)将与其他重要器官争夺能源。因此,从力量练习中获得的肌肉质量往往在肌肉减负后会迅速流失,以减少不必要的能耗;从这一意义来看,增龄性骨骼肌流失是维持机体能量供需平衡的一种必要。衰老,包括增龄性骨骼肌流失,是生命不可抗拒的发展趋势,运动不可能阻止衰老和骨骼肌流失。对老年人而言,骨骼肌体积和质量的流失不可避免,甚至是必要的,老年人从事耐力运动的目的应在于维持线粒体功能以及骨骼肌的基本活动能力,而不是增加一些不必要的高能耗器官。
综合很多研究都发现,反映线粒体功能的ROS产率、膜电位、ATP合成、钙转运、DNA氧化损伤之间存在千丝万缕的牵制关系[4,5],很难说清各功能指标之间的因果关系,这反映线粒体在各功能方向须是协调统一的。但本研究仅在8月龄组小鼠中发现骨骼肌流失、线粒体ROS产率增加、膜电位降低、DNA氧化损伤加剧同步出现,其他月龄组并不表现出同步性,4月龄组小鼠最先出现了膜电位下降,6月龄组出现了骨骼肌流失和DNA氧化损伤加剧, 8月龄组才出现ROS产率增加。这些不匹配现象说明骨骼肌衰老是一个渐进性过程,许多指标不一定能灵敏地反映衰老的进程,线粒体膜电位在骨骼肌质量顶峰时期最早出现下降。本研究推测,线粒体膜电位或许可以作为骨骼肌衰老的预警指标,评价运动效果也可用线粒体膜电位变化作为科学依据。levels in rat organs[J].Biochem Biophys Res Commun,1998, 243(3):678-682.
4 小结
在增龄性骨骼肌流失的不同时期,先后出现线粒体膜电位下降、DNA氧化损伤加剧、ROS产率增加。65%~75%最大强度的耐力运动提高了老龄小鼠骨骼肌的线粒体膜电位,表明耐力运动对老龄小鼠维持线粒体功能、防止肌细胞凋亡有重要意义,但也可能加剧DNA氧化损伤。建议老年人有必要从事耐力运动,但不宜采用过高的运动强度。
[1]ASAMI S,HIRANO T,YAMAGUCHI R,et al.Effects of forced and spontaneous exercise on 8-hydroxydeoxyguanosine
[2]BAAR K.Training for endurance and strength:Lessons from cell signaling[J].Med Sci Sport Exe,2006,38(11):1939-1944.
[3]BO H,JIANG N,MA GD,et al.Regulation of mitochondrial uncoupling respiration during exercise in rat heart:Role of reactive oxygen species(ROS)and uncoupling protein 2[J].Free Radic Biol Med,2008,44(7):1373-1381.
[4]BRINKKOETTER PT,SONG H,LOSEL R,et al.Hypothermic injury:the mitochondrial calcium,ATP and ROS love-hate triangle out of balance[J].Cell Physiol Biochem,2008,22(1-4): 195-204.
[5]BROOKES PS,YOON YS,ROBOTHAM JL,et al.Calcium, ATP,and ROS:a mitochondrial love-hate triangle[J].Am J Physiol Cell Physiol,2004,287(4):C817-C833.
[6]CHAUDHARI M,JAYARAJ R,BHASKAR ASB,et al.Oxidative stress induction by T-2 toxin causes DNA damage and triggers apoptosis via caspase pathway in human cervical cancer cells [J].Toxicology,2009,262(2):153-161.
[7]CIALOWICZ EM,JANUSZEWSKA L,PODHORSKAOKOLOW M,et al.Oxidative stress-induced apoptosis in rat skeletal muscle during a single running exercise up to exhaustion[J]. Bull Vet Inst Pulawy,2009,53(4):713-717.
[8]DIRKS AJ,LEEUWENBURGH C.The role of apoptosis in agerelated skeletal muscle atrophy[J].Sports Med,2005,35(6): 473-483.
[9]FERNANDEZ-VIZARRA E,FERRIN G,PEREZ-MARTOS A, et al.Isolation of mitochondria for biogenetical studies:An update[J].Mitochondrion,2010,10(3):253-262.
[10]GAO D Q,MADAR I,CAI Z Q,et al.Mitochondrial oxidative DNA damage/DNA repair system and mitochondrial membrane potential in aging heart[J].Circulation,2005,112(17):283.
[11]GOMEZ-CABRERA MC,DOMENECH E,ROMAGNOLI M, et al.Oral administration of vitamin C decreases muscle mitochondrial biogenesis and hampers training-induced adaptations in endurance performance[J].Am J Clin Nutr,2008,87(1): 142-149.
[12]HASHIMOTO K,TAKASAKI W,SATO I,et al.DNA damage measured by comet assay and 8-OH-dGformation related to blood chemical analyses in aged rats[J].J Toxicol Sci,2007,32 (3):249-259.
[13]IRRCHER I,ADHIHETTY P J,JOSEPH A M,et al.Regulation of mitochondrial biogenesis in muscle by endurance exercise[J].Sports Med,2003,33(11):783-793.
[14]KANGC H,DICKMAN J R,AWOYINKA L,et al.ROS play a role in regulating exercise-induced mitochondrial biogenic pathway[J].Faseb J,2007,21(6):A815-A815.
[15]LI M,HOU G,HUANG D-N,et al.Muscle atrophy and oxidative stress[J].Chinese J Biochemistry Molecular Biol,2009,25 (5):415-420.
[16]MARZETTI E,HWANGJCY,LEES H A,et al.Mitochondrial death effectors:Relevance to sarcopenia and disuse muscle atrophy[J].Biochim Biophys Acta,2010,1800(3):235-244.
[17]MOURTZAKIS M,BEDBROOK M.Muscle atrophy in cancer: a role for nutrition and exercise[J].Appl Physiol Nutr Metab, 2009,34(5):950-956.
[18]MULLER F L,SONG W,JANG Y C,et al.Denervation-induced skeletal muscle atrophy is associated with increased mitochondrial ROS production[J].AmJ Physiol Regul Integr Comp Physiol,2007,293(3):R1159-R1168.
[19]NADER G A.Concurrent strength and endurance training: From molecules to man[J].Med Sci Sport Exe,2006,38(11): 1965-1970.
[20]NAKAE D,AKAI H,KISHIDA H,et al.Age and organ dependentspontaneous generation ofnuclear 8-hydroxydeoxyguanosine in male Fischer 344 rats[J].Lab Invest,2000,80 (2):249-261.
[21]OP DEN KAMP CM,LANGEN RC,HAEGENS A,et al.Muscle atrophy in cachexia:can dietary protein tip the balance[J]. Curr Opin Clin Nutr Metab Care,2009,12(6):611-616.
[22]PHILLIPS SM.Physiologic and molecular bases of muscle hypertrophy and atrophy:impact of resistance exercise on human skeletal muscle(protein and exercise dose effects)[J].Appl Physiol Nutr Metab,2009,34(3):403-410.
[23]POWERS S K,KAVAZIS A N,MCCLUNG J M.Oxidative stress and disuse muscle atrophy[J].J Appl Physiol,2007,102 (6):2389-2397.
[24]RENNIE M J,SELBY A,ATHERTON P,et al.Facts,noise and wishful thinking:muscle protein turnover in aging and human disuse atrophy[J].Scand J Med Sci Sports,2010,20(1):5-9.
[25]REZNICK R M,ZONG H H,LI J,et al.Aging-associated reductions in AMP-activated protein kinase activity and mitochondrial biogenesis[J].Cell Metab,2007,5(2):151-156.
[26]SAVITHA S,PANNEERSELVAM C.Mitochondrial membrane damage during aging process in rat heart:Potential efficacy of L-carnitine and DL alpha lipoic acid[J].Mech Ageing Dev,2006,127(4):349-355.
[27]SCARLETT J L,SHEARD P W,HUGHES G,et al.Changes in mitochondrial membrane potential during staurosporine-induced apoptosis in Jurkat cells[J].FEBS Lett,2000,475(3): 267-272.
[28]WADLEY GD,MCCONELL G K.High-dose antioxidant vitamin C supplementation does not prevent acute exercise-induced increases in markers of skeletal muscle mitochondrial biogenesis in rats[J].J Appl Physiol,2010,108(6):1719-1726.
Effects of Endurance Training on Mitochondrial Oxidative Stress and Membrane Potential in Ageing Skeletal Muscle with 65%~75%Maximum Running Capacity
QI Zheng-tang,HE Jie,ZHAN G Yuan,DING Shu-zhe
Purpose:To investigate the relationship between mitochondrial oxidative stress and skeletal muscle loss,and the effects of ageing and endurance training on muscle atrophy.Methods:2,4,6 or 8 month old ICR mice were established an experimental model of ageing-induced muscle loss,another 40 ICR mice(1 or 6 month old)were distributed into four groups: young and sedentary(YC,n=10),young and trained(YR,n=10),old and sedentary(AC,n =10)or old and trained(AR,n=10).Running test was firstly used to determine the maximum running capacity of young or old mice,exercise training consisted of 60 min of treadmill exercise at 65%~75%maximum running capacity per day,6 days/wk.Gastrocnemius and quadriceps were excised and weighed after 4-week training,fluorescence probe was used to detect mitochondrial ROS production and membrane potential,ELISA was used to detect the content of 8-OH-dG in mice gastrocnemius.Results:1)Gastrocnemius and quadriceps wet weight of 4 month old mice was higher than that of 2,6,8 month old(P<0.05).However,exercise training had no significant effect on muscle wet weight in YR and AR mice.2)Mitochondrial ROS level of 8 month old mice was higher than that of 2,4,6 month old(P<0.01).The content of 8-OH-dG of 6,8 month old mice was higher than that of 2,4 month old(P<0.05). The content of 8-OH-dG of AR mice was increased than AC mice(P<0.05).3)Mitochondrial membrane potential(Δψ)of 4,6,8 month old mice was decreased than 2 month old(P <0.01),theΔψof 8 month old mice was more decreased than 4,6 month old(P<0.01). TheΔψof AR mice was increased than AC mice(P<0.05).Conclusion:During the ageing process and skeletal muscle loss,the decreased membrane potential occurred firstly,DNA oxidative damage was increased secondly,and ROS production was increased finally.Endurance training with 65-75%maximum running capacity increased mitochondrial membrane potentialin ageing skeletal muscle,suggesting that endurance training was likely to maintain mitochondrial function and prevent muscle apoptosis,but induce more DNA damage in skeletal muscle. Our results suggested it is necessary for old people to do endurance exercise,but it is not proper to take a program with high intensity.
endurance training;skeletal muscle loss;ROS;8-O H-dG;mitochondrial membrane potential
G804.2 文献标识码:A
1000-677X(2010)10-0046-06
2010-08-02;
2010-09-23
国家自然科学基金资助项目(30871212);教育部2007年度新世纪优秀人才支持计划(790013P8)。
漆正堂(1979-),男,湖北黄冈人,讲师,博士,研究方向为线粒体运动适应及其信号调控,E-mail:qzht79@163.com。
华东师范大学体育与健康学院,上海200241 East China Normal University,Shanghai 200241,China.
