同位素稀释高分辨质谱法测定鱼组织中6种多环芳烃
2010-09-01陈大舟徐锐锋钟石林邵明武
汤 桦,陈大舟,吴 雪,徐锐锋,钟石林,邵明武,王 覃
(1.中国计量科学研究院,北京 100013;2.北京市理化分析测试中心,北京 100089)
同位素稀释高分辨质谱法测定鱼组织中6种多环芳烃
汤 桦1,陈大舟1,吴 雪1,徐锐锋1,钟石林1,邵明武1,王 覃2
(1.中国计量科学研究院,北京 100013;2.北京市理化分析测试中心,北京 100089)
采用气相色谱-双聚焦高分辨磁式质谱联用仪开发了同位素稀释质谱法(IDMS)测定鱼组织中6种多环芳烃(PAHs)。以二氯甲烷为提取溶剂,将冻干鱼组织样品加入氘代的同位素内标后,在50℃下索氏提取18 h,采用凝胶排阻色谱(GPC)联用,固相萃取(SPE)进行净化,通过条件优化,采用二氯甲烷作为 GPC的流动相,在3.5 mL·min-1流速下,收集14~34 min的流出液,浓缩后用氟罗里硅土SPE小柱净化,V(环己烷)∶V(二氯甲烷)=1∶1的溶液洗脱,以高分辨多离子方法(HRMS-MID)检测,单点校正法定量。6种PAHs在3个添加水平的检测回收率为95%~105%,精密度(RSD)为1.7%~6.0%,最小检出限为0.8~1.6μg·kg-1。
同位素稀释质谱法(IDMS);多环芳烃(PAHs);鱼组织;凝胶排阻色谱(GPC);固相萃取(SPE)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是指由2个或2个以上苯环以线状、角状或簇状排列的化合物(如萘、蒽等),是一类惰性较强的碳氢化合物[1],正是由于这种较强的惰性使它们较稳定的广泛地分布于环境中。PAHs具有致癌、致畸及致突变性[2],致癌性随着苯环数的增加而增加。当 PAHs与—NO、—OH、—NH2等发生作用时,会生成致癌性更强的 PAHs衍生物。目前,大多数国家都将PAHs列为环境监测的重要内容之一。但由于PAHs在环境中存在的浓度很低(痕量、超痕量级),环境样品基体复杂,干扰物多,难以直接测定。海洋是地球水域的集中地,也是地球环境的主要组成部分,PAHs由海洋植物细胞吸收,进入海洋生物食物链,并从低营养级生物转移到高营养级生物,最终在海洋鱼类或海洋哺乳动物等生物体内富集[3]。鱼体中富集的 PAHs反映了所在环境中 PAHs的污染情况[4],是一种重要的环境评价指导性指标[5-7]。目前,国内采用高分辨质谱检测鱼肉基体中PAHs鲜有报道,本研究拟采用气相色谱-高分辨质谱联用,开发鱼组织中6种PAHs同位素稀释质谱检测方法,并探讨和优化前处理和仪器检测过程,为相关的检测工作提供参考。
1 实验部分
1.1 仪器装置与试剂材料
VISIPREPTM DL固相萃取装置:美国Supelco公司产品;Sartorius ME 235S分析天平(最大称量230 g,d=0.01 mg):德国 Sartorius公司产品;Mettler M3型分析天平 (d= 0.001 mg):瑞士Mettler-Toledo公司产品;RE-51旋转蒸发仪:上海亚荣生化仪器厂产品。
Finnigan MA T 900双聚焦扇形场质谱仪:美国热电公司产品;Finnigan Trace气相色谱:美国热电公司产品,配有AS 2000自动进样器; DB-5石英毛细管色谱柱(30 m×0.25 mm× 0.25μm):美国J&W公司产品。
二氯甲烷(色谱纯):德国Merck公司产品;丙酮(农残级):美国Fluka公司产品;环己烷(农残级):美国 Tedia公司产品;Florisil固相萃取小柱:Supeclean,3 mL;6种 PAHs标准溶液:由中国计量科学研究院提供;同位素标记物:6种氘代-多环芳烃溶液均购于美国 Cambridge Isotope公司。
1.2 仪器条件与检测方法
1.2.1 气相色谱条件 载气(高纯氦气)流速: 1.0 mL·min-1;进样口温度:280℃,分流进样;分流比:20∶1;进样量:1μL;程序升温:初始温度70℃,保持1 min,以35℃·min-1升温至220℃,再以3℃·min-1升温至280℃,保持25 min。
1.2.2 质谱条件 电子轰击(EI)离子源,离子源温度250℃,电子能量70 eV,灯丝发射电流0.55 mA,电子倍增检测器电压1.7 kV,分辨率2 500(10%峰高)。
1.2.3 检测方法 在多离子检测(MID)模式下测量,采用FC43的碎片峰作为高分辨质谱质量锁定和质量校正标准,针对6种 PAHs设定不同的检测窗口,分别测定其离子强度,每个MID窗口检测2个离子,包括目标物离子和相应的同位素标记物离子,具体条件列于表1。

表1 6种PAHs多离子检测(MID)的选择离子质量与出峰时间Table 1 Selected mass and retention time of 6 PAHs by multi-ion detection(MID)
1.3 样品前处理方法
1.3.1 提取 称量1 g冻干鱼粉和1 g煅烧过的无水硫酸钠,混匀后加到提取筒中,并将100~200μg·kg-16种氘代多环芳烃的混合溶液加入到混合样品中,50℃索氏提取18 h。
1.3.2 净化 由于鱼肉基体中含有大量的脂肪、蛋白等干扰物,故将提取液在浓缩后进行凝胶排阻色谱(GPC)和固相萃取(SPE)净化。
将提取液浓缩至约0.5 mL后,完全转移至GPC,用二氯甲烷作为淋洗液,以 3.5 mL·min-1速度淋洗,收集14~34 min的流出液。将收集的流出液浓缩后,进行 SPE净化。固相萃取小柱先用4 mL丙酮清洗并抽干,再用4 mL二氯甲烷活化小柱,将样品提取液转移到小柱上,用5 mLV(环己烷)∶V(二氯甲烷)= 1∶1的溶液洗脱。接收液用氮气吹至浓缩后,进行GC/MS测定。
2 结果与讨论
2.1 GPC净化条件优化
GPC是基于试样分子的尺寸和形状不同来实现分离的。在本实验中,凝胶渗透色谱主要用于除去鱼组织提取液中的大部分油脂和色素等大分子,以减少有机质对目标化合物的干扰。分别选择V(乙酸乙酯)∶V(环己烷)=1∶1的溶液和二氯甲烷作为流动相,通过对比2种流动相在不同时间的洗脱效率对GPC净化条件进行优化。对浓度为500μg·g-1的6种 PA Hs混合溶液进样0.5 mL,淋洗速度为3.5 mL·min-1,接收0~36 min的淋洗液,每隔2~3 min收集1次,浓缩后进行检测,结果示于图1和图2。
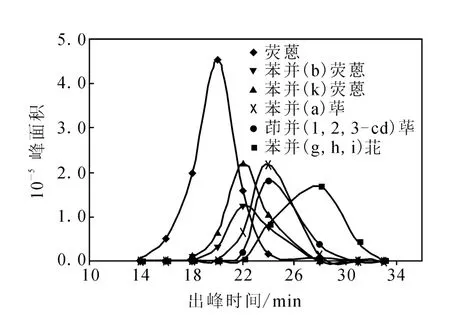
图1 以V(乙酸乙酯)∶V(环己烷)=1∶1的溶液为流动相的6种PAHs的洗脱曲线Fig.1 The eluted curve of 6 PAHs by V(acetacetate)∶V(cyclohexane)=1∶1

图2 以二氯甲烷为流动相的6种PAH s的洗脱曲线Fig.2 The eluted curve of 6 PAH s by dichloromethane
由图中可以看出,使用V(乙酸乙酯)∶V (环己烷)=1∶1的溶液作为流动相,6种PAHs洗脱时间相差较大,收集时间约为20 min,选择二氯甲烷作为流动相,6种PAHs几乎在同一段时间被洗脱,收集时间缩短到10 min,故选择二氯甲烷作为GPC洗脱6种PAHs的流动相。
2.2 SPE条件优化
2.2.1 洗脱液种类的选择 根据溶液极性的不同,在氟罗里土固相萃取小柱上洗脱强度不同的原理,按溶液极性大小分别选择V(正己烷)∶V(二氯甲烷)=1∶1,V(正己烷)∶V(丙酮)= 1∶1,V(正己烷)∶V(甲苯)=1∶1, V(环己烷)∶V(二氯甲烷)=1∶1混合溶剂作为洗脱液,使用0.5 mL浓度为500μg·g-1的6种PAHs混合溶液上样,采用6 mL溶液进行洗脱,收集洗脱液浓缩后,添加内标,用气相色谱-质谱进行测定,结果表明,采用V(环己烷)∶V(二氯甲烷)=1∶1混合溶液作为洗脱液,得到的6种PAHs回收率最高,故选择V(环己烷)∶V(二氯甲烷)=1∶1混合溶液作为洗脱液。
2.2.2 洗脱液比例的选择 由于不同的洗脱液比例会影响洗脱效果,故分别采用V(环己烷)∶V(二氯甲烷)为1∶9、1∶4、3∶7、1∶1、7∶3、4∶1、9∶1的混合溶剂进行洗脱,添加内标后,进行气相色谱-质谱测定。以回收率为纵坐标,6种PAHs的洗脱溶剂比例为横坐标,结果表明V(环己烷)∶V(二氯甲烷)=1∶1为较理想的洗脱液比例。
2.3 质谱条件的优化
采用高分辨质谱以多离子检测的方式测定,在MID模式下测量,采用PFK的碎片峰作为高分辨质谱质量锁定和质量校正标准,针对6种PAHs及其同位素稀释剂设定不同的检测窗口,分别测定其离子流强度。
2.3.1 选择离子 多环芳烃的基峰强度最高,选择其为检测的特征离子。
2.3.2 分辨率 分别采用 R=1 000、R= 2 500、R=5 000、R=10 000分辨率对含有低浓度PAHs的鱼肉萃取样品进行检测,当分辨率R=2 500时,基体干扰较小,而且信号强度较高,信噪比最好。进一步提高分辨率,可以减少干扰,但样品信号强度下降,因此选择 R= 2 500。
2.3.3 离子源温度 提高离子源温度,有利于提高多环芳烃的检测灵敏度,综合考虑离子源加热丝寿命等因素,选择离子源温度为250℃。
2.4 定量方式的选择
本实验采用同位素稀释质谱单点校正法定量,定量公式如下:

式中:RSM为样品溶液目标峰面积与标记物峰面积的比值;RCM为标准溶液目标峰面积与标记物峰面积的比值;Ccalib为标准溶液的浓度; Mspike(sample)为加入样品中的标记物的质量; Cspike(calib)为加入标准溶液中的标记物的浓度; Msample为样品质量;fpurity为标准品的纯度;fdry为样品干燥后与干燥前质量的比率。
为了保证测定结果的准确性,同位素稀释质谱单点法测定的标准溶液浓度及添加到样品中的同位素稀释剂浓度应与被测样品溶液的浓度相近。故先经过初步测试,用单点校正法计算样品中多环芳烃的大概浓度,得到一个初步测试值。根据初步测试值,精确配制一个与此浓度接近的混合标准溶液,并在样品和标准溶液中根据1∶1的比例添加标记物,用本工作建立的流程进行分析,单点校正法计算样品中多环芳烃的浓度。
2.5 回收率、精密度与检出限
取空白冻干鱼组织样品,分别添加浓度水平相当于100、20和5μg·g-1的6种PAHs混合溶液,按上述方法重复分析,得到的精密度与回收率列于表2。降低添加浓度水平,相当于10 μg·g-1和5μg·g-1的 PAHs混合溶液,以3倍信噪比为最小检出限,结果列于表2。

表2 鱼组织样品中6种PAHs的回收率、精密度与检出限Table 2 The recovery,RSD and detection limit of 6 PAHs in freezing dry fish tissue sample
2.6 样品测定
应用本实验方法测定冻干鲅鱼、梭子鱼和鳕鱼组织样品中的6种PAHs,得到的结果列于表3。样品中6种PAHs及同位素的提取离子质谱图示于图3。
2.7 测量结果的不确定度分析
根据2.4中的计算公式,测量结果的不确定度主要来源于仪器测量的标准偏差、标准溶液的不确定度和样品称量的不确定度等,相对分子质量、温度、湿度等引起的测量不确定度可忽略不计。
仪器测量的不确定度包括测试过程中的随机误差,体现为测量结果的标准偏差,记为Ua;标准溶液的不确定度来源于溶液标准物质,由标准物质证书上的标准不确定度获得,记为Ub;样品称量不确定度,记为Uc,根据检定证书和称量次数估算,天平称量带来的不确定度为0.5%。合成3个不确定度分量Ua、Ub和Uc,取包含因子k=2,故扩展不确定度表示为:
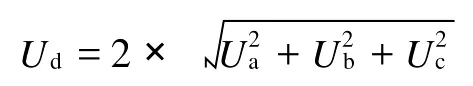
每个样品的不确定度评估结果列于表3。
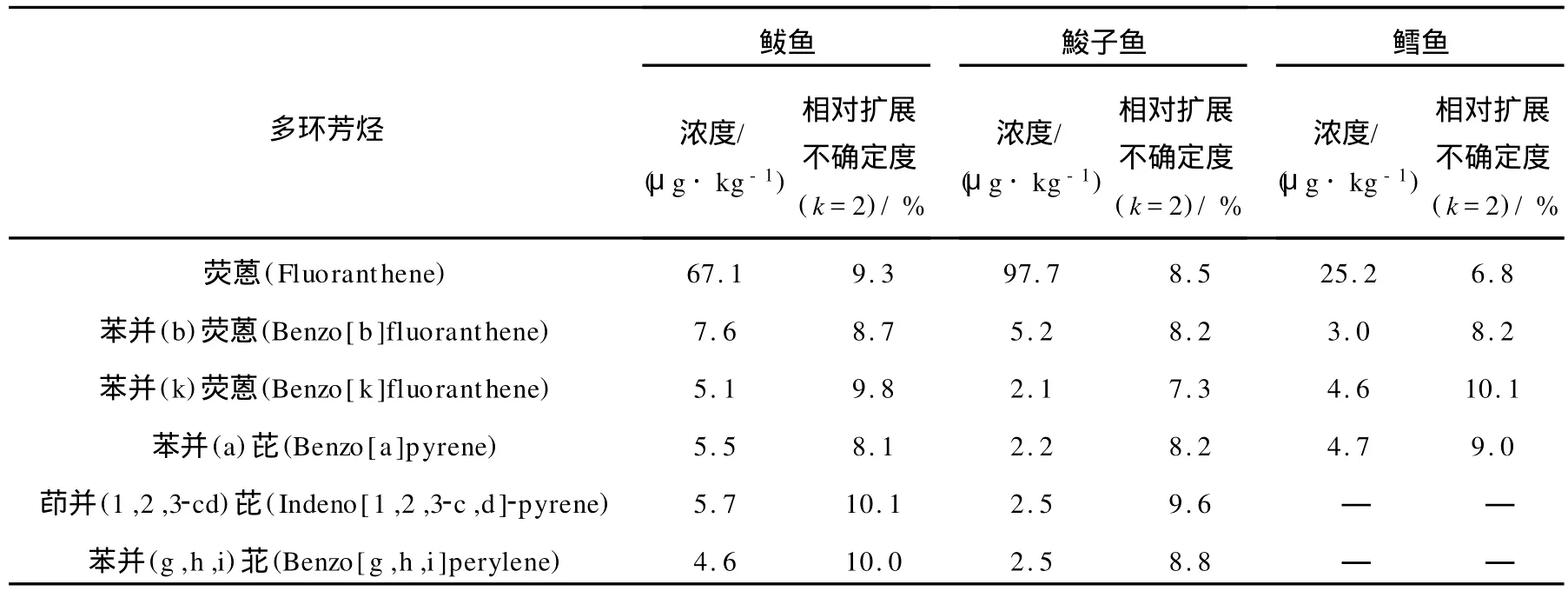
表3 冻干鲅鱼、梭子鱼和鳕鱼组织样品中6种PAHs含量的测定结果Table 3 Results of 6 PAHs in freezing dry spanish mackerel,barracuda and cod tissue

图3 鲅鱼样品中6种PAHs及其同位素提取离子质谱图Fig.3 GC-HRMS MID chromatogram of 6 PAHs in freezing dry spanish mackerel
3 结 论
采用气相色谱-双聚焦高分辨磁式质谱联用仪开发了同位素稀释质谱法测定鱼组织中6种PAHs的检测方法。冻干后的鱼肉样品经过添加同位素稀释剂、索氏抽提、凝胶渗透色谱和固相萃取净化、浓缩等前处理步骤,采用高分辨多离子检测方式,将目标物质量精确到小数点后4位,从而最大可能地排除相同整数位质量数的干扰离子,大大降低了背景噪声,显著提高了测量的灵敏度和选择性。结果表明,该方法准确、可靠、灵敏度高,可对鱼类样品中痕量PAHs的确证和准确检测提供可靠的技术支持。
[1]宋冠群,林金明.环境样品中多环芳烃的前处理技术[J].环境科学学报,2005,25(10):1 287-1 296.
[2]HARKOV R,GREENBERG A,DARACK F. Summertime variations in polycyclic aromatic hydrocarbons at four sites in New Jersey[J].Environ Sci Technol,1984,18(4):287-291.
[3]赵文昌,程金平,谢海赟,等.环境中多环芳烃(PAHs)的来源与监测分析方法[J].环境科学与技术,2006,29(3):105-107.
[4]BAUMARD P,BUDZINSKI H,GARRIGUES P. PAHs in Arcachon bay,France:origin and biomonitoring with caged organisms[J].Marine Pollution Bulletin,1998,36(8):557-586.
[5]ANYAKORA C,OGBECHE A.Determination of polynuclear aromatic hydrocarbons in marine samples of Siokolo Fishing Settlement[J].J Chromatogr A,2005,1 073(1/2):323-330.
[6]MEADOR J P,STEIN J E,REICHERT W L. Bioaccumulation of polycyclicaromatic hydrocarbons by marine organisms[J].Rev Environ Contam Toxicol,1995,143:79-165.
[7]LAW R J,KELL Y C,BAKER K.Toxic equivalency factors for PAH and their applicability in shellfish[J].Journal of Environmental Monitoring,2002,4:383-388.
Determination of Six Polycyclic Aromatic Hydrocarbons in Fish Tissue by Isotope Dilution GC/HRMS
TANG Hua1,CHEN Da-zhou1,WU Xue1,XU Rui-feng1, ZHONG Shi-lin1,SHAO Ming-wu1,WANG Tan2
(1.N ational Institute of Metrology,Beijing100013,China; 2.Beijing Center f or Physical and Chemical A nalysis,Beijing100089,China)
An isotope dilution mass spectrometry(IDMS)method for the determination of 6 polycyclic aromatic hydrocarbons(PAHs),including fluoranthene,benzo[b]fluoranthene, benzo[k]fluoranthene,benzo[a]pyrene,benzo[g,h,i]perylene,indeno[1,2,3-c,d]-pyrene,in freezing dried fish tissue was established.6 PAHs were extracted with dichloromethane by soxhlet extraction under 50℃for 18 h.Purification of extracts was carried out by gel permeation chromatography(GPC)and solid phase extraction(SPE).Dichloromethane was chosen as mobile phase after comparing the eluting effect of 6 PAHs with V(ethyl acetate)∶V(cyclohexane)=1∶1,and V(cyclohexane)∶V(dichloromethane)= 1∶1 was chosen as eluting solution of SPE after optimizing the type and ratio of eluting solution.6 PAHs were separated by capillary column DB-5(30 m×0.25 mm×0.25μm)withhelium as carrying gas.6 PAHs were quantified by high resolution mass spectrometry multi-ion detection(HRMS-MID),using deuterated PAHs as internal standards,single point method.The recoveries of 6 PAHs are in the range of 95%—105%.The detection limits of 6 PAHs are 0.8—1.6μg·kg-1(dry weight).The RSD(n=6)ranges from 1.7% to 6.0%.The methods was applied to three fish sample,the spectrum of the sample showed the little inference and ideal sensitivity of the method.With good sensitivity and accuracy,this method will be successfully applied to the qualitative and quantitative analysis of fish tissue sample.
isotope dilution mass spectrometry(IDMS);polycyclic aromatic hydrocarbons (PAHs);fish tissue;gel permeation chromatography(GPC);solid phase extraction(SPE)
O 657.6
A
1004-2997(2010)04-0208-06
2009-11-25;
2010-03-22
国家质量监督检验检疫总局食品安全专项(SPAQ06-4)资助
汤 桦(1977~),女(汉族),山东人,工程师,从事食品安全与环境中有机污染物的质谱分析研究。E-mail:tanghua@nim.ac.cn
