重组弓形虫致密颗粒蛋白7的表达及免疫活性分析
2010-08-30袁仕善孙文霞唐小异
袁仕善,孙文霞,陈 婧,唐小异,鄢 慧
(湖南师范大学医学院检验系,湖南 长沙 410006)
重组弓形虫致密颗粒蛋白7的表达及免疫活性分析
袁仕善,孙文霞,陈 婧,唐小异,鄢 慧
(湖南师范大学医学院检验系,湖南 长沙 410006)
目的:重组表达弓形虫致密颗粒蛋白7(GRA7),分析其免疫活性。方法:采用聚合酶链反应(PCR)从刚地弓形虫基因组DNA中扩增GRA7基因,经克隆和测序分析后,亚克隆至表达载体pET-23a(+),转化大肠埃希菌BL21,异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达GRA7,用His-bindTM亲和层析柱纯化,免疫印迹和小鼠免疫分析其抗原性。结果:PCR扩增出大小约660bp的GRA7基因片段,并被亚克隆到原核表达载体pET-23a(+),构建了原核重组表达质粒pET-GRA7;表达纯化获得分子量约29,000的重组GRA7;重组GRA7能被弓形虫感染兔血清所识别,并诱导小鼠产生抗体滴度达1:12800。结论:获得了具有良好免疫学活性的重组抗原GRA7。
弓形虫;致密颗粒蛋白7;表达;抗原性
弓形虫是寄生于人体和许多动物组织细胞的机会致病性原虫,可侵犯脊椎动物的多种细胞,并在细胞内繁殖,最后破坏宿主细胞,释放出虫体,导致一系列病理变化。弓形虫病已成为一个世界性的公共卫生问题,引起了医学界和兽医学界的高度重视。建立灵敏特异的弓形虫病诊断方法,研制弓形虫疫苗,对有效控制弓形虫感染、提高人口素质具有重要意义。致密颗粒蛋白7(GRA7)是一种分子量为29kDa的弓形虫致密颗粒蛋白,可诱导机体产生粘膜免疫和全身免疫,对弓形虫病具有一定的保护作用,被认为是一种有潜力的疫苗候选分子[1];并能刺激机体强烈的抗体应答,是一种诊断弓形虫感染的有效抗原[2]。本文利用原核表达载体pET-23a(+)构建GRA7的原核重组表达质粒,并予表达、纯化和免疫活性分析,以期为弓形虫GRA7用于弓形虫病诊断和疫苗研究奠定基础。
1 材料与方法
1.1 虫株和实验动物
刚地弓形虫RH株由武汉大学基础医学院寄生虫学教研室何立教授赠送。雄性昆明鼠,体重202克,由湖南农业大学实验动物中心提供。
1.2 菌株、质粒 表达载体pET-23a(+)及大肠埃希菌JM109和BL21由本室保种。pMD18-T载体购自大连宝生物工程公司。
1.3 仪器与试剂
TC-412型PCR仪系英国TECHNE公司生产;5840R型高速冷冻离心机系德国Eppendorf公司生产。DYCZ-240型电泳槽、DYCZ-400型转印槽、DYY-12C型三恒多功能电泳仪电源系北京六一仪器厂生产。丙烯酰胺、甲叉双丙烯酰胺、琼脂糖、十二烷基硫酸钠(SDS)、蛋白酶K、异丙基-β-D-硫代半乳糖苷(IPTG)系美国Amresco公司产品;标准分子量 DNA、TaqDNA聚合酶、pMD18-T载体、T4DNA连接酶。限制性核酸内切酶BamH I和SalI、DNA的胶回收纯化试剂盒系大连宝生物工程公司产品。预染标准分子量蛋白质系美国 New England Biolabs公司产品。质粒DNA小量提取试剂系北京赛百盛基因技术有限公司产品。His-Binding Resin系美国Novogen公司产品。硝酸纤维素(NC)膜系美国Bio-rad公司产品。HRP标记的羊抗兔IgG系美国PIERCE公司产品。DAB显色试剂盒系北京中杉金桥生物技术有限公司产品。其它试剂系国产分析纯。
1.4 弓形虫感染兔血清的制备
取约100个弓形虫速殖子,腹腔接种健康家兔,每天观察其症状,于第30d重复接种一次,第60d时心脏采血,分离血清,-20℃保存备用。
1.5 弓形虫速殖子基因组
DNA的提取弓形虫速殖子感染健康小鼠3天后,从小鼠腹水中收集弓形虫速殖子,PBS洗涤,重悬于0.2mL含1%SDS的STE(pH8.0的10mmol/L Tris-HCl、1mmol/L EDTA、0.15mmol/L NaCl)液中,补加蛋白酶K至0.1mg/mL,37℃消化过夜;用等体积的饱和酚、饱和酚氯仿、氯仿各抽提一次,无水乙醇沉淀DNA,溶于TE中,-20℃冻存备用。
1.6 GRA7基因的体外扩增和克隆
使用如下引物:引物F:5'—GGATCC GCCAC CGCGTCAG—3',引物R:5'—GTCGAC GCGGGCATCCTC—3'。以弓形虫基因组DNA为模板扩增反应条件为:94℃预变性 5min;94℃变性 30sec,58℃退火30sec,72℃延伸1min,共35个循环;72℃延伸5min、1%琼脂糖凝胶电泳分离PCR产物、切胶回收,与T载体pMD18-T于16℃连接过夜,转化大肠埃希菌JM109感受态细胞,菌落PCR和质粒DNA序列分析鉴定阳性菌株。
1.7 GRA7原核表达质粒的构建
扩增阳性克隆的菌株和含pET-23a(+)的菌株,抽提并纯化含正确的插入片段的pMD18-T的质粒和pET-23a(+)质粒,pET-23a(+)质粒用BamH I和SalI进行双酶切,含正确的插入片段的pMD18-T的质粒用 BamH I酶切 6h后,补加 SalI酶切40min,1%琼脂糖凝胶电泳分离,回收目的片段和载体,将酶切后的表达载体和目的片段进行连接,转化大肠埃希菌BL21感受态细胞,质粒DNA小量提取试剂盒抽提质粒DNA,用PCR和部分双酶切鉴定阳性重组子。
1.8 重组GRA7的表达和纯化
将构建好的重组表达菌株于37℃振荡培养过夜,转换新鲜的 LB培养基培养至对数生长期,经IPTG诱导表达 4h,3 500g离心10min,收集菌体;含0.15mol/LNaCl的20mmol/L pH7.9 Tris-HC重悬菌体,反复冻融三次,冰浴超声,4℃,12 000g离心20min,取上清,按照试剂盒使用说明,用HisbindTM柱纯化蛋白,12%SDS-PAGE和免疫印迹分析。血清为1:500稀释的弓形虫感染兔血清,二抗为1:2000的HRP标记的羊抗兔IgG。
1.9 重组蛋白的免疫活性分析
雄性昆明鼠20只,随机分两组,分别为GRA7免疫组和完全弗氏佐剂(FCA)组。于0、2、4周经背部皮下多点注射分别免疫重组GRA7(20μg蛋白和50μL佐剂)和FCA(50μL生理盐水和50μL佐剂)。第 6周采血,以免疫前血清为对照,用 1μg/孔GRA7包板,间接ELISA测定测定抗体滴度,抗体滴度达1:6400以上时,摘眼球采血,收集血清,-20℃冻存。
2 结果
2.1 弓形虫GRA7基因的扩增与克隆
采用PCR技术,扩增出GRA7基因片段,大小约为660bp,与预期目的片段相符(图1)。将菌落PCR鉴定为阳性的两个克隆进行测序,并与Gen-Bank中GRA7基因序列进行比较,发现两个克隆均在同一位置存在同一类型的碱基突变,即183位碱基由A变为T,为同义突变,编码的氨基酸仍为脯氨酸。本文选择2号克隆进行GRA7的重组表达。
2.2 GRA7重组表达质粒的构建
重组质粒经BamHⅠ酶切后用SalⅠ部分酶切以及重组质粒的PCR见图2。由图2可知,部分双酶切和PCR鉴定均出现一条大小约为660bp的电泳带,与理论值大小一致。此外部分双酶切还出现两条分子量大于2000bp的条带,分别为含有外源基因GRA7的重组质粒和切去外源基因GRA7后的载体DNA。
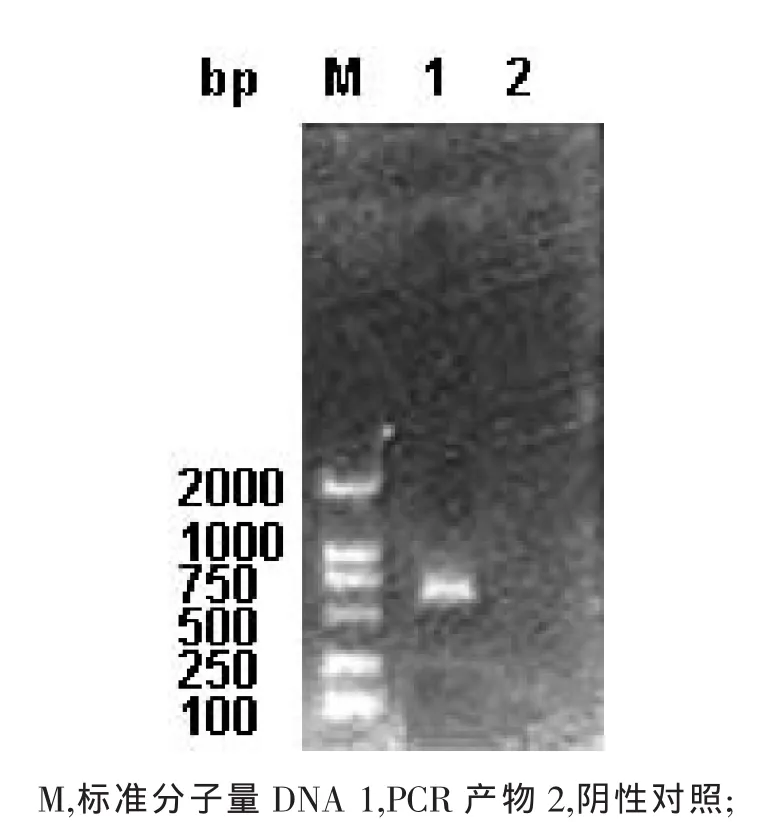
图1 弓形虫RH株GRA7基因PCR扩增
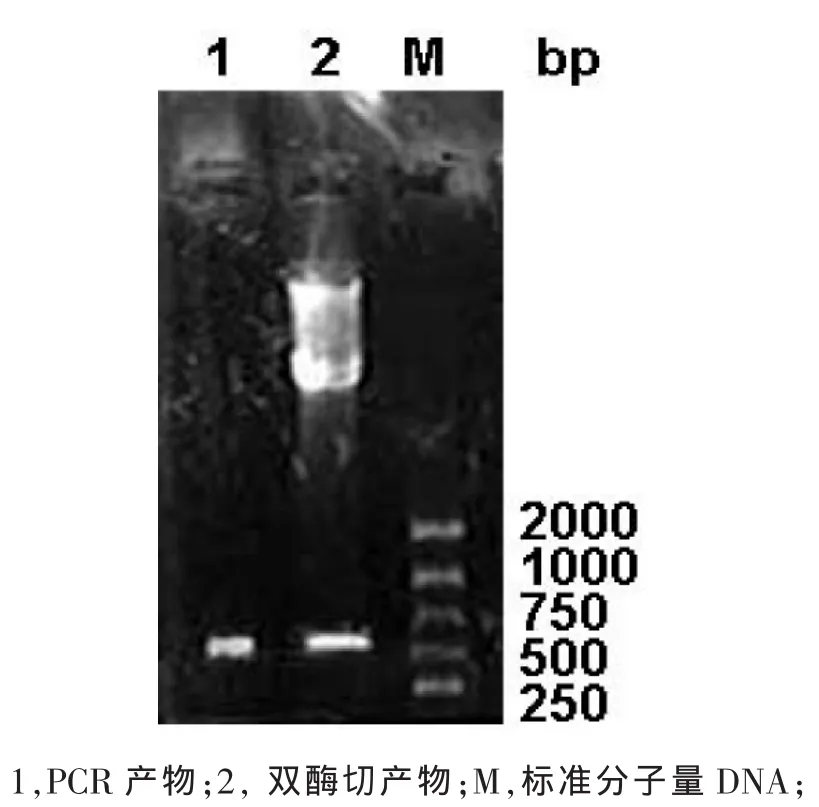
图2 pET-GRA7重组子PCR和酶切鉴定
2.3 重组GRA7的纯化与鉴定
含GRA7的菌体裂解液上清经His-bindTM柱亲和层析后,SDS-PAGE分析显示主要蛋白为GRA7的融合蛋白,分子量约结果见图3。由图3可知,重组GRA7分子量大小的介于25 000至33 000之间,约29 000,与理论值相符。免疫印迹分析表明,纯化的GRA7能被弓形虫速殖子感染兔血清所识别(图4),说明纯化的蛋白具有良好的反应原性。
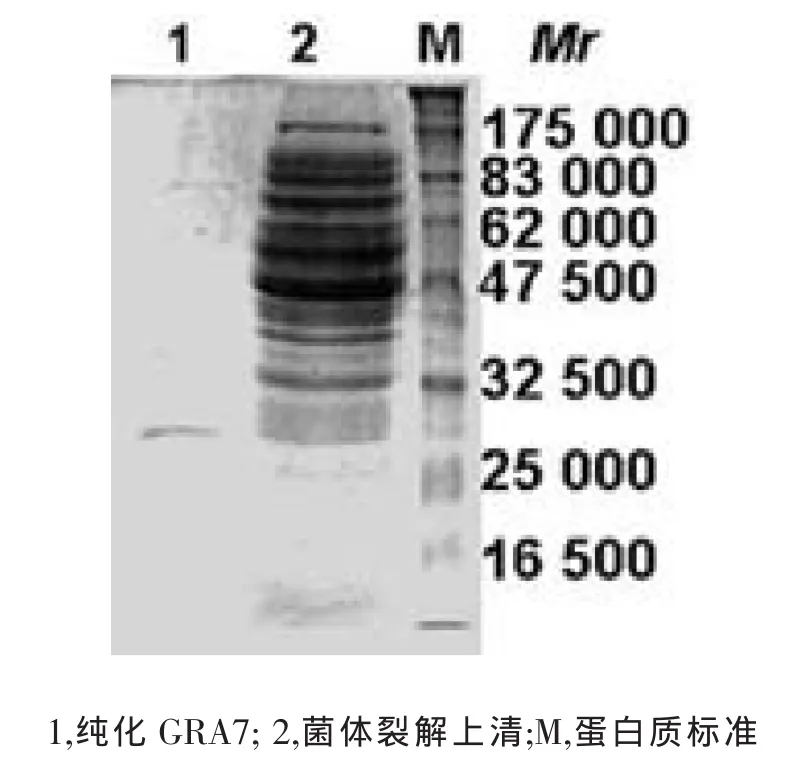
图3 纯化GRA7的电泳图谱
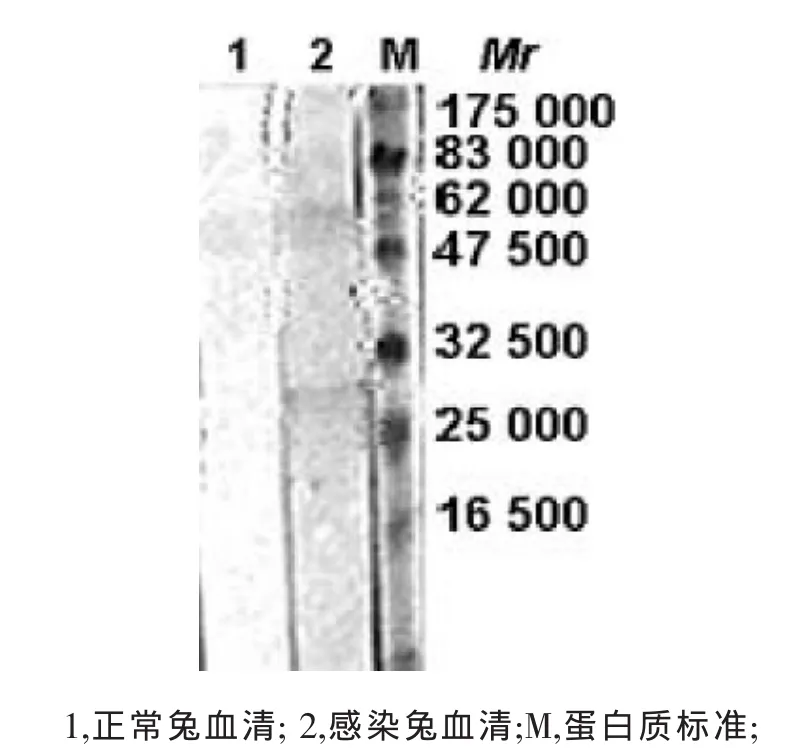
图4 纯化GRA7的免疫印迹图谱
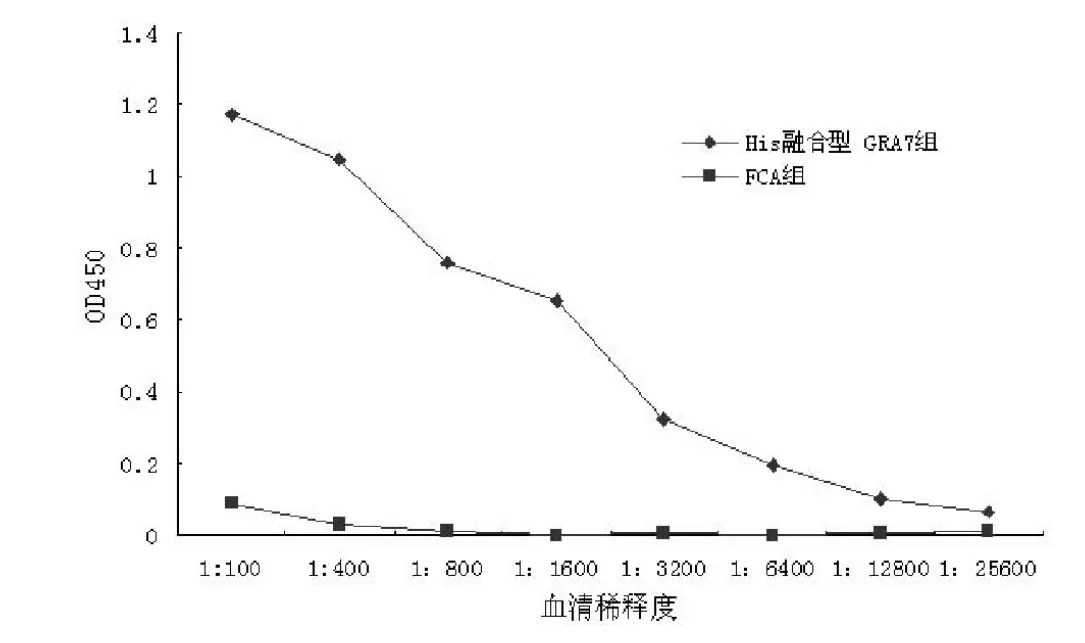
图5 GRA7诱导产生的抗体滴度图Fig.5 antibodies titre induced by recombinant GRA7
2.4 重组GRA7诱导的抗体应答
以免疫前混合血清为对照,用1μg/孔重组GRA7包板,间接ELISA测定测定第三次免疫后各组抗体滴度,结果见图5。由图示可知,当血清稀释度达1:12800时,GRA7组450nm的光吸收值仍明显高于FCA组,表明GRA7诱导产生了较强的抗体应答。
3 讨论
弓形虫感染所致的弓形虫病可造成人和动物多种组织、器官的病变和损伤,并可通过母婴垂直传播而造成胎儿畸形、神经系统发育障碍、脉络膜视网膜炎等,引起流产、早产甚至死胎;对免疫功能低下,例如艾滋病的患者、器官移植后长期使用免疫抑制者、肿瘤化疗者,常是致死的主要病因,引起了医学界和兽医学界的普遍重视。
致密颗粒蛋白(GRA)是弓形虫侵入宿主细胞后由致密颗粒细胞器释放入纳虫泡内的一类分泌代谢抗原[3]。自1989年Cesbron-Delauw等[4]首先报道GRA1以后,诸多学者对致密颗粒蛋白进行了系列的研究,目前已发现致密颗粒细胞器分泌的蛋白有16种,即GRA1-12、两种核苷三磷酸水解酶和两种蛋白酶抑制剂[5-6]。GRA在宿主与寄生虫的相互作用中起重要作用[7,8],对人体和动物具有较强的免疫反应性和免疫原性[9-11],在弓形虫病诊断和免疫预防的研究中受到广泛关注。Bonhomme等[1]和Jacobs等[2]的研究表明,弓形虫感染可产生GRA7的高滴度抗体,且GRA7可诱导强烈的免疫应答,提示GRA7具有良好的免疫原性和反应原性。郑斌等[12]发现弓形虫RH株、ZS2株及GT株的GRA7基因高度保守,序列相同,且重组表达的GRA7具有良好的免疫反应性[13]。Velmurugan等[14]在大肠埃希菌中重组表达了弓形虫GRA7,免疫印迹和酶联免疫吸附测定证明重组GRA7具有良好的反应原性,可用于弓形虫急性感染的诊断。Sadeghiani等[15]重组表达了弓形虫GRA7,免疫印迹分析表明重组GRA7能与弓形虫急性感染人血清反应,与慢性感染血清反应弱,阴性血清无反应,提示重组GRA7可用于研制弓形虫感染的诊断试剂盒。Jongert等[14]发现GRA1和GRA7的质粒DNA混合物免疫小鼠产生高滴度的抗体,产生大量分泌IFN-γ的脾细胞,并使感染小鼠脑包囊负荷下降89%;低剂量单一基因的DNA免疫,仅GRA7诱导 IFN-γ生成并产生强的保护作用,提示GRA7在弓形虫DNA疫苗组成中非常重要,是混合DNA疫苗的主要成分。皮内免疫GRA1和GRA7 DNA疫苗混合物产生高滴度的抗GRA1、GRA7及弓形虫裂解产物的抗体,攻击感染后检测到淋巴细胞增殖和IFN-γ生成,提示DNA疫苗可有效抵抗弓形虫感染[16]。这些研究已证明,弓形虫GRA7是弓形虫病的一种重要诊断抗原和疫苗候选抗原。
本文从弓形虫RH株基因组DNA中扩增到编码GRA7的基因片段,经DNA序列分析与Gen-Bank中登录的序列一致。将GRA7基因片段插入原核表达载体pET-23a(+),成功构建了GRA7的原核重组表达质粒pET-GRA7。经IPTG诱导后,亲和层析纯化获得GRA7的融合蛋白。Western印迹分析发现,纯化的重组蛋白可以被弓形虫感染兔血清所识别,出现阳性反应带,表明表达纯化的重组蛋白具有良好的反应原性;将纯化的重组抗原免疫小鼠,产生了高滴度的抗体,表明重组表达的抗原具有良好的免疫原性。具有良好抗原性GRA7的获得为其用于弓形虫病诊断和疫苗研究奠定了良好的基础。
[1]Bonhomme A,Maine GT,Beorchia A,et al.Quantitative immunolocalization of a P29 protein(GRA7),a new antigen oF Toxoplasma gondii[J].J Histochem Cytochem,1998,46(12):1411-1422.
[2]Jacobs D,Vercammen M,Saman E.Evaluation of recombinant dense granule antigen 7(GRA7)of Toxoplasma gondii for detection of immunoglobulin G antibodies and analysis of a major antigenic domain[J].Clin Diagn Lab Immunol,1999,6(1):24-29.
[3]Tilley M,Ficheram F,Jerom ME,et al.Toxoplasma gondii sporozoites form a transient parasitophorousvacule that is impermeable and contains only a subset of dense granule proteins[J].Infect Immun,1997,65(11):4598-4605.
[4]Cesbron-Delauw MF,Guy B,Torpier G,et al.Molecular characterization of a 23-kilodalton major antigen secreted by Toxoplasma gondii[J].Proc Natl Acad Sci USA,1989;86(19):7537-7541.
[5]Michelin A,Bittame A,Bordat Y,et al.GRA12,a Toxoplasma dense granule protein associated with the intravacuolar membranous nanotubular network[J].Int J Parasitol,2009,39(3):299-306.
[6]Mercier C,Adjogble KDZ,D?ubener W,et al.Dense granules:Are they key organelles to help understand the parasitophorous vacuole of all apicomplexa parasites[J].Int J Parasitol,2005,35(8):829-849.
[7]Cesbron-Delauw MF.Dense granule organelles of Toxoplasma gondii:their role in the host-parasite relationship [J].Parasitol Today,1994,10:293-296.
[8]Ahn HJ,Kim S,Nam HW,et al.Host cell binding of GRA10,a novel,constitutively secreted dense granular protein from Toxoplasma gondii[J].Biochem Biophys Res Commun,2005,3331(2):614-620.
[9]Pietkiewicz H,Hiszczynska-Sawicka E,Kur J,et al.Usefulness of Toxoplasma gondii-Speci.c Recombinant Antigens in Serodiagnosis of Human Toxoplasmosis[J].J Clin Microbiol,2004,42(4):1779-1781.
[10]Aubert D,Maine GT,Villena I,et al.Recombinant antigens to detect Toxpolasma Gondii-specific immunoglobulin G and immunoglobulin M in human sera by enzyme immunoassay[J].J Clin Microbiol,2003,38(3):1144-1150.
[11]Golkar M,Azadmaneshb K,Khalili G,et al.Serodiagnosis of recently acquired Toxoplasma gondii infection in pregnant women using enzyme-linked immunosorbent assays with a recombinant dense granule GRA6 protein[J].Digan Microbiol Infect Dis,2008,61(1):31-39.
[12]郑斌,郑焕钦,何蔼,等.弓形虫不同分离株致密颗粒蛋白基因的序列分析及其在大肠埃希菌中的表达[J].中国寄生虫学与寄生虫病杂志,2005,23(2):100-105.
[13]郑斌,余南,李卓雅,等.弓形虫致密颗粒蛋白基因的表达及其重组蛋白免疫反应性的评价[J].中国人兽共患病杂志,2005,21(2):119-121.
[14]Velmurugan GV,Tewari AK,Rao JR et al.High-level expression of SAG1 and GRA7 gene of Toxoplasma gondii(Izatnagar isolate)and their application in serodiagnosis of goat toxoplasmosis[J].Vet Parasitol,2008,154(3-4):185-192.
[15]Sadeghiani G,Zare M,Babaie J,et al.Heterologous production of dense granule GRA7 antigen of Toxoplasma gondii in Escherichia coli.Southeast Asian[J]J Trop Med Public Health.2009,40(4):692-700.
[16]Jongert E,de-Craeye S,Dewit J,et al.GRA7 provides protective immunity in cocktail DNA vaccines against Toxoplasma gondii[J].Parasite Immunol,2007,29(9):445-453.
[17]J ongert E,Melkebeek V,de-Craeye S,et al.An enhanced GRA1-GRA7 cocktail DNA vaccine primes anti-Toxoplasma immune responses in pigs[J].Vaccine,2008,26(8):1025-1031.
Recombinant Expression and Immunological Activites of Dense Ggranule Antigen 7 from Toxoplasma Gondii
YUAN Shi-shan,SUN Wen-xia,CHEN Jing,TANG Xiao-yi,YAN Hui
(Molecular Lab.of Medical college in Hunan Normal University.Changsha 410013,China)
Objective To express recombinant Toxoplasma gondii(T.gondii)Dense granule antigen 7(GRA7)in E.coli and analyze its immunological activites.M ethods DNA fragment encoding the GRA7 antigen of T.gondii was obtained from the total DNA of T.gondii RH strains by polymerase chain reaction(PCR).The gene was cloned and the DNA sequence was determined subsequently.The gene with correct sequence was subcloned into a expression vector pET-23a(+)and was transformed into Escherichia coli BL21 for expression.The expressed fusion protein induced by IPTG was purified by His-bindTM affinity chromatography,and the purified fusion protein was analyzed by Western-blot and immunization in mice for its antigenicity.Results A 660bp gene fragment encoding GRA7 was amplified by PCR from T.gondii genomic DNA;The insert of GRA7 gene in positive clone was subcloned into pET-23a(+)properly to construct a recombinant expression plasmid pET-GRA7.The fusion protein with molecular weight about 29 000 was purified by His-bindTMaffinity chromatography from lysate of the induced E.coli BL21 containing recombinant expression plasmid pET-GRA7.Recombinant protein GRA7 was recognized by rabbit sera infected with T.gondii tachyzoites and induced antibodies with a titre of 1:12 800. Conclusion Recombinant protein GRA7 with good immunological activites was obtained through cloning and expression.
Toxoplasma gondii;dense granules antigen 7;polymerase chain reaction;expression; antigenicity
R382.5
A
1673-016x(2010)01-0017-05
2009-12-20
湖南省医药卫生科研计划课题(B2005109)
袁仕善,(1968-),男,湖南绥宁人,副教授,主要从事病原分子生物学研究,E-mail:yuanshishan@yahoo.com.cn
