微生物A TP提取方法及其在微波灭菌效果快速评价中的应用研究
2010-08-27叶菁王周平乐国伟施用晖
叶菁, 王周平, 乐国伟, 施用晖
(江南大学食品学院,江苏无锡 214122)
微生物A TP提取方法及其在微波灭菌效果快速评价中的应用研究
叶菁, 王周平*, 乐国伟, 施用晖
(江南大学食品学院,江苏无锡 214122)
本文对ATP发光技术中微生物ATP提取方法进行了优化研究,通过对不同提取剂提取效率的比较,发现苯扎溴铵提取效果好,并且无需稀释,能真实体现微生物细胞内的ATP水平。通过对苯扎溴铵提取时间和提取浓度的优化,结果显示采用体积分数为0.05%苯扎溴铵溶液与菌液混合3~4 min,即可将细胞内的A TP最大限度地释放出来。将该提取方法与ATP生物发光反应体系偶联,实现了对微波灭菌效果的快速评价,在短时间内即可得到可靠结果。试验比较了不同微波功率和微波时间的灭菌效果,实验结果表明,大肠杆菌ATCC25922在用2450 MHz 650 w微波照射60 s时可被完全杀灭,而金黄色葡萄球菌ATCC25923则需70 s才能被杀灭。当用2450 MHz微波同样处理60 s时,650 w即可杀灭大肠杆菌ATCC25922,而金黄色葡萄球菌ATCC25923则需700 w才可被完全杀灭。
生物发光;苯扎溴铵;微波灭菌;快速检测
A TP生物发光技术是一种用于检测样品中有无微生物及其数量的方法。这种方法具有简便、灵敏等特点。ATP生物发光技术的机理是利用虫荧光素酶催化荧光素、三磷酸腺苷(ATP)、和氧气反应,将生物能转化为光能。在荧光素酶催化的发光反应中,ATP在一定浓度范围内,其浓度与发光强度呈线性关系。由于细菌有细胞膜和细胞壁包裹,必须要将其裂解,才能将细胞内的ATP释放出来,因此未经处理的细菌是无法检测其ATP的。目前萃取微生物中ATP的方法很多,主要有:加热、超声、酸、有机溶剂等。选择一种合适的萃取剂和萃取方法,对于测定结果的准确性极其重要。
微波是一种波长为1 mm~1 m(不含1 m)之间的电磁波,其频率较高,介于300~300 000 MHz。由于其频率较高,又称为超高电磁波。消毒与杀菌中常用的是915 MHz与2 450 MHz微波,微波最早用于加热与干燥,后发现具有杀菌效能。微波基于其热效应和非热效应,逐渐用于消毒和灭菌方面[1]。
Webster等国外学者利用生物发光快速、灵敏、重复性好等优点,建立ATP生物发光法快速评定高压灭菌效果的方法[2],克服了传统平板培养耗时长,不能立即判定结果的缺点。本文将生物发光技术扩大到快速检测微波灭菌效果上,分别用大肠杆菌、金黄色葡萄球菌制备成生物指示剂测试管,进行微波灭菌测试,再用生物发光法测定指示菌短期增菌培养物中ATP的释放量来判定灭菌效果。结果与传统平板培养法试验结果一致。
1 材料与方法
1.1 实验材料与试剂
大肠杆菌ATCC25922、金黄色葡萄球菌菌株ATCC25923,为本实验室保存。将受试菌用营养肉汤培养至OD600为0.3~0.4,4℃保存备用。
重组虫荧光素,重组虫荧光素酶均为Promega公司产品。ATP标准品购于Amresco。苯扎溴铵(新洁尔灭)购于上海运佳黄浦制药有限公司,三氯乙酸(以下简称TCA)购于国药集团化学试剂有限公司。缓冲体系采用Tris-HCl(p H=7.4)。其他试剂均为国产分析纯。
1.2 仪器
电子天平(METTL ER TOL EPQ AB204-N); PH计(METTLER TOLEPQ);不锈钢自动手提式压力蒸汽灭菌锅:上海申安医疗器械厂产品;隔水式恒温培养箱:宁波机电工业研究设计院;标准型净化工作台:苏净集团苏州安泰空气技术有限公司;迴转式恒温调速摇瓶柜:上海新蕊自动化设备有限公司;电脑型变频微波炉:松下;MPI-B型多参数化学发光分析测试系统:西安瑞迈分析仪器有限公司。
1.3 实验方法
1.3.1 提取剂及提取方法的选择
1)微生物ATP提取方法的选择
(1)TCA法:将0.5 mL菌液与等体积预冷的0.03 g/mL的TCA混合,振摇3 min后加入20倍体积的缓冲液加以稀释,以终止其反应。
(2)氯仿提取法:按参照文献[3]对样品进行提取。
(3)苯扎溴铵提取法:取100μL 5×10-4g/mL的苯扎溴铵溶液与等体积的菌液混合3 min。(为了使结果有可比性,将用氯仿和苯扎溴铵提取得到的ATP同样稀释20倍)。
取100μL上述提取剂与菌液的混合液,加入到400μl酶反应液(1×10-6mol/L虫荧光素酶,5× 10-6mol/L荧光素,25 mmol/L tris-HCl缓冲液,1 mmol/L Mg2+)中,立即放入MPI-B型多参数化学发光分析测试系统中测定BL发光值。
2)提取剂浓度的优化 配制不同浓度的苯扎溴铵溶液(5×10-5、1×10-4、5×10-4、1×10-3、2× 10-3、4×10-3g/mL),取100μL提取剂与等体积的受试菌液混合3min后,以同样的方法测定BL发光值。
3)提取时间的选择
取100μL 5×10-4g/mL的苯扎溴铵溶液,与等体积的受试菌液混合不同的时间(1、2、3、4、5min)后,用同样的方法测定BL发光值。
1.3.2 微波灭菌测试
1)灭菌时间对灭菌效果的影响
用2 450 MHz650W微波对受试菌液进行不同时间的照射(40、50、60、70、80、90、100、110 s),处理后的菌液在无菌条件下分为3组:第一组制成纯细胞悬液(4℃存放)作本底测定用;第二组菌液接种到平板上37℃培养24 h作为对照;剩余菌液进行摇床培养7h后以同样的方法制成纯细胞悬液进行生物发光检测。
2)灭菌功率对灭菌效果的影响
固定灭菌时间为60s,用2 450 MHz微波变换不同功率(1 000、820、700、650、500 w)处理菌液,处理后的菌液以同样的方法制成纯细胞悬液以及进行平板培养。
1.3.3 生物发光测定 由于荧光素酶对反应体系条件要求严格,作者做了一些前期工作,对荧光素酶的最适反应体系进行了研究,包括缓冲液的种类、离子强度、p H、金属离子的种类以及浓度,最适的反应温度等。由于荧光素、荧光素酶价格昂贵,为节约成本,故对两者的最低反应浓度也做了摸索,在试验中所用的酶反应体系为25 mmol/L tris-HCl作为缓冲体系,p H 7.4,Mg2+浓度为1 mmol/ L,虫荧光素酶浓度为1×10-4mol/L,虫荧光素浓度为5×10-4mol/L,最适反应温度为25℃。
取100μL0.05%的苯扎溴铵溶液与等体积的菌液混合3~4 min(大肠杆菌菌液混合3min,金黄色葡萄球菌混合4 min)后,取100μL上述混合液置于石英发光小管中,加入400μL酶反应液在MPI-B型多参数化学发光分析测试系统中测定BL发光值。
2 结果与讨论
2.1 提取剂及提取方法的选择
目前常用的提取细菌中ATP的方法主要是加热、加热超声、酸、有机溶剂等。有文献[4]报道超声加热提取ATP的效果最佳,加热次之,它们对于ATP分析的抑制较小,萃取率高,但需要附加设备,操作繁琐,难于推广。超声方法的淬取效果尚可,但不能使apyrase变性,故会水解微生物A TP,从而使检测得到细菌ATP水平较实际水平大为降低。国外文献[5-8]报道采用阳离子表面活性剂,特别是季胺盐类阳离子表面活性剂如苯扎氯铵(BAC),苯扎溴铵(BAB)作为细菌细胞ATP提取剂的主要成分,并且证明在提取ATP效果上上述两种消毒剂与常用的TCA法同样有效,并且无需稀释,因此这种提取方法最能真实反应细胞中的ATP水平,测定结果更为准确。
本文对TCA提取法、苯扎溴铵提取法以及常用的氯仿提取法提取细菌ATP的效果进行了比较,结果如图1。

图1 不同提取方法提取细菌ATP的效果Fig.1 ATP extracted effects with different extraction methods
试验结果表明氯仿的淬取效率最低,可能是由于氯仿无法使apyrase变性而水解细菌ATP,使检测到的ATP水平较实际值低。TCA提取法与苯扎溴铵提取法效果相近,但是由于TCA对荧光素酶体系有很强的抑制作用,故需要大量稀释才可检测发光值,无法真实反应细胞的ATP水平,故本试验采用苯扎溴铵作为细菌ATP的提取剂。
提取剂的浓度除了对发光反应的稳定性有影响外,还对细菌ATP的提取效果有很大的影响,图2表明BAB提取两种细菌细胞内ATP的适宜浓度范围,其中两种细菌的OD600值分别为:大肠杆菌0.421,金黄色葡萄球菌0.386。

图2 BAB浓度对提取两种细菌ATP效果的影响Fig.2 Effect of BAB concentration on the ATP extraction from two kind of bacteria
实验结果表明,BAB提取大肠杆菌和金黄色葡萄球菌细胞内ATP的最适浓度均为5×10-4g/ mL,故在后续实验中,采用5×10-4g/mL苯扎溴铵溶液作为ATP提取剂。
BAB需要一定的时间才能达到杀菌的目的,其与细菌混合的时间和提取细菌内ATP的效率有关,同时与被提取的细胞内ATP的降解过程也有关系,因此,每次生物发光反应中加入ATP提取剂与加入虫萤光素一萤光素酶之间的时间间隔必须保持一致,否则将影响实验结果的重复性。5× 10-4g/mL BAB与细菌的作用时间对生物发光反应强度的影响见图3,其中两种细菌的OD600值分别为:大肠杆菌0.443,金黄色葡萄球菌0.408。

图3 BAB作用时间对提取细菌ATP的影响Fig.3 Effect of BABtreatment time on the ATP extraction from bacteria
试验结果表明,对不同种类的细菌提取ATP,所需的最适时间不同,对于大肠杆菌,提取时间为3min,而提取金黄色葡萄球菌A TP的最适时间为4min。
2.2 微波灭菌测试
根据Webester等报道,细菌经灭菌处理后,如灭菌不彻底(只要达到100 cfu/L活菌存在),残余活菌在适宜的条件下,经过迟缓期后进入对数生长期,释放ATP的细菌数将以几何级数增大。因此,孵育5h即可观察到生物发光值的大幅度提高。但作者通过试验发现,孵育5 h并不能观察到A TP的明显增加,故延长孵育时间至7 h。
2.2.1 灭菌时间对灭菌效果的影响
2 450 MHz,650 w的微波处理两种供试菌株时(结果如图4,图5),不耐热的大肠杆菌在60 s时已全部被杀灭;而金黄色葡萄球菌在70 s之后才完全被杀灭。实验结果表明,用微波灭菌的效率高,操作简便。并且随灭菌时间的延长,细菌的死亡率明显增加,在较短的时间内即能完全杀灭细菌。以24h平板培养试验作为对照,结果一致。

图4 微波效果评价(大肠杆菌)Fig.4 Evaluation on the effect of microw ave sterilization(E.coli)
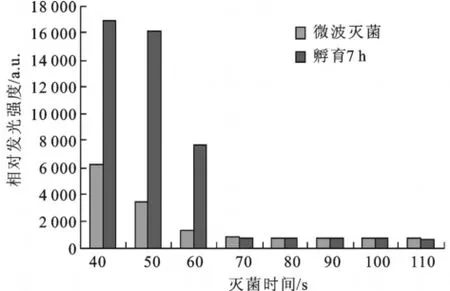
图5 微波效果评价(金黄色葡萄球菌)Fig.5 Evaluation on the effect of microw ave sterilization(S.aureus)
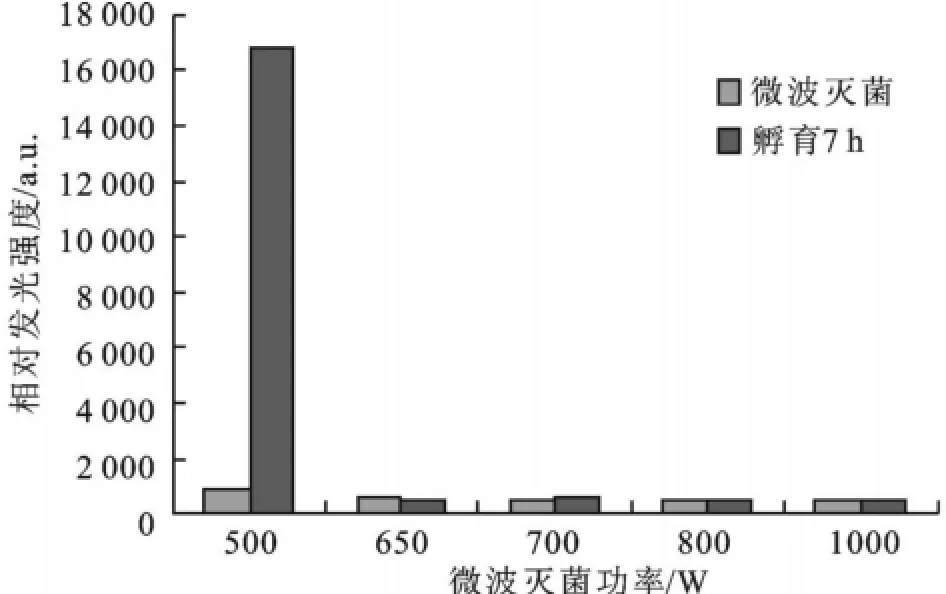
图6 微波灭菌效果评价(大肠杆菌)Fig.6 Evaluation on the effect of microw ave sterilization(E.coli)

图7 微波灭菌效果评价(金黄色葡萄球菌)Fig.7 Evaluation on the effect of microw ave sterilization(S.aureus)
2.2.2 灭菌功率对灭菌效果的影响 固定杀菌时间为60s,用2 450 MHz不同功率(1 000、820、700、650、500 W)的微波照射菌液(结果如图6,图7),在500 W的微波功率下处理60 s,大肠杆菌和金黄色葡萄球菌均未完全杀灭,当用650 W功率微波照射60 s,大肠杆菌完全被杀灭,而金黄色葡萄球菌在用700 W功率微波照射同样的时间后完全被杀灭,杀菌效果明显,并且所需时间短。对照平板培养试验,结果一致。在微生物细胞A TP生物发光法快速检测中,微生物细胞中的A TP从胞内释放出来是关键的第一步,因此选择一种合适的提取剂和提取方法是至关重要的。常用的提取方法有超声,加热,氯仿,TCA法等,由于前两种操作繁琐,需附加设备,因此难于广泛应用,而氯仿法提取效率低,无法真实反应细胞内的A TP水平。TCA法虽然提取效果较好,但其对发光反应体系中荧光素酶活性抑制较大,测定时必须进行大量稀释,这就必然降低检测灵敏度。在国外已渐渐开始使用季胺阳离子表面活性剂作为ATP提取剂,既保持了较高的提取效率,又克服了TCA需大量稀释的缺点,但这一方法在国内未见报道。本试验对苯扎溴铵作为ATP提取剂的提取条件进行了优化,并将其成功应用到生物发光技术中,用以评价微波灭菌效果。
3 结语
微波灭菌以其快速,简便的优点已广泛用于食品、中药、医疗器械等物品的灭菌,在灭菌效果的质量检测方法中,最可靠的就是生物指示剂法,通常被作为灭菌效果的最终鉴别,用以评价灭菌设备、灭菌工艺、灭菌效果的。而传统的平板培养法虽然结果可靠,但是需要的时间长(超过24 h),不能立即判断结果,对于立即使用的物品作为灭菌效果的评价缺乏实际意义。本实验建立s用生物发光法评价微波灭菌效果的方法,通过测定灭菌后孵育7 h后ATP的释放量是否增加来判定灭菌效果。此方法结果可靠,又可在短时间内获得正确的结论,使生物指示剂法在评价灭菌效果的质量监测上更具实际意义。
[1]胡新宇,宁正祥.食品灭菌新技术[J].中国食品工业,2000,7(12),40-42.
HU Xin-yu,NING Zheng-xiang.New technology in food sterilization[J].China Food Industry,2000,7(12):40-42
[2]Webster J J,Bronstin I,Edwards B,et al.Biolumin[J].Chemilumin,1988,2(2):120-125.
[3]RSiragusa G,Dorsa W J,Cutter C N.Biolumin[J].Chemilumin,1996,11(6):297-301.
[4]舒柏华,赵志耀,徐顺清,等.利用生物发光技术快速检测微生物的方法学研究[J].发光学报,1999,20(1),230-231.
SHU Bai-hua,ZHAO Zhi-yao,XU Shun-qing,et al.Study on the rapid bioluminescence assay method for the detection of bacteria[J].Chinese Journal of Luminescence,1999,20(1),230-231.(in Chinese)
[5]Kenichi Noda,Tadahiro Matsuno,Hiroya Fujii,et al.single bacterial cell detection using a mutant lucferase[J].Biotechnol.Letters,2007,30:1051-1054.
[6]AAnsehn S,Lundin A,Nilsson L,et al.Proceedings of international symposium on analytical applications of bioluminescence and chemiluminescence[C].Westlake Village:CA:State Printing&Publishing,1979,438-445.
[7]Siro M,Romar H,Lovgren T.Continuous flow method for extraction and bioluminescence assay of ATP in baker’s yeast [J].Applied Microbiology and Biotechnology.1982,15:258-264.
[8]Kolehmainen S E,Tarkkanen V.Selective determination of nucleotides in viable somatic and microbial cells:US,4,303, 752,[P].1981-05-13.
[9]凌云,赵渝,徐亚同,等.发光细菌法在食品安全性检测中的应用[J].食品与生物技术学报,2005,24(6),106-109.
LING Yun,ZHAO Yu,Xu Ya-tong,et al.Application of photobacteria in food safety inspection[J].Journal of Food Science and Biotechnology,2005,24(6),106-109.(in Chinese)REN Hai-lin,Study on preparation of quaternary alkaloid cationic tapioca starch[J].Journal of QiQiH ar University,2007, 23(3):10-12.(in Chinese)
(责任编辑:杨萌)
[3]刘华,刘温霞,刘谦.阳离子淀粉的制备以及在造纸工业中的应用[J].造纸化学品与应用,2007,(2):32-34.
LIU Hua,LIU Wen-xia,LIU Qian.The preparation and application in the paper-making industry of cationic starch[J]. Hunan PaperMaking,Paper Science&Technology,2007,(2):32-34.(in Chinese)
[4]许开绍,罗军,黄崇杏.AKD专用高分子乳化剂的研制[J].纸科学与技术,2002,21(5):26-29.
XU Kai-shao,LUO Jun,HUANG Chong-xing.The preparation of polymeric emulsifier of AKD emulsion[J].Paper Science&Technology,2002,21(5):26-29.(in Chinese)
[5]沈一丁,李勇进.高取代度阳离子淀粉的制备与应用[J].造纸化学品,2002,(3):9-12.
SHEN Yi-ding,LI Yong-jin.Preparation of the highly substituted cationic starch and its application as the dry strengtherring agent for papermaking[J].Paper Chemicals,2002,(3):9-12.(in Chinese)
[6]陈启杰,陈夫山,王高升.半干法制备高取代度阳离子淀粉[J].造纸化学品,2004,16(1):24-27.
CHEN Qi-jie,CHEN Fu-shan,WANG Gao-sheng.Preparation of cationic starch with high substituted degree using halfdry process[J].Paper Chemicals,2004,16(1):24-27.(in Chinese)
[7]张晓宇,童群义.半干法制备低取代度阳离子淀粉研究[J].食品与生物技术学报,2005,24(5):94-97.
ZHANG Xiao-yu,TONG Qun-yi.Preparations of cationic starch with low degree of substitution using the semi-dry process[J].Journal of Food Science and Biotechnology,2005,24(5):94-97.(in Chinese)
[8]Hassler,Thord G.Paper size and paper sizing process[P].WO 97/35068,1997-09-25
[9]GB1l543-89.表面活性剂乳液的特性测试及其乳化能力的评定方法[S].北京:中国标准出版社,1989.
(责任编辑:朱明)
Optimization and application of ATP Bioluminescence System in the Rapid Evaluation of Microwave Sterilization
YE Jing, WANG Zhou-ping*, L E Guo-wei, SHI Yong-hui
(School of Food Science and Engineering,Jiangnan University,Wuxi 214122,China)
In this manuscript,the extraction method of microorganism ATP used in bioluminescence techniques were studied.According to compare the extract results of different extractants,it was found that that benzalkonium bromide(BAB)is the best extractant to extract all of ATP microorganism cells.The extraction conditions including the extractant concentration and the extaction time were determined and listed as follows:0.05%BAB mixing with bacteria cells for 3-4 min.The finding was applied to rapidly evaluate the effect of microwave sterilization coupling with bioluminescent technology and the reliable results can be obtained within a short time.According to the sterilization effect of different microwave power and sterilization time,we found that E.Coli ATCC25922 can be completely exterminated irrediated by 2 450 MHz 650 w microwave for 60 s but 70 s for Staphylococcus aureus A TCC25923.When treated with 2450 MHz microwave all for 60 s,the power for compelte extermination of E.Coli ATCC25922 is 650w but 700 s for Staphylococcus aureus ATC25923.
bioluminescence,benzalkonium bromide(BAB),microwave sterilization,rapid detection
TL 271.5
:A
1673-1689(2010)02-0172-05
2009-04-16
国家863计划项目(2008AA10Z419),国家自然科学基金项目(20805019),江南大学科学基金项目。
*通信作者:王周平(1974-),男,陕西凤翔人,理学博士,教授,博士生导师,主要从事食品营养与安全分析研究。Email:wangzp@jiangnan.edu.cn
